4-苯基丁酸类似物的设计合成及对PC12细胞内质网应激与过度自噬的抑制作用
范兰兰,孔珊珊,吴彬彬,叶晓霞
温州医科大学 药学院,浙江 温州 325035
4-苯基丁酸(4-phenylbutyric acid,PBA)是一种小分子量的短链脂肪酸,是一种被批准用于治疗小儿遗传性尿素代谢障碍、镰刀形细胞贫血和地中海贫血的临床药物[1-2]。2006年有研究报道PBA作为分子伴侣可以通过抑制内质网应激(endoplasmic reticulum stress,ERS)反应,重塑II型糖尿病鼠血糖稳定[3]。近几年研究表明,PBA可以通过抑制ERS反应,减少氧糖剥夺后的SH-SY5Y细胞的凋亡[4],减少原代海马神经元细胞的损伤[5]、减小骨关节炎关节损伤[6]、减小脑组织缺血性损伤[7]、减少肝细胞损伤和凋亡[8]、治疗II型糖尿病[9]、治疗特发性肺纤维化或肺动脉高压[10]等。
本课题组前期研究发现PBA通过抑制GRP78的表达来缓解ERS,但是与正常细胞中的GRP78表达量相比仍然偏高。能否以PBA为模板,改造其结构,寻找到比PBA作用更强的抑制剂呢?我们尝试设计并合成了11个PBA类似物,并探讨其对PC12细胞过度ERS的抑制作用。
1 材料和方法
1.1 仪器和试剂
1.1.1 仪器:中科牛津-Quantum-Iplus-400M核磁共振波谱仪(CDCl3或DMSO-d6作溶剂);LTQ-Velos 液相色谱质谱联用仪;SHZ-D(III)循环水式真空泵;ZQJ-25手提紫外仪;BSA124S-CW电子天平;DF-101S集热式磁力加热搅拌器;XRS+凝胶成像系统;MX190酶标仪;美国Thermo-6N98二氧化碳培养箱;ALLEGRA-64R低温超速离心机。
1.1.2 试剂:PC12细胞(大鼠肾上腺嗜铬细胞瘤)来源于上海青旗生物科技有限公司,MTT试剂盒购自上海碧云天生物科技有限公司;过氧化氢(H2O2,浓度为30%)、DMSO购自美国Sigma-Aldrich公司;GRP78抗体、LC3抗体、GAPGH内参、Marker试剂购自武汉三鹰生物技术有限公司,乙酸乙酯、甲醇、石油醚、毒胡萝卜素(thapsigargin,TG)、3-甲基腺嘌呤、苯基丁酸等均购自上海阿拉丁生物科技股份有限公司;血清、双抗、胰酶(含EDTA)以及DMEM培养基均购自中国赛默飞世尔科技有限公司。
1.2 方法
1.2.1 化合物A1-A5 的合成:称取4-(氨基苯基)丁酸(1 g,5.61 mmol,1 eq)和三乙胺(1.3 mL,16.73 mmol,3 eq)加入至圆底烧瓶内,加入4 mL二氯甲烷,缓慢滴入乙酰氯(1.2 mL,8.36 mmol,1.5 eq),反应30 min,NaHCO3淬灭,经萃取后将水层pH调至中性,干燥得化合物A1。将A1(0.824 g,3.61 mmol,1 eq)和K2CO3(0.990 g,7.23 mmol,2 eq)溶于DMF中,反应30 min加入溴乙烷(815 μL,10.83 mmol,3 eq),萃取纯化得A2。将A2(0.657 g,2.63 mmol,1 eq)溶于四氢呋喃中,加入NaH(0.189 g,7.91 mmol,3 eq)反应30 min,再加入碘甲烷(141 μL,7.91 mmol,3 eq),萃取纯化得A3。将A3(0.202 g,0.77 mmol,1 eq)溶于2 mL的CH3OH中,加入NaOH(57 μL,3.07 mmol,4 eq),油浴加热120 ℃和80 ℃回流24 h,分别得到A4和A5(见图1)
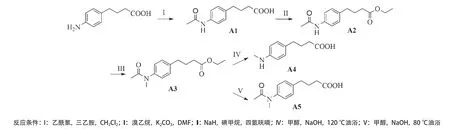
图1 PBA类似物(A1-A5)合成路线及结构
1.2.2 化合物A6-A9的合成:称4-(氨基苯基)丁酸 (1 g,5.61 mmol,1 eq)于10 mL无水乙醇中溶解,滴加浓硫酸(891 μL,16.74 mmol,3 eq),油浴加热70 ℃回流3 h,萃取纯化得化合物A6。称取A6(0.845 g,4.07 mmol,1 eq)于THF中溶解,加入NaH(0.294 g,12.23 mmol,3 eq)反应30 min后,加入CH3I(761 μL,12.23 mmol,3 eq),萃取纯化得化合物A7。称取A7(0.757 g,3.42 mmol,1 eq)于DMF中搅拌溶解,加入K2CO3(1.514 g,10.26 mmol,3 eq)反应30 min后加入CH3CH2Br (771 μL,10.26 mmol,3 eq)或CH3CH2CH2Br (970 μL,10.26 mmol,3 eq),得化合物A8或A9(见图2)。
1.2.3 化合物A10-A11的合成:将A7(1 g,5.61 mmol,1 eq)于浓硫酸(2.409 mL,45.18 mmol,10 eq)中冰浴搅拌5 min后,滴加浓硝酸(2.034 mL,45.18 mmol,10 eq),反应1.5 h后,冰水淬灭,萃取纯化后分别得到化合物A10和A11(见图3)。
1.2.4 PC12细胞培养:PC12细胞生长于DMEM高糖完全培养基中,培养基中含有热灭活的10%胎牛血清和1%的抗生素(100 U/mL青霉素,100 mg/mL链霉素)中,上述细胞均于37 ℃、含5% CO2的恒温加湿培养箱中培养,隔天更换新鲜培养基,待细胞快长满时进行胰酶消化传代,冻存于-80 ℃冰箱保种。
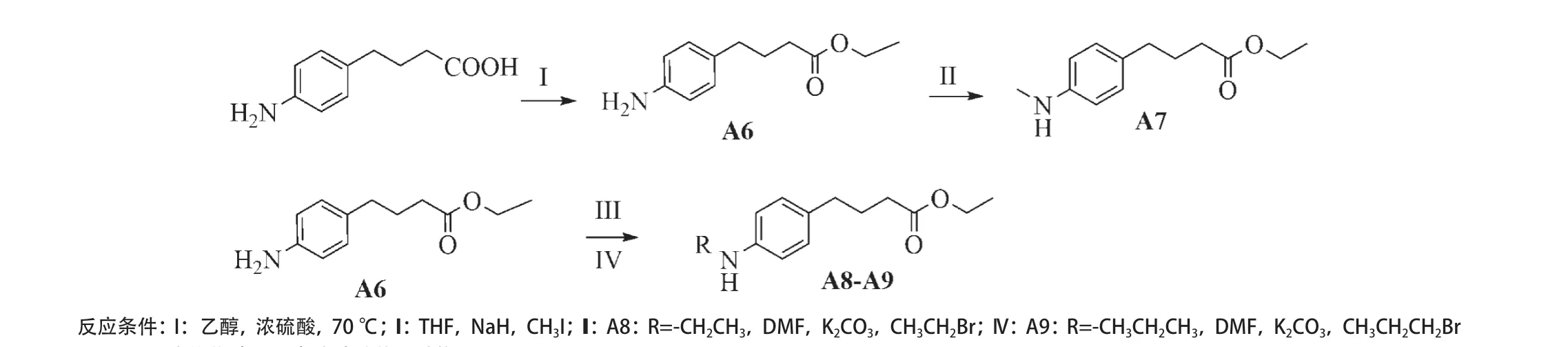
图2 PBA类似物(A6-A9)合成路线及结构
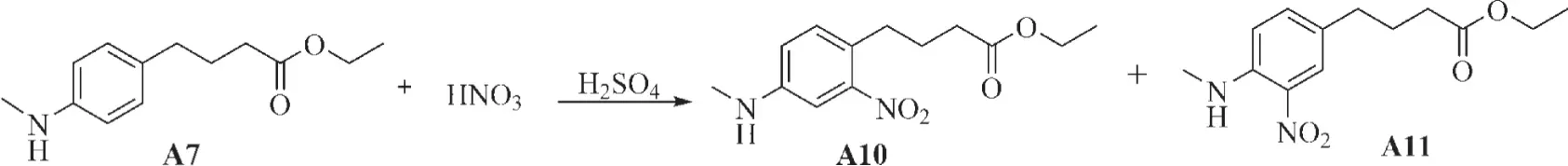
图3 PBA类似物(A10-A11)合成路线及结构
1.2.5 细胞毒性实验:对数生长期的PC12细胞用0.25%含EDTA的胰酶消化,以5 000个/孔接种于96孔板中,细胞于培养箱中生长24 h后更换新鲜培养基并加入药物(10 μmol/L)孵育,药物作用24 h后,在避光条件下,每孔加20 μL的MTT溶液,于细胞培养箱中孵育4 h,4 h后吸掉各孔MTT液并加100 μL的DMSO,震荡均匀5 min,并用酶标仪在490 nm处测定OD值。存活率百分比计算公式如下:存活率= (OD给药组-OD对照孔)/(OD溶剂组-OD对照孔)。每孔设3个复孔。
1.2.6 MTT法测定H2O2引起自噬损伤的细胞生存率分析:将处于对数生长期的细胞以5 000个/孔接种于96孔板内,放入培养箱孵育24 h,加入终浓度为10 μmol/L的药物预保护18 h,再加入终浓度为 0.1 μmol/L的TG损伤24 h,避光条件下每孔加入 20 μL的MTT溶液,于细胞培养箱中孵育4 h,4 h后吸掉各孔MTT液并加100 μL的DMSO,震荡均匀 5 min,用酶标仪在490 nm处测定OD值。生存率= (OD给药组-OD对照孔)/(OD溶剂组-OD对照孔)。每孔设3个复孔。
1.2.7 MTT法测定TG引起ERS的细胞生存率分析:将处于对数生长期的细胞以5 000个/孔接种于96孔板内,放入培养箱孵育24 h,加入终浓度为 10 μmol/L的药物预保护18 h,再加入终浓度为 336 μmol/L的H2O2损伤24 h,避光条件下每孔加入20 μL的MTT溶液,于细胞培养箱中孵育4 h,4 h后吸掉各孔MTT液并加100 μL的DMSO,震荡均匀 5 min,并用酶标仪在490 nm处测定OD值。生存率= (OD给药组-OD对照孔)/(OD溶剂组-OD对照孔)。每孔设3个复孔。
1.2.8 Western blot检测ERS标志蛋白和自噬标志蛋白的表达:PC12细胞以每孔40万接种于6孔板上,并在37 ℃、含5% CO2培养箱内培养24 h。加药作用18 h后加双氧水刺激24 h,在冰上用培养细胞总蛋白提取试剂裂解细胞10 min。12 000 r/min 离心15 min后取上清液测定蛋白浓度并计算出上样量,等量蛋白样品(80 μg)在10%或15% SDSPAGE凝胶上分离,并转移到PVDF膜上。随后用5%脱脂牛奶封闭,并在4 ℃下用一抗过夜:GRP78抗体(sc-10789,1:1 000)、LC3 II/I抗体(sc-47724,1: 1 000)、Beclin-1(1:1 000)。用1×TBST洗涤3次后,在室温下用兔二抗孵育1 h,蛋白条带在ChemiDoc TMXRS+凝胶成像仪中来检测蛋白表达,条带灰度值用ImageJ软件定量分析。
1.3 统计学处理方法 采用GraphPad Prism7.0进行统计学分析。计量资料采用±s表示,多组间比较采用单因素方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 化合物A1-A11的结构解析
2.1.1 4-(4-(N-methylacetamido)phenyl) butanoic acid(A1):淡黄色油状液体,产率:66.7%;IR(cm-1):3335(N-H),2908(CH2),1712(O= C-OH),1633(O=C-N),1517,1540(苯环骨架振动),1410(C-N),1254(C-O)。1HNMR(400 MHz,CDCl3)δ 9.81(s,1H,-COOH),7.46(d,2H,Ar-H),7.08(d,2H,Ar-H),2.49(t,2H,Ar-CH2),2.18(t,2H,-CH2-C=O-OH),2.00(s,3H,CH3-C=O-NH),1.80~1.70(m,2H,-CH2)。13C NMR(125 MHz,CDCl3)δ 179.45(-O=C-OH),173.24(O=C-NH),142.43,141.31,133.63,124.36(Ar-C),39.03(Ph-C),38.25(-CH2-C=O-OH),31.54(-CH2),29.12(CH3- C=O-NH)。ESI-MSm/z:222.1[M+H]+,与计算分子量吻合。
2.1.2 4-(4-(methylamino)phenyl)butanoic acid (A2):淡黄色油状液体,产率:70.8%;IR(cm-1):3361(N-H),2928(CH2),1717(O=C-O),1687(O=CN),1510(苯环骨架振动),1406(C-N),1174(C-O)。1H NMR(400 MHz,CDCl3)δ 7.56(s,1H,-NH),7.40(d,2H,Ar-H),7.10(d,2H,Ar-H),4.12(q,2H,-O-CH2),2.59(t,2H,Ar-CH2),2.29(t,2H,-CH2-C=O-OH),2.14(s,3H,CH3-C=O-NH),1.94~1.88(m,2H,-CH2),1.24(t,3H,-CH3)。13C NMR(125 MHz,CDCl3)δ 173.53(-O=C-OH),168.38(O=C-NH),137.43,135.99,128.91,120.14(Ar-C),60.27(-O-CH3),34.52(Ph-C),33.60(-CH2-C=O-OH),26.53(-CH2)24.42(CH3-C=O-NH),14.23(-CH3)。ESI-MSm/z:250.2[M+H]+,与计算分子量吻合。

2.1.4 ethyl 4-(4-acetamidophenyl)butanoate (A4):淡棕色油状液体,产率:71.2%;IR(cm-1):3288(N-H),2924(CH2),1700(C=O),1513,1447(苯环骨架振动),1212(C-O)。1H NMR(400 MHz,CD3OD)δ 6.97(d,2H,Ar-H),6.59(d,2H,Ar-H),2.74(s,3H,N-CH3),2.55~2.49(t,2H,Ar-CH2),2.26(t,2H,-CH2-C=O),1.83(m,2H,-CH2)。13C NMR (125 MHz,CD3OD)δ 177.69(-O=C-OH),149.41,131.72,130.07,114.26(Ar-C),35.31(-N-CH3),34.34(Ph-C),31.34(-CH2-C=O-OH),28.27(-CH2)。ESI-MSm/z:194.1[M+H]+,与计算分子量吻合。2.1.5 4-(4-acetamidophenyl)butanoic acid (A5):淡黄色油状液体,产率:50.7%;IR(cm-1):2988(CH2),1715(O=C-OH),1684(O=C-N),1540,1508(苯环骨架振动),1457(C-N),1270(C-O)。1H NMR(400 MHz,CD3OD)δ 7.30(d,2H,Ar-H),7.20(d,2H,Ar-H),3.22(s,3H,N-CH3),2.70(t,2H,Ar-CH2),2.32(t,2H,-CH2-C=O-OH),1.93(m,2H,-CH2),1.84(s,3H,CH3-C=O-NH)。13C NMR(125 MHz,CD3OD)δ 177.13(-O=C-OH),173.13(O=C-NH),143.55,143.32,131.03,128.06(Ar-C),37.64 (-N-CH3),35.62(Ph-C),34.20(-CH2-C=O-OH),27.75(-CH2),22.29(CH3-C=O-NH)。ESI-MSm/z:236.1[M+H]+,与计算分子量吻合。
2.1.6 ethyl 4-(4-aminophenyl)butanoate(A6):黄褐色油状液体,产率:85.4%;IR(cm-1):3364(NH),2940(CH2),1722(C=O),1517,1448(苯环骨架振动),1176(C-O)。1H NMR(400 MHz,CDCl3)δ 6.99~6.93(d,2H,Ar-H),6.62(d,2H,Ar-H),4.12(q,2H,O-CH2),3.49(s,2H,-NH2),2.54(t,2H,Ar-CH2),2.29(t,2H,-CH2-C=O),1.95~1.84(m,2H,-CH2),1.25(t,3H,-CH3)。13CNMR(125 MHz,CDCl3)δ 173.64(-C=O),144.41,131.48,129.26,115.26(Ar-C),60.17(O-CH2),34.29(Ph-C),33.68(-CH2-C=O),26.86(-CH2),14.25(-CH3)。ESI-MSm/z:208.2[M+H]+,与计算分子量吻合。
2.1.7 ethyl 4-(4-(methylamino)phenyl) butanoate(A7):淡黄色油状液体,产率:83%;IR(cm-1):3415(N-H),2941(CH2),1728(C=O),1520,1451(苯环骨架振动),1182(C-O)。1H NMR (400 MHz,CDCl3)δ 7.04~6.97(d,2H,Ar-H),6.59~6.52(d,2H,Ar-H),4.12(q,2H,O-CH2),2.82(s,3H,-N-CH3),2.55(t,2H,Ar-CH2),2.30(t,2H,-CH2-C=O),1.95~1.86(m,2H,-CH2),1.25(t,3H,-CH3)。13C NMR(125 MHz,CDCl3)δ 173.67(-C=O),147.60,130.19,129.20,112.58(Ar-C),60.15(OCH2),34.26(Ph-C),33.72(-CH2-C=O),30.97(N-CH3),26.92(-CH2),14.25(-CH3)。ESI-MSm/z:222.2 [M+H]+,与计算分子量吻合。
2.1.8 ethyl 4-(4-(ethylamino)phenyl)butanoate (A8):淡黄色油状液体,产率:81.1%;IR(cm-1):3401(N-H),2978(CH2),1731(C=O),1521,1483(苯环骨架振动),1183(C-O)。1H NMR(400 MHz,CDCl3)δ 6.99(d,2H,Ar-H),6.56(d,2H,Ar-H),4.12(q,2H,O-CH2),3.14(q,2H,-N-CH2),2.54(t,2H,Ar-CH2),2.30(t,2H,-CH2-C=O),1.90(m,2H,-CH2),1.28~1.22(t,6H,-CH3)。13C NMR (125 MHz,CDCl3)δ 173.67(-C=O),146.68,130.16,129.22,112.93(Ar-C),60.14(O-CH2),38.75(N-CH2),34.26(Ph-C),33.72(-CH2-C=O),26.91(-CH2),14.94(-CH3),14.25(-CH3)。ESI-MSm/z:236.2[M+H]+,与计算分子量吻合。
2.1.9 ethyl 4-(4-(propylamino)phenyl) butanoate(A9):淡黄色油状液体,产率:67.7%;IR(cm-1):3411(N-H),2963(CH2),1732(C=O),1521,1480(苯环骨架振动),1183(C-O)。1H NMR (500 MHz,CDCl3)δ 6.99(d,2H,Ar-H),6.56(d,2H,Ar-H),4.13(q,2H,O-CH2),3.07(t,2H,-NCH2),2.54(t,2H,Ar-CH2),2.31(t,2H,-CH2-C=O),1.90(m,2H,-CH2),1.68~1.60(m,2H,-CH2),1.26(t,3H,-CH3),1.00(t,3H,-CH3)。13C NMR (125 MHz,CDCl3)δ 173.69(-C=O),146.70,130.06,129.22,112.92(Ar-C),60.15(O-CH2),46.15(N-CH2),34.26(Ph-C),33.72(-CH2-C=O),26.92(-CH2),22.77(-CH2),14.26(-CH3),11.62(-CH3)。ESI-MSm/z:250.2[M+H]+,与计算分子量吻合。
2.1.10 ethyl 4-(4-(methylamino)-2-nitrophenyl) butanoate(A10):明黄色油状液体,产率:45.3%;IR(cm-1):3565(N-H),2928(CH2),1717(C=O),1540,1507(苯环骨架振动),1217(C-O)。1H NMR (400 MHz,CDCl3)δ 7.08(d,2H,Ar-H),6.74(s,1H,Ar-H),4.12(q,2H,O-CH2),2.85(s,3H,-NCH3),2.81~2.74(t,2H,Ar-CH2),2.34(t,2H,-CH2-C=O),1.97-1.88(m,2H,-CH2),1.25(t,3H,-CH3)。13C NMR(125 MHz,CDCl3)δ 173.33(-C=O),150.04(Ar-C-NO2),148.26(Ar-C-NH),132.48,124.16,117.38,106.96(Ar-C),60.30(O-CH2),33.84(Ph-C),31.41(-CH2-C=O),30.55(N-CH3),26.05(-CH2),14.22(-CH3)。ESI-MSm/z:267.1 [M+H]+,与计算分子量吻合。
2.1.11 ethyl 4-(4-(methylamino)-3-nitrophenyl) butanoate(A11):淡橙色油状液体,产率:37.9%;IR(cm-1):3583(N-H),2990(CH2),1728(C=O),1545,15077(苯环骨架振动),1190(C-O)。1H NMR (500 MHz,CDCl3)δ 8.07(s,1H,Ar-H),7.81(d,1H,Ar-H),7.49(d,1H,Ar-H),4.15(q,2H,-OCH2),3.45(s,3H,-N-CH3),2.99~2.95(t,2H,Ar-CH2),2.41(t,2H,-CH2-C=O),2.05~1.99(m,2H,-CH2),1.26(t,3H,-CH3)。13C NMR(125 MHz,CDCl3)δ 172.93(-C=O),149.67(Ar-C-NH),141.31(Ar-C),134.90(Ar-C-NO2),133.18,122.47,114.34(Ar-C),60.49(O-CH2),33.71(Ph-C),31.78(-CH2-C=O),30.55(N-CH3),25.72(-CH2),14.22(-CH3)。ESI-MSm/z:267.1[M+H]+,与计算分子量吻合。
2.2 化合物A1-A11对细胞毒性的影响 MTT法检测结果显示,除化合物A11细胞存活率低于20%外,A1-A10的细胞存活率在100%左右,说明无细胞毒性。并且A1的细胞存活率高于100%,说明有促进细胞增殖的作用,且高于PBA组(P<0.01),证明其具有较好的细胞保护作用。见图4A。
2.3 化合物对TG诱导的ERS模型中PC12细胞存活率的影响 在TG诱导的ERS损伤模型中,TG组的生存率约为51%,而A1组的细胞生存率明显高于TG组和PBA组(P<0.05),但是A6却显示出了毒性,其余化合物在TG损伤模型中未见明显毒性。见图4B。
2.4 化合物对H2O2诱导的过度自噬模型PC12细胞存活率的影响 在H2O2诱导的过度自噬损伤模型中,化合物A1、A2、A4和A6-A10组的细胞生存率明显高于H2O2组(P<0.05),并且A1、A4、A6和A7组的细胞生存率高于PBA组,然而A2和A10组的细胞生存率低于PBA组(P<0.05)。见图4C。
根据以上MTT法检测结果,综合考虑化合物A1-A10对ERS和自噬损伤模型中细胞的双重保护作用结果,我们选取化合物A1、A4、A8通过实验进一步检测其对ERS和自噬损伤细胞的保护作用。
2.5 化合物对ERS相关蛋白GRP78表达的影响 Western blot实验结果显示,TG组GRP78蛋白表达量高于DMSO组,A1组GRP78蛋白表达量低于TG组,差异有统计学意义(P<0.05)。见图5A-B。
2.6 化合物对自噬相关蛋白Beclin-1和LC3 II/I表达的影响 Western blot检测结果表明,H2O2组 Beclin-1和LC3 II/I蛋白表达量明显高于DMSO组,A1组Beclin-1和LC3 II/I蛋白表达量低于H2O2组和自噬抑制剂3-甲基腺嘌呤(3-MA)组,差异均有统计学意义(P<0.05)。见图5C-E。
3 讨论
内质网(endoplasmic reticulum,ER)是一种具有重要生理功能的细胞器,参与蛋白质合成、折叠、钙的储存和释放,还参与脂类代谢、类固醇代谢等一系列过程,对维持心肌细胞Ca2+和蛋白质合成稳态具有重要作用[11-12]。缺血缺氧、葡萄糖/营养物质匮乏、ATP耗竭、大量自由基的产生及Ca2+稳态破坏等应激刺激均可引起ER功能障碍,触发ERS[13-15]。 适度的ERS有利于细胞内钙和蛋白质加工等稳态的恢复,增强细胞耐受应激剌激的能力;如果ERS持续存在或过强,细胞最终将启动细胞凋亡程序。ER通路机制是近年来刚发现的一条新的调节细胞凋亡的途径,是目前研究热点。研究表明,ER通路诱导的细胞凋亡参与了多种常见疾病,如:神经退行性疾病(阿尔茨海默病、帕金森病等)、糖尿病、心脑组织缺血等的发病过程[16-19],日益受到重视。
TG常作为ERS的诱导剂,我们选择TG(0.1 μmol/L) 作为诱导剂,PBA(10 μmol/L)作为阳性对照药,评估了化合物对TG诱导的ERS模型中损伤细胞的保护作用。细胞自噬是ERS状态下产生的结果,与许多疾病密切相关,文献报道,在脑缺血再灌注损伤中,存在过度ERS和过度自噬的双重损伤病理生理过程,药物通过抑制ERS和自噬途径得以大大缓解脑损伤[20]。 因此,本研究同时探究了化合物A1-A10是否具有抑制过度自噬的作用。H2O2常被作为细胞自噬的诱导剂[21],当H2O2在细胞内含量过高时,则会引起细胞自噬和凋亡[22]。本研究选用H2O2(336 μmol/L)作为自噬的诱导剂,PBA(10 μmol/L)作为阳性对照药。
GRP78是ERS重要的标志性蛋白之一,抑制GRP78蛋白表达的上调,将会缓解过度ERS,恢复内环境稳态。LC3蛋白来源于自噬体,为自噬的标志性蛋白,自噬发生时LC3 I会被Ag7蛋白活化成LC3 II,LC3 II和LC3 I的比值可用来衡量细胞自噬的水 平[23],Beclin-1是自噬信号通路上的蛋白,也是检测自噬水平的重要指标,于是我们采用Western blot法检测GRP78蛋白和Benclin-1、LC3 II/I蛋白的表达情况。
本研究结果表明化合物(除A11)均无显著细胞毒性,并且A1细胞存活率优于PBA,具有更好的细胞保护作用;采用MTT法分析化合物在TG诱导的ERS模型中对PC12细胞的生存率的影响,其中化合物A1对ERS损伤细胞具有明显的保护活性,同时我们发现化合物A1、A2、A4和A6-A10对过度自噬损伤细胞具有保护作用,并且A1、A4、A6和A7对细胞的保护活性优于PBA。基于以上实验结果综合考虑,本研究选择A1、A4和A8通过Western blot法检测上述化合物对ERS的标志蛋白GRP78和过度自噬标志蛋白LC3 II/I和Beclin-1的表达抑制量,进一步证实设计合成的化合物对ERS和过度自噬的抑制作用;结果表明A1能抑制ERS标志性蛋白GRP78的表达,具有对ERS抑制作用,且A1的抑制作用明显优于PBA,具备更好的对ERS导致的损伤细胞的保护作用;并且A1能抑制自噬标志性蛋白Beclin-1以及LC3 II/I的表达,且A1的抑制作用明显优于3-MA,对过度自噬损伤细胞具有更好的保护作用。以上结果表明,设计合成的化合物A1母核PBA相比,对ERS和过度自噬损伤细胞具有更强的双重保护作用。
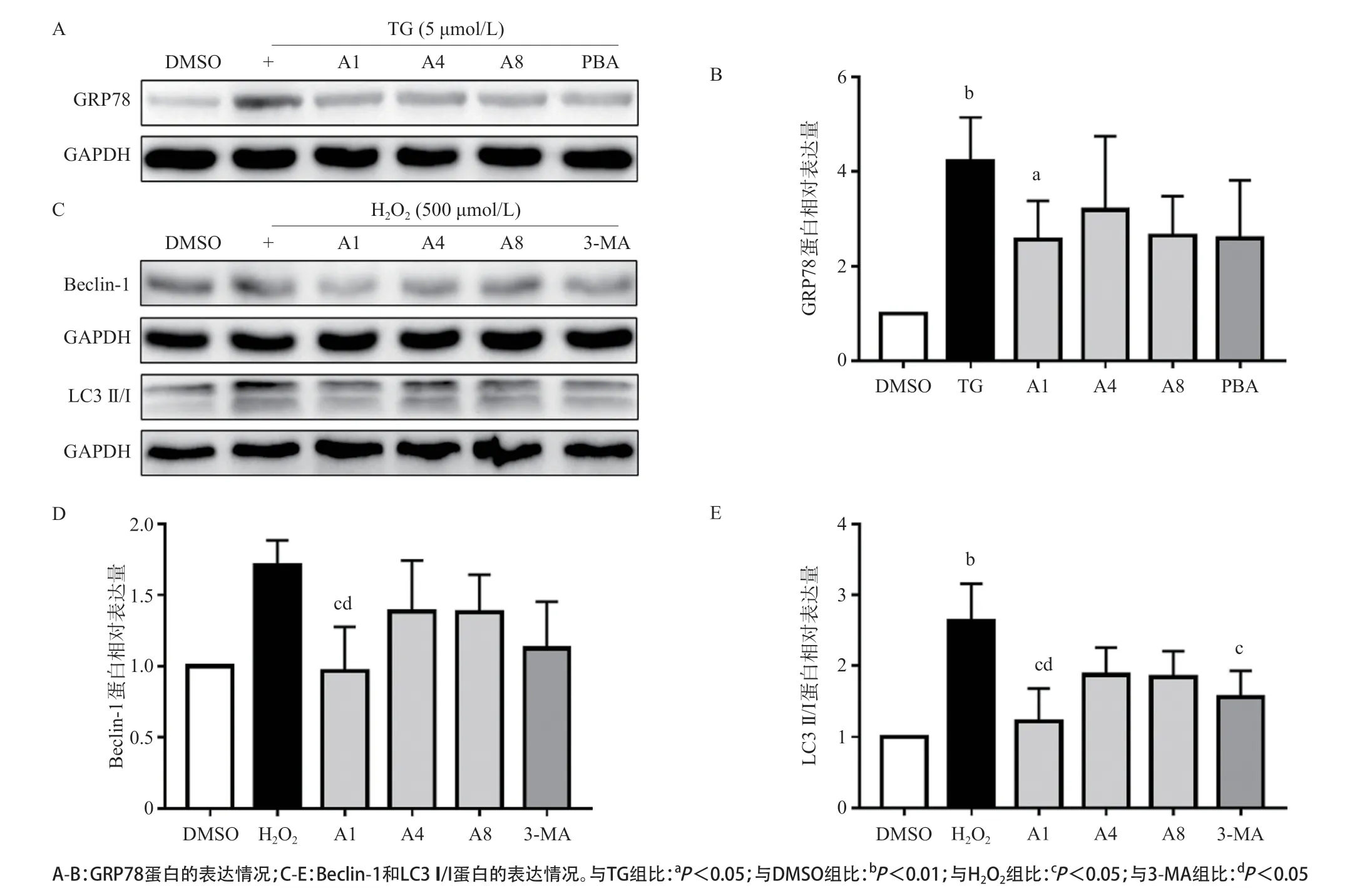
图5 Western blot法检测GRP78蛋白和Benclin-1、LC3 II/I蛋白的表达情况
本研究合成了11个PBA类似物,并对其进行了ERS和过度自噬的双重抑制作用研究。首先参考文献[24],在PBA的苯环上引入了一个氨基,接着对氨基进行了一系列简单的结构改造,将A1、A4结构中的羧基乙酯化为A2、A7,A3结构中的酯基水解为羧基得A5,从活性检测结果表明,A1和A2,A4与A7,A3与A5之间活性相差无几,说明结构中为羧基还是酯基对活性影响不大;A6的游离氨基改造为甲氨基得A7,A7对ERS导致的细胞损伤保护作用明显加强,说明对氨基的结构改造也许是活性改变的主要位点,A1活性最强,正是对游离氨基的乙酰化所致;邻位硝基取代的A11对正常细胞PC12具有明显毒性作用,细胞存活率下降明显,我们推测可能是由于化合物中硝基的影响,然而,间位硝基取代的A10对正常细胞PC12无细胞毒性,且对ERS和过度自噬引起的损伤细胞具有保护作用,说明硝基的取代位置对活性具有重要影响作用。
综上所述,本研究设计合成的11个化合物,合成简便,通过对PBA简单的结构改造就获得活性较其更强的化合物A1-A10,具有较其更好的ERS和过度自噬的双重抑制作用,对ERS和过度自噬导致的损伤细胞起到保护作用,后续我们将对其进行进一步的深入研究。

