lncRNA TTN-AS1靶向抑制miR-1271的表达对肺癌细胞增殖、侵袭和凋亡的影响及机制
陈哲,王勤宁,黄璐捷,史信宝,胡静
宁波市医疗中心李惠利医院,浙江 宁波 315040,1.心胸外科;2.放疗科
肺癌具有较高的发病率及病死率,多数患者在确诊时已处于中晚期,治疗效果及预后不理想[1]。随着分子生物学的发展,靶向治疗成为肺癌治疗的新方法,寻找有效的肺癌治疗靶点具有重要意义。大 量研究表明,长链非编码RNA(long non-coding RNA,lncRNA)及微小RNA(microRNA,miRNA)与肺癌发生发展及预后密切相关,可作为肺癌诊疗的特异性靶点[2]。肌联蛋白反义RNA1(titin antisense RNA1,TTN-AS1)是新近发现的lncRNA,发挥促癌作用,有研究显示,在甲状腺癌、食管癌、骨肉瘤等多种肿瘤中lncRNA TTN-AS1异常表达,其表达可促进肿瘤进展[3-5]。有研究显示,肺癌中TTN-AS1高表达,抑制其表达可降低癌细胞增殖、侵袭和迁移能力[6]。有研究报道,过表达miR-1271可在体内体外抑制肺癌生长[7];lncRNA TTN-AS1可通过靶向抑制miR-1271促进前列腺癌细胞的增殖和侵袭[8]。TTNAS1和miR-1271都可影响肺癌进展,且lncRNA TTNAS1和miR-1271存在靶向关系,但TTN-AS1是否可通过调节miR-1271影响肺癌细胞增殖、侵袭和凋亡尚未可知。本研究以肺癌A549细胞为研究对象,旨在探讨TTN-AS1调节miR-1271对肺癌细胞增殖、侵袭和凋亡的影响及可能的分子机制,为肺癌分子水平的治疗提供一定的参考及依据。
1 材料和方法
1.1 试剂和仪器 DMEM培养基、Opti-MEM培养基、胰蛋白酶、青霉素-链霉素、胎牛血清均购自美国Gibco公司;Lipofectamine 2000、TRIzol试剂盒均购自美国Invitrogen公司;荧光定量PCR试剂盒及反转录试剂盒均购自日本TaKaRa公司;CCK-8试剂盒购日本Djingo公司;Transwell小室购自美国Corning公司;细胞凋亡试剂盒、BCA蛋白浓度检测试剂盒、RIPA裂解液均购自上海碧云天生物技术有限公司;PI3K、p-AKT、PCNA、E-cadherin、cleaved caspase 3和3-磷酸肌醇依赖性蛋白激酶1 (3-phosphate dependent protein kinase 1,PDK1)抗体购自美国Abcam公司;双荧光素酶报告基因检测试剂盒购自美国Promega公司;RT-PCR仪购自瑞士Roche公司;倒置显微镜购自日本Olympus公司;FACScan流式细胞仪购自德国BD Biosicences公司;酶标仪购自美国Bio-Rad公司。
1.2 细胞培养 人肺癌A549细胞购自美国ATCC。常规复苏冻存的A549细胞后,使用含10% FBS及1%青霉素-链霉素的DMEM培养基,放置于5% CO2、37 ℃培养箱培养。隔天换液1次,待细胞贴壁且占满80%~90%培养皿面积时进行传代。实验选择处于对数生长期的细胞。
1.3 细胞转染 采用Lipofectamine 2000进行细胞的转染。选择对数生长期的A549细胞,胰酶消化细胞,调整细胞浓度为1×106个/mL,按照2 mL/孔接种于6孔板,于培养箱培养。细胞生长达70%~80%融合时,更换为不含FBS的培养基同步化12 h,随后进行转染。使用适量Opti-MEM培养基分别稀释Lipo 2000、TTN-AS1 siRNA(si-TTN-AS1)及阴性对照(si-NC)、pcDNA-TTN-AS1及空载体(pcDNA)、miR-1271 mimics及miR-NC、miR-1271 inhibitors(anti-miR-1271)及anti-miR-1271。将稀释后的各转染组与Lipofectamine 2000混匀,室温静置 30 min。将混合液加入6孔板内,于5% CO2、37 ℃培养箱孵育6 h,更换为完全培养基,继续培养48 h,用于后续实验研究。
1.4 qRT-PCR检测TTN-AS1和miR-1271表达 采用TRIzol法提取细胞总RNA,按照反转录试剂盒说明反转录为cDNA。将cDNA稀释10倍,按照荧光定量试剂盒说明进行PCR扩增。每个样本设置5个重复,相对表达量采用2-△△Ct法计算。所有引物由上海生工生物工程有限公司合成,序列如下:TTN-AS1:F:5’- CGGGAACAAGCCCTGTG-3’,R:5’-CCGGCCCAAAGATGATG- 3’;GAPDH:F:5’-TGCACCACCACCTGCTTAGC-3’,R:5’- GGCATGGACTGTGGTCATGAG-3’;miR-1271:F:5’-CTAGA CGTCCAGATTGAATAGAC-3’,R:5’-GTCCGAGCTTGGTC-AG AATG-3’;U6:F:5’-CTCGCTT-CGGCAGCACA-3’,R:5’-AAC GCTTCACGAATTTGCGT-3’。实验重复3次。
1.5 CCK-8法检测细胞增殖 以5×103个/孔将生长状态良好且处于对数生长期的细胞接种于96孔板,每孔100 μL细胞悬液,于培养箱常规孵育24 h,按照上述方法转染,每组设置5个重复。收集转染48 h的细胞,在每孔加10 μL的CCK-8反应液,混匀,于培养箱继续孵育4 h。酶标仪检测波长为450 nm的光密度值(OD值)。实验重复3次。
1.6 Transwell实验检测细胞侵袭 Transwell小室上室加100 μL的Matrigel基质胶(基质胶:无血清培养基为1:4),待基质胶凝固后进行实验。收集按照上述分组转染48 h的各组细胞,胰酶消化细胞,不含血清培养基重悬细胞,并调整细胞浓度为5×105个/mL。取300 μL细胞悬液,加入Transwell小室上室,下室加500 μL含血清的培养基。培养箱正常培养24 h,去掉小室细胞培养液,PBS清洗,棉签擦净上室未穿过膜细胞,多聚甲醇固定,0.1%结晶紫染色。倒置显微镜下随机选择5个视野,计数穿过膜的细胞数。实验重复3次。
1.7 流式细胞术检测细胞凋亡 采用Annexin V-FITC/PI双染法检测细胞凋亡。收集转染48 h的各组细胞,胰酶消化细胞,并将细胞浓度调整为5× 105个/mL。预冷PBS洗涤细胞2次,加入binding buffer重悬细胞,离心,弃掉上清液,PBS洗涤细胞2次。加5 μL Annexin V-FITC和5 μL PI,室温避光孵育20 min。上机检测前再加入300 μL的binding buffer,1 h内通过FACScan流式细胞仪检测。实验重复3次。
1.8 Western blot检测PI3K、p-AKT、PCNA、E-cadherin和cleaved caspase 3表达 在转染48 h 的各组细胞中加适量RIPA裂解液,冰上反应30 min,4 ℃离心,收集上清液。取适量上清液,BCA法检测蛋白样品浓度。根据蛋白样品体积加loading buffer,混匀,100 ℃变性5 min。按照40 μg/孔将变性蛋白加入至SDS-PAGE凝胶(5%浓缩胶和12%分离胶),电泳结束后4 ℃转PVDF膜1.5 h,加5%脱脂奶粉封闭膜2 h。将膜放置在含PI3K、p-AKT、PCNA、E-cadherin和cleaved caspase 3(1:1 000稀释)的孵育盒中,4 ℃孵育过夜,TBST洗膜。转移膜至1:2 000稀释的辣根过氧化物酶标记的二抗中,室温孵育1 h,洗膜。膜上滴加ECL显色液,自动凝胶成像系统采集图像。Quantity One软件分析各抗体条带灰度值。实验重复3次。
1.9 双荧光素酶报告基因实验 生物信息学软件TargetScan预测结果显示TTN-AS1和PDK1的3’UTR有可与miR-1271结合的位点。构建含结合位点的TTN-AS和PDK1的野生型(WT)及突变型(MUT)3’UTR报告质粒。以5×104个/孔将对数生长期的A549细胞接种于24孔板,待细胞生长达80%融合时,参照Lipofectamine 2000转染说明,将报告质粒分别与miR-1271 mimics及miR-NC转染至A549细胞,每组设3个复孔。转染48 h,参照双荧光素酶报告基因检测试剂盒说明检测各组细胞荧光素酶活性。结果以萤火虫荧光素酶/海肾荧光素酶活性比值表示。
1.10 统计学处理方法 采用SPSS21.0软件进行分析。计量资料以±s表示,两组比较采用独立样本t检验,多组比较采用单因素方差分析,组间两两比较采SNK-q检验。P<0.05为差异有统计学意义。
2 结果
2.1 抑制TTN-AS1表达对肺癌细胞增殖、侵袭和凋亡的影响 qRT-PCR结果显示,转染TTN-AS1 siRNA的A549细胞TTN-AS1表达明显低于si-NC组(P<0.05),表明构建的抑制TTN-AS1表达的A549细胞成功。CCK-8实验、Transwell实验及流式细胞术检测结果显示,与si-NC组比较,si-TTN-AS1组细胞增殖能力明显降低,穿膜细胞数明显下降,凋亡率明显升高(P<0.05)。见图1和表1。
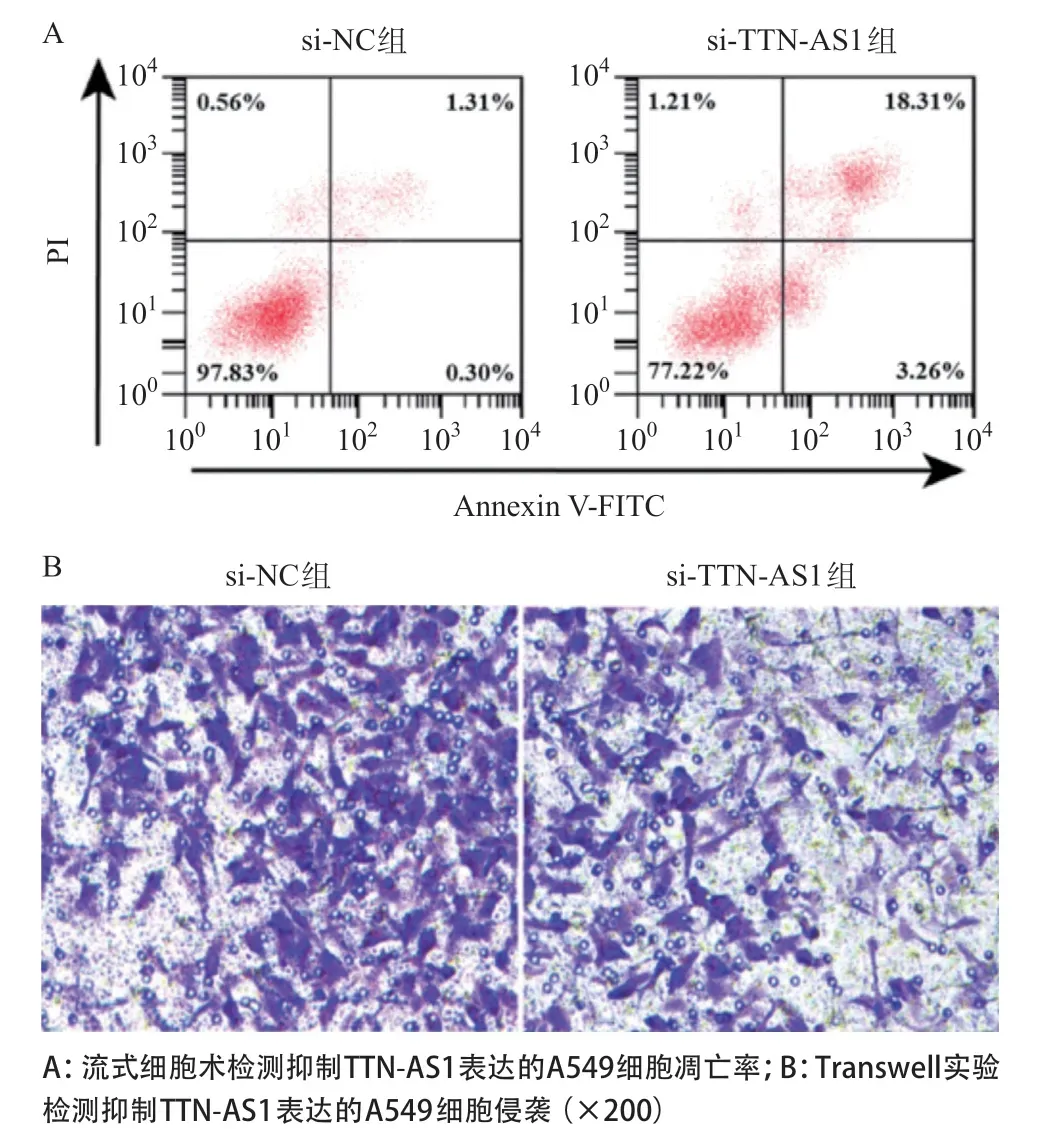
图1 抑制TTN-AS1表达对A549细胞凋亡和侵袭能力的影响
2.2 抑制TTN-AS1表达对A549细胞PI3K、p-AKT、PCNA、E-cadherin和cleaved caspase 3表达的影响 Western blot结果显示,与si-NC组比较,si-TTN-AS1组PI3K、p-AKT和PCNA表达明显降低,E-cadherin和cleaved caspase 3表达明显升高 (P<0.05)。见图2。

表1 抑制TTN-AS1表达后的A549细胞增殖、侵袭和凋亡情况
2.3 过表达miR-1271对肺癌细胞增殖、侵袭和凋亡的影响 qRT-PCR结果显示,转染miR-1271 mimics 的A549细胞TTN-AS1表达明显低于si-NC组(P<0.05),表明构建过表达miR-1271的A549细胞成功。CCK-8实验、Transwell实验及流式细胞术检测结果显示,与miR-NC组比较,miR-1271组细胞增殖能力明显降低,穿膜细胞数明显下降,凋亡率明显升高(P<0.05)。见图3和表2。
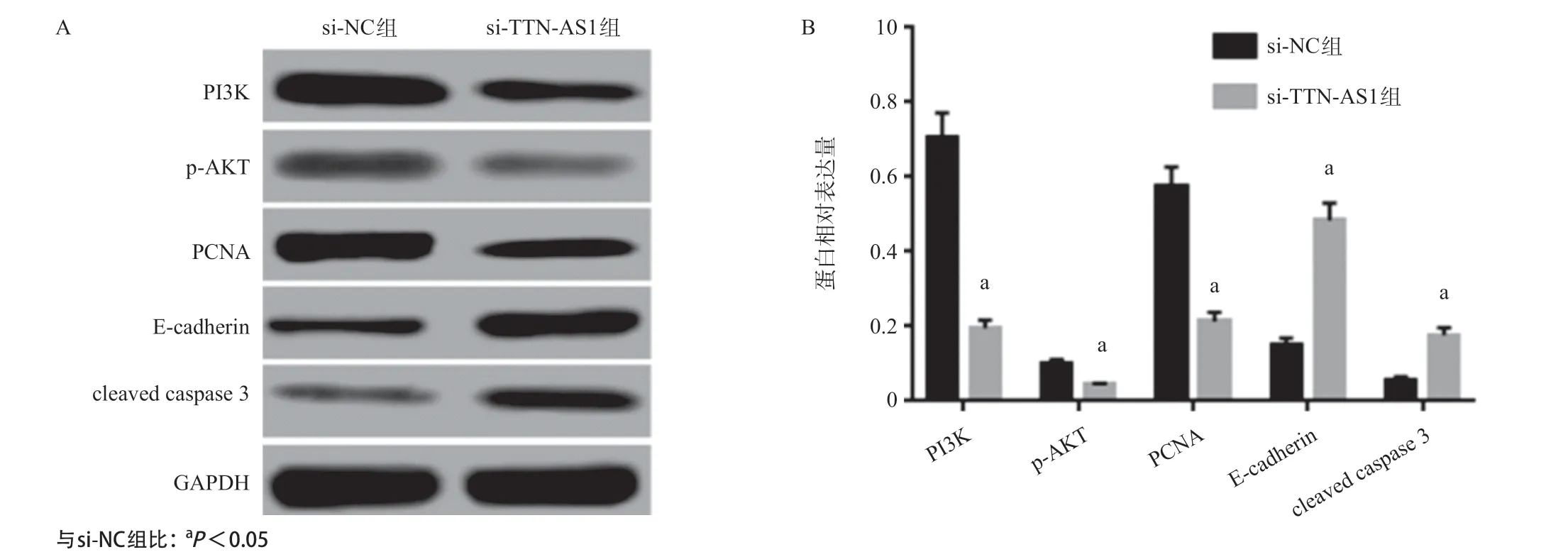
图2 抑制TTN-AS1表达对A549细胞PI3K、p-AKT、PCNA、E-cadherin和cleaved caspase 3表达的影响
2.4 过表达miR-1271对A549细胞PI3K、p-AKT、PCNA、E-cadherin和cleaved caspase 3表达的影响 Western blot检测PI3K/AKT信号通路及与细胞增殖、侵袭和凋亡相关蛋白表达,结果显示,与miRNC组比较,miR-1271组PI3K、p-AKT和PCNA表达明显降低,E-cadherin和cleaved caspase 3表达明显升高(P<0.05)。见图4。
2.5 TTN-AS1可靶向调控miR-1271的表达 生物信息学TargetScan软件预测结果显示(见图5),TTNAS1与miR-1271序列中存在连续的结合位点。双荧光素酶报告基因实验结果显示(见表3),miR-1271组野生型TTN-AS1荧光素酶活性较miR-NC组明显降低(P<0.05),而突变型TTN-AS1荧光素酶活性较miR-NC组差异无统计学意义(P>0.05)。qRT-PCR检测结果显示(见表4),抑制TTN-AS1表达可明显上调miR-1271表达,而过表达TTN-AS1可明显下调miR-1271表达(P<0.05)。说明lncRNA TTN-AS1与miR-1271存在靶向关系,且可负调控miR-1271表达。
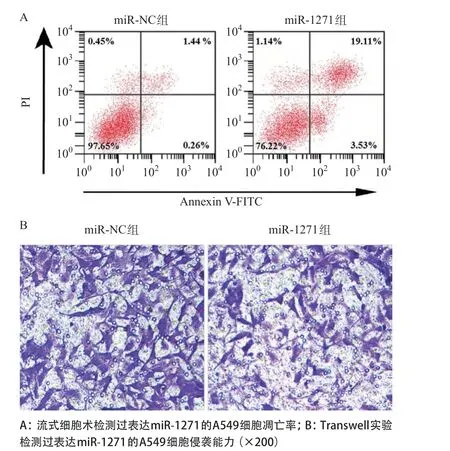
图3 过表达miR-1271对A549细胞凋亡和侵袭能力的影响
2.6 抑制miR-1271可逆转抑制TTN-AS1对A549细胞增殖、侵袭和凋亡的影响 各组细胞增殖、侵袭和凋亡检测结果显示(见表5),与si-TTN-AS1组比较,si-TTN-AS1+anti-miR-1271组细胞增殖能力明显降低,穿膜细胞数明显下降,凋亡率明显升高(P< 0.05)。Western blot检测结果显示(见表6),与si-TTN-AS1组比较,si-TTN-AS1+anti-miR-1271组PI3K、p-AKT和PCNA表达明显升高,E-cadherin和cleaved caspase 3表达明显降低(P<0.05)。

表2 过表达miR-1271后的A549细胞增殖、侵袭和凋亡情况
2.7 TTN-AS1可调节miR-1271靶基因PDK1表达生物信息学预测软件TargetScan预测结果显示(见图6),miR-1271和PDK1有可结合的位点。双荧光素酶报告基因实验显示(见表7),miR-1271 mimics与野生型PDK1质粒共转染荧光素酶活性明显降低(P<0.05),而与突变型PDK1质粒共转染荧光素酶活性无明显变化(P>0.05)。Western blot结果显示(见图7-8),过表达miR-1271和抑制TTN-AS1表达明显下调PDK1表达,而抑制miR-1271表达和过表达TTN-AS1可明显上调PDK1表达(P<0.05)。提示miR-1271与PDK1存在靶向关系,miR-1271和TTN-AS1均可调控PDK1表达。
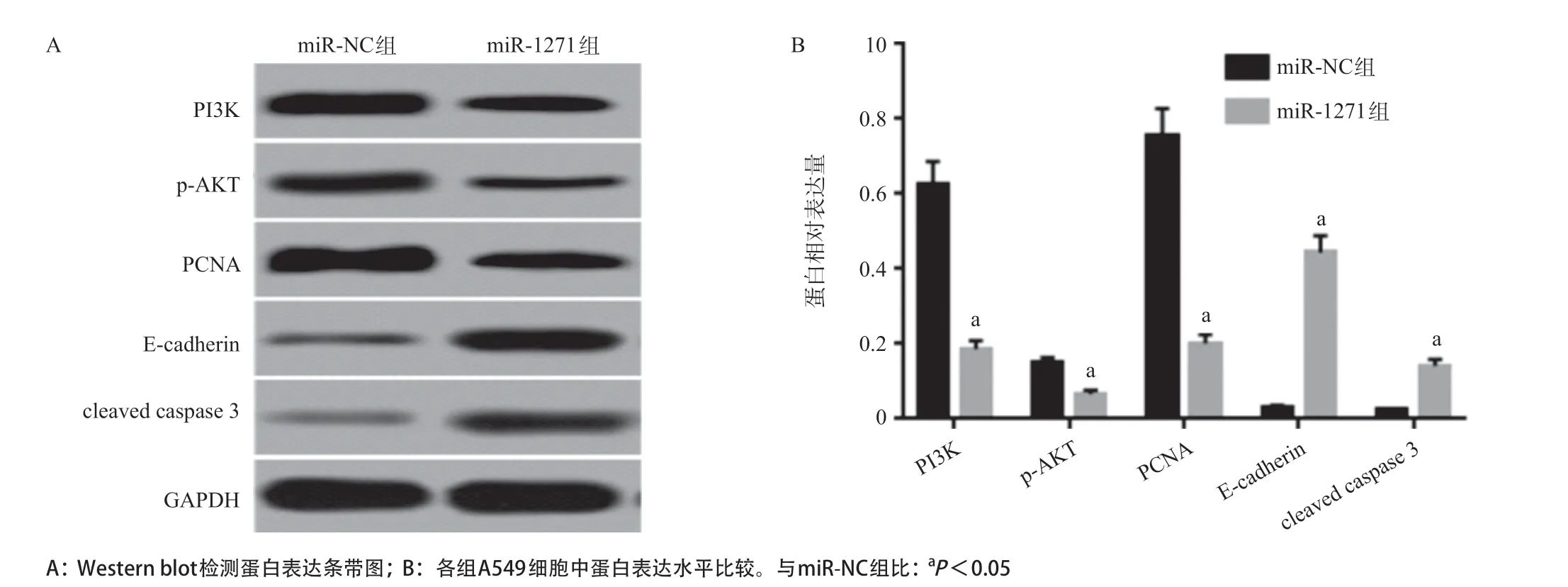
图4 过表达miR-1271对A549细胞PI3K、p-AKT、PCNA、E-cadherin和cleaved caspase 3表达的影响
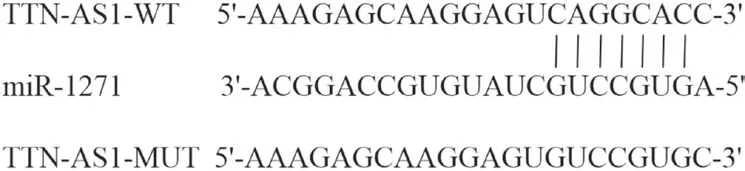
图5 TTN-AS1的序列含有与miR-1271互补的核苷酸序列

表3 TTN-AS1 WT/MUT与miR-1271 mimics共转染后的荧光素酶活性
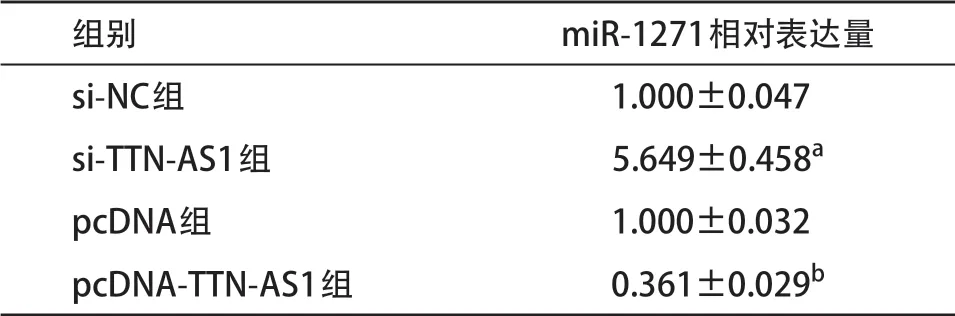
表4 lncRNA TTN-AS1调节miR-1271表达
3 讨论
lncRNA是一类不编码的RNA分子,长度大于200 nt,可在转录水平、转录后水平及翻译水平的调控中发挥重要作用。多种肿瘤中lncRNA异常表达,发挥促癌或抑癌作用,参与癌细胞的多种生物学过程[9-10]。lncRNA TTN-AS1是一个促癌基因,在多种肿瘤中高表达,如CHEN等[11]研究显示,抑制TTNAS1表达可降低胃癌细胞的增殖和侵袭能力;LI 等[12]研究显示,抑制TTN-AS1表达可降低骨肉瘤细胞的增殖、侵袭和迁移,并促进细胞凋亡。本研究结果显示,抑制TTN-AS1表达可降低A549细胞增殖和侵袭能力,并促进细胞凋亡。有研究显示TTN-AS1可通过调节miR-142-5p/CDK5抑制肺癌细胞增殖、侵袭和迁移能力[13]。

表5 抑制miR-1271可逆转抑制TTN-AS1对A549细胞增殖、侵袭和凋亡的影响

表6 各组细胞PI3K、p-AKT、PCNA、E-cadherin和cleaved caspase 3蛋白相对表达量
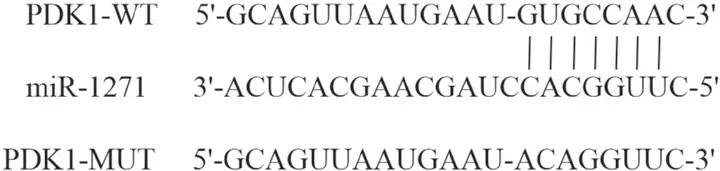
图6 miR-1271的序列含有和PDK1互补的核苷酸序列
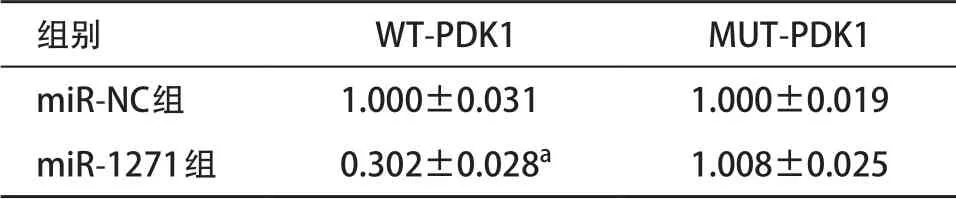
表7 PDK1 WT/MUT与miR-1271 mimics共转染后的荧光素酶活性
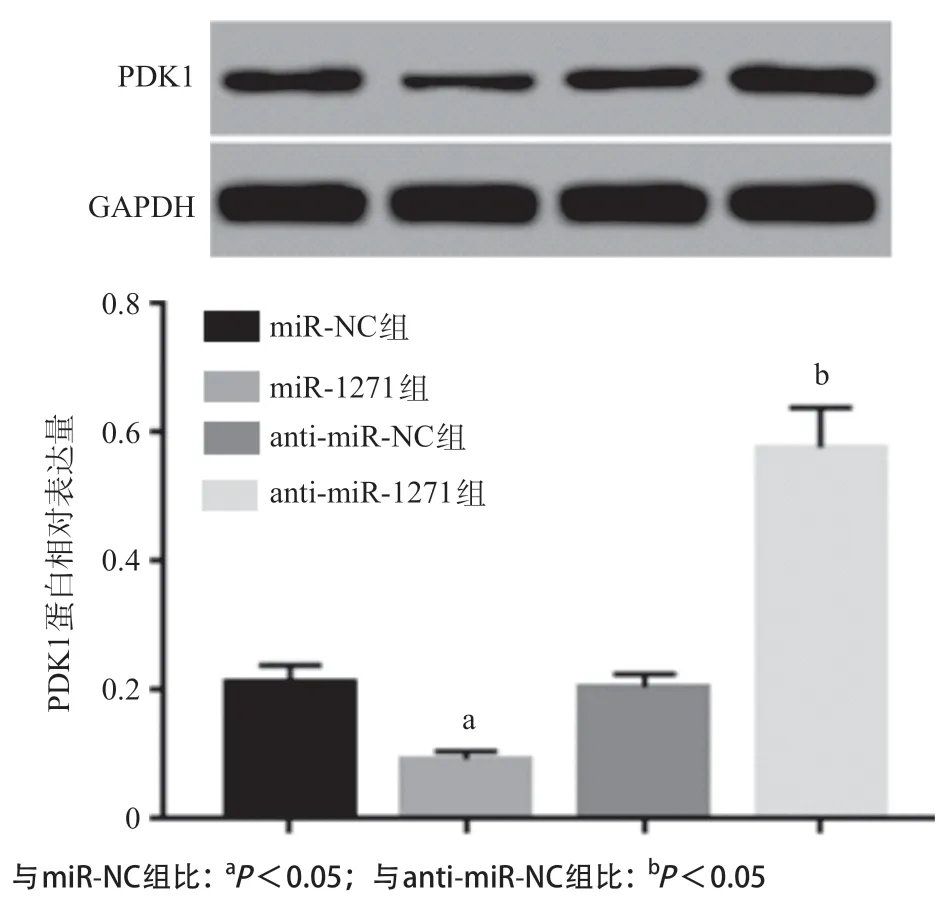
图7 过表达或抑制miR-1271对PDK1蛋白表达的影响
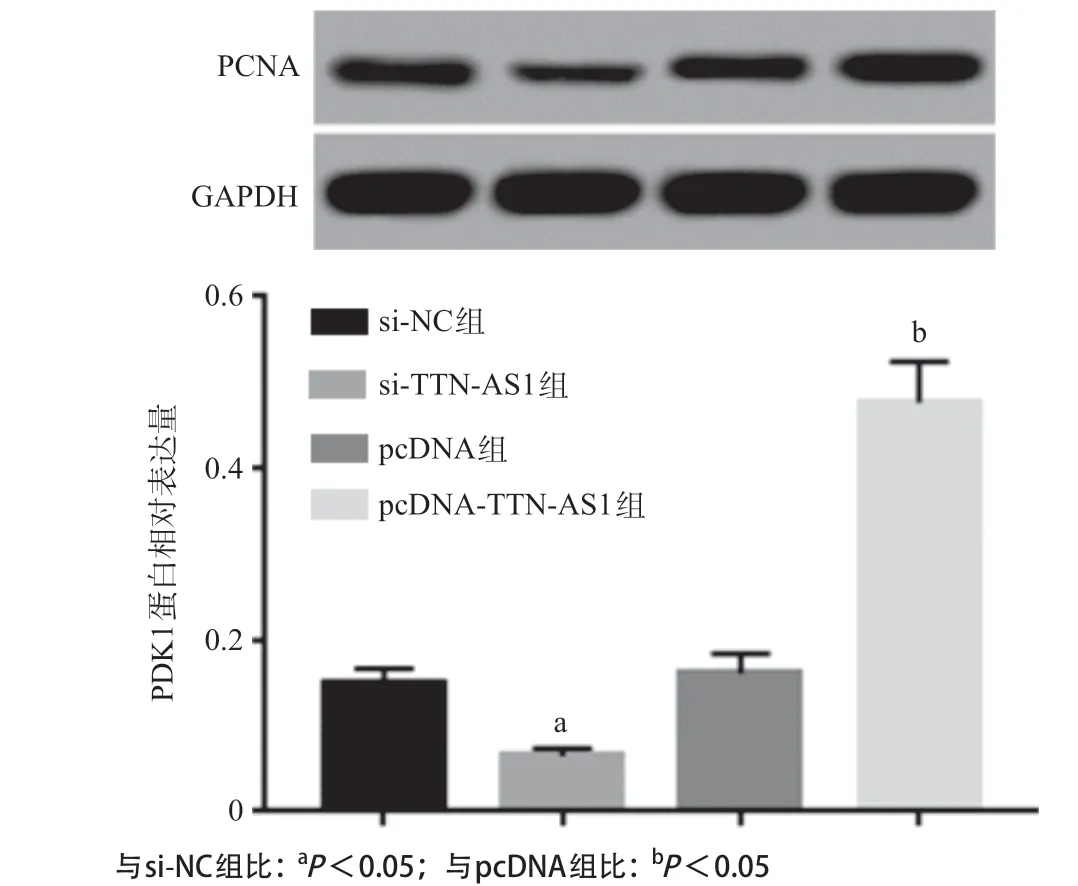
图8 过表达或抑制TTN-AS对PDK1蛋白表达的影响
近年的研究发现,lncRNA可作为miRNA“海绵”,降低组织及细胞中靶miRNA丰度,降低miRNA对mRNA结合作用及抑制mRNA翻译,从而增强miRNA靶蛋白表达水平[14]。本研究结果显示,TTN-AS1和miR-1271存在靶向关系,过表达TTN-AS1可下调miR-1271表达,抑制TTN-AS1表达可上调miR-1271表达。过表达miR-1271可明显抑制A549细胞增殖和侵袭能力,并促进细胞凋亡,而抑制miR-1271可逆转抑制TTN-AS1对细胞增殖、侵袭和凋亡的影响。提示TTN-AS1可靶向调节miR-1271影响肺癌细胞增殖、侵袭和凋亡。PDK1是一个丝/苏氨酸蛋白激酶,大小为67 kDa,在细胞生长、凋亡、分化等病理生理过程中发挥重要作用[15]。多种肿瘤中PDK1均呈现高表达,可作为一种原癌基因参与肿瘤进展[16-17]。有研究显示,干扰PDK1表达可通过抑制AKT/FoxO1通路降低肺癌细胞增殖及促进细胞凋亡[18]。miR-1271可通过靶向PDK1调控AKT/MTOR信号通路促进胰腺癌细胞进 展[19]。本研究结果显示,过表达miR-1271及抑制TTN-AS1均可下调PDK1表达,抑制miR-1271及上调TTN-AS1均可上调PDK1表达。提示TTN-AS1可通过调节miR-1271/PDK1影响肺癌细胞生长。
PI3K/AKT是一条与肿瘤发生发展密切相关的信号途径,近年研究发现,多种肿瘤中PI3K/AKT信号过度表达和活化[20-21]。AKT是一种丝/苏氨酸蛋白,PI3K可通过磷酸化Ser473和Thr308位点刺激AKT的活化,AKT活化后可通过调节下游分子表达,从而影响肿瘤生长[22]。上皮间质转化(epithelial mesenchymal transformation,EMT)与肿瘤侵袭、转移密切相关,E-cadeherin是EMT过程的标志物,其表达降低可促进肿瘤的侵袭和转移[23]。Caspase 3 是凋亡相关的Caspase家族效应蛋白,其活化可促进细胞凋亡[24]。有研究显示,lncRNA TTN-AS1可通过调控PTEN/PI3K/AKT信号通路影响胃癌进展[25]。 本研究结果显示,抑制TTN-AS1表达及过表达miR-1271均可下调PI3K、p-AKT和细胞增殖标志物PCNA表达,上调E-cadherin和cleaved caspase 3表达,同时抑制TTN-AS1和miR-1271可逆转抑制TTNAS1对PI3K、p-AKT、PCNA、E-cadherin和cleaved caspase 3表达的影响;lncRNA TTN-AS1可通过靶向调节miR-1271/PDK1并抑制PI3K/AKT信号通路影响肺癌细胞生长。
综上所述,本研究发现抑制lncRNA TTN-AS1表达可降低肺癌细胞增殖和侵袭能力,并促进细胞凋亡,机制可能与靶向miR-1271/PDK1分子并抑制PI3K/AKT信号通路有关。

