宫腔粘连内膜纤维化进展与TGF-β1/Smads信号通路的相关性研究*
牛红萍,姜丽娟,张永会,彭强丽,詹兴秀,秦光贵,胡红娟
(1.云南中医药大学,云南 昆明 650500;2.云南省中医医院/云南中医药大学第一附属医院,云南 昆明 650021)
子宫是产生月经、接受胚胎着床并生长发育的场所,为一肌性空腔器官,可随女性不同时期生理现象发生不同改变。当宫腔遭受感染,或直接机械性创伤,可导致子宫内膜瘢痕化修复,出现宫腔、宫颈管不同程度的粘连、闭塞,临床称为宫腔粘连(intrauterine adhesion,IUA)。1948年Asherman对IUA进行了症状、诊断等的详细报道,故又称Asherman综合征[1]。IUA主要临床表现为月经过少,可伴或不伴经行腹痛,甚至闭经;主要危害是不孕、自然流产、复发性流产、胚胎种植反复失败等不良妊娠结局,以及胎盘植入、胎盘残留等产科并发症。创伤和感染是导致IUA的两大主要病因,但迄今为止,IUA确切的发病机制仍在探索中,对其防治以及改善妊娠结局仍是生殖医学的瓶颈问题。目前大多学者认为IUA是一种子宫内膜纤维化疾病。TGF-β1/Smads信号通路是调控组织器官纤维化的经典通路,而中医药对该信号通路有调节作用[2]。因此,笔者团队通过调取本院IUA患者子宫内膜病理切片,采用苏木素-伊红(HE)染色检测腺体计数、Masson染色检测纤维化程度,免疫组化法(IHC)检测与TGF-β1/Smads信号通路相关的TGF-β1、Smad2、Smad3、Smad7 表达,进行回顾性分析,明确TGF-β1/Smads信号通路与IUA发生发展的相关性,为进一步临床防治研究提供理论依据。
1 资料与方法
1.1 临床资料 2018年1月-2019年5月因人工流产、诊断性刮宫、自然流产清宫术后出现月经量少、闭经、痛经、不孕、自然流产等在云南中医药大学第一附属医院(云南省中医医院)妇科就诊患者,经宫腔镜检查证实为IUA,并按照纳入标准纳入病例30例(轻、中、重各10例);非IUA患者10例,为同期因宫内膜增厚行宫腔镜下诊刮术,且内膜组织病检证实为子宫内膜单纯性增生。纳入标准:参照2015年中国宫腔粘连诊断分级评分标准,宫腔镜确诊为IUA,评分为1~20分,其中0~5分为轻度粘连;6~10分为中度粘连;11~20分为重度粘连。排除标准:子宫内膜结核、子宫发育畸形;合并有黏膜下肌瘤、子宫内膜癌、宫颈癌、乳腺癌等恶性肿瘤;有血栓性疾病。所有患者自愿加入研究并签署知情同意书。本实验研究经医院伦理委员会批准,伦理文件批号:YNSZLL-AF-004-2020/03。
1.2 主要实验仪器及试剂 Thermo EXCELSIOR AS全自动脱水机(上海);BM-Ⅷ生物组织包埋机;Thermo FINESS E+半自动切片机CS-Ⅵ型摊片烤片机;Nikon Ci显微镜(日本);OPLENIC DIGITAL CAMERR图像采集软件(四川西陇科学);Motic MedA数码医学图像分析系统(四川西陇科学);兔抗人Smad2/3/7一抗(Bios);兔抗人 TGF-β1(Bios);免疫组化显色试剂(DaKo);抗体稀释液(福州迈新生物技术);封闭羊血清(福州迈新生物技术)。
1.3 方法 所有组织标本按照常规标准操作步骤进行洗涤、脱水、透明、浸蜡、包埋、切片、展片、贴片、烤片。各组内膜组织HE染色及Masson染色后,采用Motic MedA数码医学图像分析系统显微镜下观察,每张切片选10个高倍视野(HE:200×;Masson:200×)。HE染色用于检测内膜腺体计数,Masson染色用于检测各组子宫内膜纤维化面积。IHC检测与TGF-β1/Smads信号通路相关的 TGF-β1、Smad2、Smad3、Smad7表达水平情况。严格按照试剂盒说明书进行操作。
1.4 结果评定标准 IHC结果评定标准:阳性表达为棕黄色。阴性表达为无着色。参照文献[2]制定结果评分标准。根据阳性细胞的百分率分别给予1~5分:1分:阳性率为1%~10%;2分:阳性率为11%~25%;3分:阳性率为分26%~50%;4分:阳性率为51%~75%;5分:阳性率为76%~100%。Masson染色结果评定标准:胶原纤维呈蓝色。细胞质、肌纤维和红细胞为红色。
1.5 统计学处理 采用SPSS23.0统计软件包进行统计分析,计量资料均以表示。对于正态分布,组内比较采用配对样本t检验,2组组间比较采用独立样本t检验,多组间比较采用单方差分析;对于非正态数据,采用非参数检验方法,组内比较采用威尔-科克森符号秩检验,2组组间比较采用曼-惠特尼U检验,多组组间比较采用Kruskal-Wallis检验;显著性水平为0.05。
2 结果
2.1 腺体计数 非粘连组腺体丰富,呈圆形或长椭圆形。粘连组腺体稀少。与非粘连组比较,粘连组腺体计数明显下降,差异显著(P<0.001),且与粘连程度呈负相关。见表1、图1。
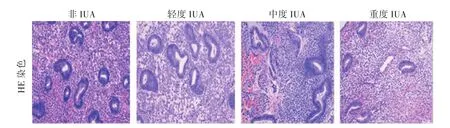
图1 子宫内膜HE染色(200×)
2.2 子宫内膜胶原纤维面积比 非粘连组蓝染区域不明显,胶原纤维面积小。粘连组可见明显蓝染区域,胶原纤维面积广泛。与非粘连组比较,粘连组胶原纤维面积明显增加,差异显著(P<0.001),且与粘连程度呈正相关。见表1、图2。
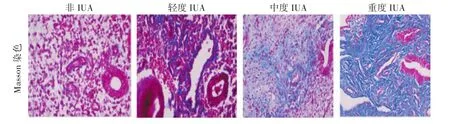
图2 子宫内膜Masson染色(200×)
表1 各组子宫内膜腺体计数、内膜纤维化面积(±s,n=10)

表1 各组子宫内膜腺体计数、内膜纤维化面积(±s,n=10)
注:与非粘连组比较,△P<0.001;与轻度IUA组比较,▲P<0.05。
组别 腺体计数(个/H P) 纤维化面积(%)非粘连组 4 8.1 3±6.5 5 0.4 8 9±0.2 4 1轻度I U A组 2 4.8±2.1 5△ 1 2.9 2±5.0 5 4△中度 I U A 组 1 8.7±1.3 4△▲ 2 5.8 2±2.6 3 6△▲重度 I U A 组 1 2.1±2.0 8△▲ 3 2.5 0±6.9 6 9△▲
2.3 IHC检测各组子宫内膜组织中TGF-β1、Smad2/3/7的表达 TGF-β1在粘连组、非粘连组子宫内膜腺上皮和间质均有表达,但主要表达于腺上皮细胞。与非粘连组比较,IUA组TGF-β1高表达,并与粘连程度呈正相关,差异显著(P<0.01)。Smad2在粘连组、非粘连组子宫内膜腺上皮细胞和间质细胞均有表达,与非粘连组比较,粘连组Smad2呈高表达,差异显著(P<0.01),但与粘连程度无明显相关(P>0.05)。Smad3在非粘连组中主要表达于腺上皮,在粘连组中腺上皮、间质均有表达。与非粘连组比较,粘连组呈高表达,差异显著(P<0.01),并与粘连程度呈正相关。Smad7在腺上皮、间质中均有表达。在非粘连组中,Smad7高表达,在粘连组中呈低表达。与非粘连组比较,差异显著(P<0.01),并与粘连程度呈负相关。见表2、图 3-图 6。
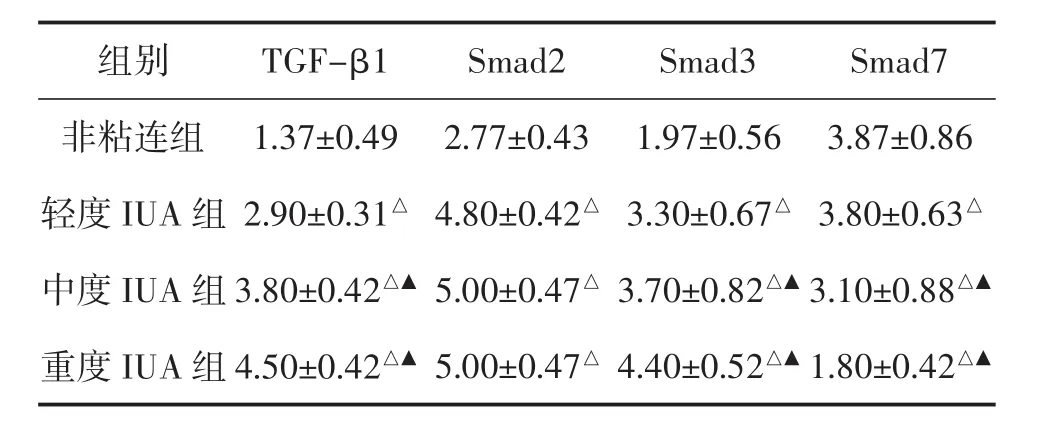
表2 各组子宫内膜TGF-β1、Smad2/3/7免疫组化评分(x ± s,n=10)
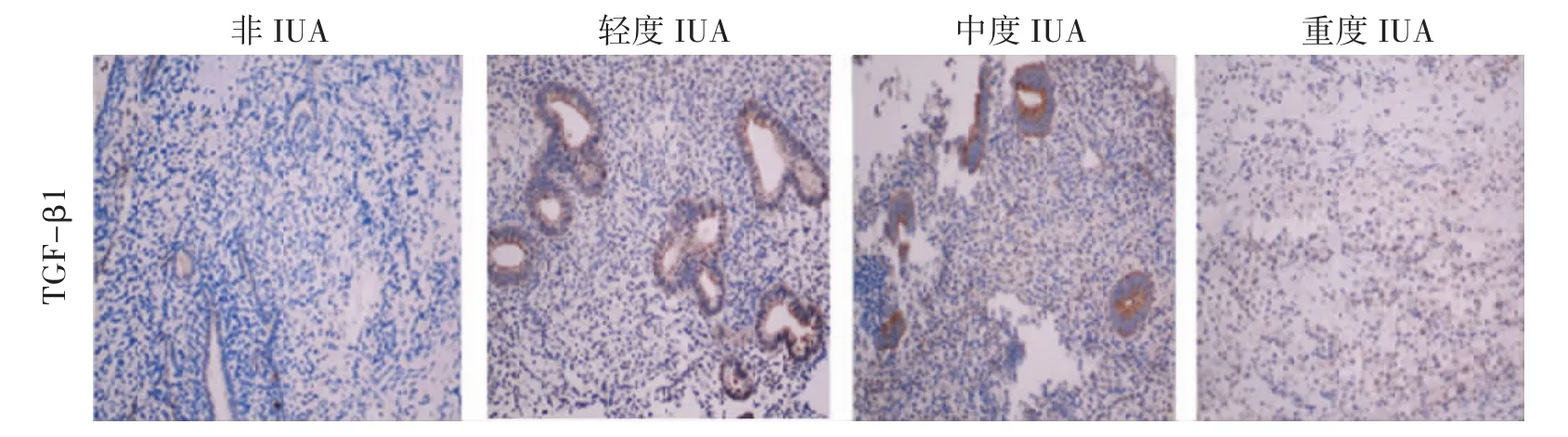
图3 子宫内膜TGF-β1免疫组化染色(200×)
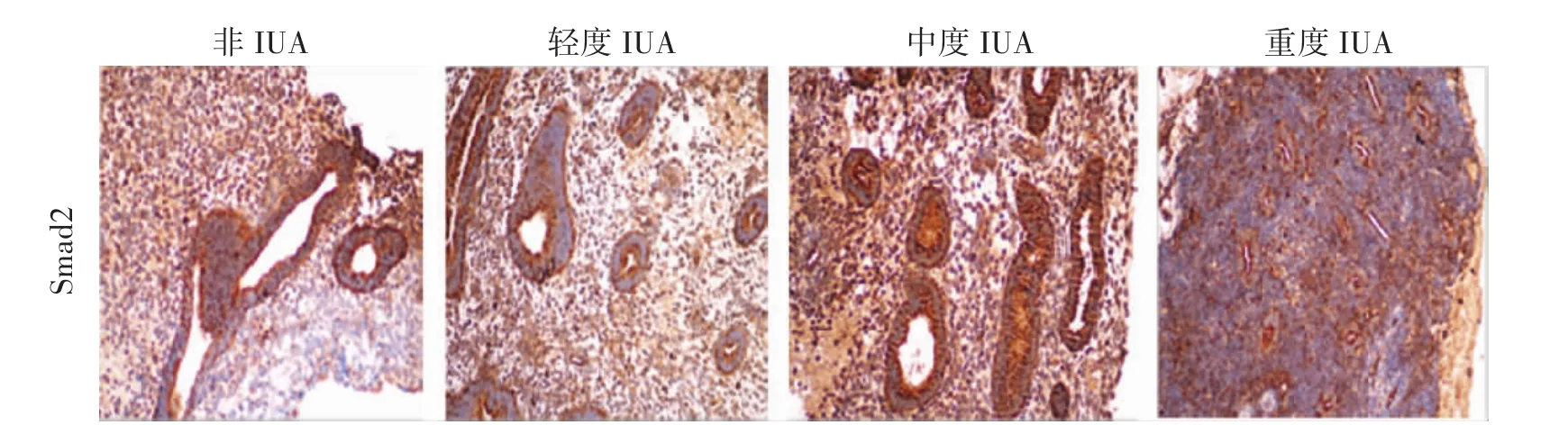
图4 子宫内膜Smad2免疫组化染色(200×)
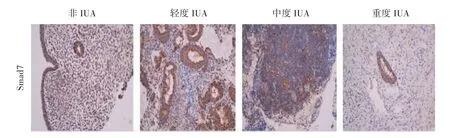
图6 子宫内膜Smad7免疫组化染色(200×)
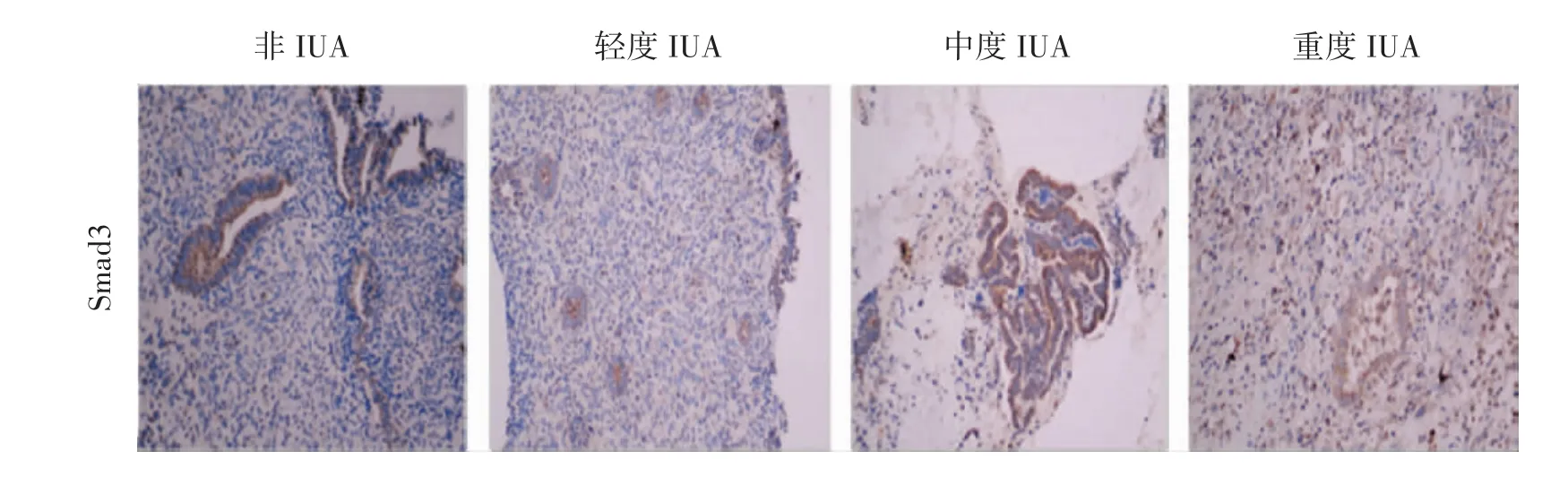
图5 子宫内膜Smad3免疫组化染色(200×)
3 讨论
人子宫内膜由黏膜上皮、腺体、间质和血管等组成,可分为功能层和基底层。功能层占据子宫内膜的上三分之二,可随着卵巢激素的调控周期性的增殖和脱落,形成规律月经,接受胚胎植入。基底层主要由基质以及丰富的大血管等组成,是子宫内膜的生发区域,其完整性和连续性对内膜的再生及修复起着决定性的作用。生理情况下,子宫内膜可无痕化再生及修复[3]。人工流产负压吸引术,稽留流产清宫术、葡萄胎清宫术、产后胎盘残留清宫术、人流不全清宫术,诊断性刮宫术、子宫内膜病变切除是常见的宫腔手术,也是目前公认引起IUA的常见病因[4-5]。
尽管目前一致认为子宫内膜损伤是引起IUA的主要病因,但迄今为止,其确切发病机制尚不清楚。文献表明,子宫内膜组织细胞因子、酶、受体、蛋白、微RNA、基因、干扰素-γ(IFN-γ)等异常表达参与了 IUA的发生发展。就细胞因子而言,白介素-18(IL-18)、肿瘤坏死因子-α(TNF-α)及血管内皮生长因子(VEGF)、TGF-β1、胰岛素样生长因子-Ⅰ(IGF-Ⅰ)、转录调节因子核因子-κB(NF-κB)、结缔组织生长因子(CTGF)、血小板源性生长因子 BB(PDGF-BB)以及碱性成纤维细胞生长因子(bFGF)高表达参与了IUA发生发展[6-10]。IFN-γ是Th1细胞的特异性因子,研究表明IFN-γ在粘连组织及粘连旁内膜组织的低表达参与了IUA的形成。酶的异常主要与基质金属蛋白酶-9(MMP-9)低表达有关[11-12]。但有研究认为MMP-9表达上调参与了IUA的形成[13]。受体异常与Toll样受体4、雌激素受体高表达、生长激素受体低表达有关[14-16]。蛋白异常主要与骨桥蛋白、锌指蛋白Snail、Smad2/3蛋白的高表达有关[17-18]。微RNA主要与miR-29、miR-665低表达有关[19]。此外叉头框F2(Fox F2)高表达亦参与了IUA的发生[20]。
转化生长因子-β(transforming growth factor-β,TGF-β)是一类参与细胞生长、分化调节等多种生理功能的细胞因子。目前哺乳动物中已发现有TGF-β1、TGF-β2、TGF-β3三个亚型,均由 112 个氨基酸组成,具有70%~82%的同源性,生物学作用相似。机体内几乎所有正常及病理组织均能合成释放某种TGF-β家族成员,并表达该家族成员的膜结合受体,但其中以TGF-β1活性最强[21-22]。TGF-β1是迄今发现的最强致纤维化因子,且在纤维化疾病发病过程中起核心作用,能和成纤维细胞当中的特异性受体相结合,实现对多条信号传导通路的激活。Smads蛋白家族是其下游激活蛋白,可介导细胞外信号经膜受体致细胞内的转导。TGF-β1/Smads信号通路是经典的纤维化信号通路,由 TGF-β1、TGF-β1受体(TGF-βR)、Smads蛋白家族以及调控基因等组成。TGF-β1通过与受体结合激活信号转导至下游Smads家族。在TGF-βR 中,TGF-βRⅠ和 TGF-βRⅡ为结构相似的单次跨膜糖蛋白和跨膜的丝氨酸/苏氨酸激酶受体,是TGF-β1信号传导的主要受体[23-24]。Smads蛋白家族根据结构和功能特性分为受体调节Smads(RSmads)、共同通路性Smads(Co-Smads)和抑制性Smads(I-Smads)三类。Smad2/3 是 TGF-β1 信号下传的首个信号分子,属于R-Smads。Smad4是信号通路必需的转运分子,可将信号转至胞核,在核内调节各基因的转录属Co-Smads。Smad7可与Smad2或Smad3竞争结合 TGF-β1受体,阻断 Smad2或Smad3被磷酸化及转位至细胞核内,抑制TGF-β1信号转导,起负调节作用,属于I-Smads[25-27]。
任何事件致子宫内膜基底层损伤造成的上皮细胞及间质细胞再生受阻、血管新生障碍、成纤维细胞增生,以及细胞外基质(extracellular matrix,ECM)合成与降解失衡等,均可引起纤维结缔组织增殖[28]。文献[29-30]表明TGF-β1在子宫内膜、宫腔液中均分布广泛,可通过旁分泌或自分泌作用,调节子宫内膜细胞的增殖、分化、凋亡;对细胞外基质的合成、创伤的修复、免疫功能具有重要的调节作用。研究[31-32]表明无论是IUA术后创面渗出液中,还是子宫内膜组织中TGF-β1水平均显著升高,认为其参与了IUA的发生发展。与此同时,研究[33-34]发现在重度粘连内膜组织中,TGF-β1、Smad4、Smad3 表达明显上调,而Smad7表达明显下调,且TGF-β1与Smad4、Smad3呈正相关,与Smad7则呈负相关;在TGF-β1/Smad信号通路中,Smad3正调控过度和Smad7负调控不足可能促进了IUA的形成。本研究结果显示,IUA组腺体稀少,纤维化面积广泛,且纤维化面积与粘连程度呈正相关;IHC检测结果显示,IUA组 TGF-β1、Smad3、Smad2表达明显上调,Smad7表达明显下调,差异显著(P<0.01),且其中 TGF-β1、Smad3与粘连程度呈正相关,Smad7与粘连程度呈负相关,而Smad2与粘连程度无明显相关,与目前研究具有一致性。综上,纤维化进展参与了IUA的发生发展,且内膜组织纤维化程度与粘连程度呈正相关,而TGF-β1/Smad信号通路激活可能参与了IUA内膜纤维化。内膜纤维化导致内膜容受性低下,而目前尚缺乏特意性有效药物防治内膜纤维化,文献[35]表明中医药对该信号通路具有调节作用,因此本研究结果认为TGF-β1/Smad信号通路可作为中医药改善IUA内膜纤维化的作用靶点。但由于本研究样本量小,主要以IHC为检查手段,因此仍需进一步深入研究,但目前IHC是临床病理检测主要措施,且经济适用,因此对临床仍具有一定价值。

