匹伐他汀联合用药体外抗HIV-1活性研究*
杨金轩,罗荣华,陈 欢,郑永唐△
(1.云南中医药大学中药学院,云南 昆明 650500;2.中国科学院昆明动物研究所,中国科学院动物模型与人类疾病机理重点实验室,云南 昆明 650223)
他汀类药物是羟甲戊二酰辅酶A还原酶竞争性抑制剂,自美国FDA于1987年批准洛伐他汀上市以来,先后出现了辛伐他汀、氟伐他汀、瑞舒伐他汀、普伐他汀及阿托伐他汀等(化学结构式见图1),其具有抗氧化、抗炎、调节一氧化氮合成、改善内皮功能等多种药理作用,主要用于心血管疾病的治疗[1-2]。
图1 他汀类药物的化学结构式
人类免疫缺陷病毒(human immunodeficiency virus,HIV)主要攻击宿主的CD4+T细胞,引起细胞耗竭、免疫缺陷,最后出现威胁生命的机会性感染。当前治疗艾滋病最为有效的方法仍然是联合抗逆转录病毒疗法(combined antiretroviral therapy,cART),可以将病毒载量控制在检测限水平以下、恢复和稳定CD+T细胞的数量、降低炎症及免疫激活标志物水平,但有研究显示HIV感染者经cART治疗后产生的相关代谢疾病会使心血管疾病风险增加[3-6]。HIV相关的动脉粥样硬化性心血管疾病涉及的机制是复杂的,不仅与血脂异常、胰岛素抵抗及高血压等传统因素相关,也和HIV感染产生的慢性炎症及免疫激活与抑制有关[7-9]。
随着“发现即治疗”策略的出现,使艾滋病从致死性疾病转变为可以治疗但难以治愈的慢性疾病,延长了患者的存活期,HIV感染者老龄化和长期cART治疗也势必增加心血管疾病的患病率。他汀类药物具有广泛的抗炎和免疫调节作用,这对HIV感染人群是十分有益的。目前他汀药物如何调节HIV患者免疫功能的机制尚未完全阐明,有研究显示他汀类药物可能具有抗HIV活性[10]。本研究想探寻他汀类药物的抗HIV活性机制并在体外评价匹伐他汀与其它抗HIV药物联合用药时的联合抗病毒效应,旨在寻求适宜的联合用药方案。
1 材料与方法
1.1 试剂 噻唑蓝(3,(4,5-dimethylthiazol-2-yl,噻唑蓝)-2,5-diphenyl tetrazolium bromide,MTT)、氯化钠、氯化钾、磷酸二氢钾、磷酸氢二钠、Triton X-100、青霉素、Tween 20和抗IgG Fc抗体(Sigma公司产品);辣根过氧化物酶(HRP)标记羊抗兔IgG抗体(KPL公司);十二烷基硫酸钠(Sodium dodecyl sulfate,SDS)(BioFR0XX 公司);二甲基亚砜(Dimethyl sulfoxide,DMSO)(VWR Life Science AMRESCO 公司);硫酸链霉素(Solarbio公司);N,N-二甲基甲酰胺DMF(N,N-dimethylformamine,DMF)(成都市科隆化学品有限公司);30%过氧化氢(西陇科学股份有限公司);RPMI-1640和胎牛血清(Fetal bovine serum,FBS)(Gibco公司);脱脂奶粉(内蒙古伊利实业集团股份有限公司);抗HIV p24单克隆抗体和兔抗HIV-1 p24多克隆抗体(本实验室)。
1.2 仪器 离心机(Allegra X-30,Beckman),二级生物安全柜(1287,Thermo),CO2细胞培养箱(3111,Thermo),2~8 ℃冰箱(HYC-360,Haier),-20 ℃冰箱(BCD-196E/D,Haier),-80 ℃冰箱 (386L,-86 ℃,Thermo),酶标仪(800TS,Bioteck),倒置显微镜(TS-100F,Nikon)。
1.3 待测化合物及阳性对照药物 依曲韦林(E-travirine,ETR)(山东大学刘新泳教授馈赠);雷特格韦(Raltegravir,RAL)(默沙东制药有限公司);拉米夫定(Lamivudine,3TC)、齐多夫定(Zidovudine,AZT)、茚地那韦(Indinavir,IDV) 和达芦那韦(Darunavir,DRV)(大连美仑生物技术有限公司);恩曲他滨(Emtricitabine,FTC)(北京中硕医药科技开发有限公司);替诺福韦(Tenofovir,TDF)(黄石福尔泰医药科技有限公司);普伐他汀钠(Pravastatin sodium)、洛伐他汀(Lovastatin)、辛伐他汀(Simvastatin)、瑞舒伐他汀(Rosuvastatin)、阿托伐他汀(Atorvastatin)、匹伐他汀 (Pitavastatin) 和度鲁 特韦(Dolutegravir,DTG)(Macklin公司)。
1.4 细胞与病毒 人T淋巴细胞C8166细胞系、实验株HIV-1IIIB由NIH AIDS Reagent Progrom惠赠。根据常规方法培养制备HIV-1病毒并进行感染性滴度测定,将病毒小量分装,-80℃保存。C8166细胞培养于含10% FBS的RPMI-1640培养基,实验前1天进行传代使细胞处于对数生长期。
1.5 他汀类药物对C8166细胞的毒性实验 96孔板内将药物进行5倍梯度稀释,共设置6个药物浓度,每个药物浓度设 3个复孔(100 μL/孔),同时设置无药物的阴性对照孔(NC)和空白对照孔(BC)。除BC孔外,每孔加入100 μL的细胞悬液。在37℃,5% CO2培养箱培养3 d,采用MTT法测定化合物对不同细胞的毒性。800TS酶标仪在570/630 nm波长下测定OD值,计算半数细胞毒性浓度(The 50% cytotoxicity concentration,CC50)。
1.6 他汀类药物对HIV-1IIIB致C8166细胞病变的抑制作用 96孔板内将药物进行5倍梯度稀释,共设置6个药物浓度,每个药物浓度设3个复孔(100 μL/孔)。每孔加 50 μL C8166 细胞悬液与 50 μL HIV-1IIIB病毒稀释液(1300 TCID50),同时设置含C8166细胞与病毒的阳性对照孔(PC),置于37℃,5% CO2培养箱内培养。第3天在倒置显微镜下(100×)观察合胞体的形成并计数,计算半数有效浓度(The 50% effective concentration,EC50)[11]。
1.7 他汀类药物对HIV-1IIIB急性感染C8166细胞中病毒复制的抑制作用 将C8166细胞悬液与HIV-1IIIB病毒液(2000 TCID50)混匀,置 37 ℃感染4 h后加入适量1×PBS缓冲液离心洗涤以便去除游离的病毒,用培养基重悬细胞备用。
96孔板内将药物进行5倍梯度稀释,共设置6个药物浓度,每个药物浓度设3个复孔(100 μL/孔),同时设置无药物的阳性对照孔(PC)和空白对照孔(BC)。除BC孔外,每孔加入100 μL上述细胞,轻轻振动混匀,37℃,5% CO2培养箱培养。第3天收集细胞培养上清,用终浓度为5% Triton X-100裂解灭活。采用ELISA测定HIV-1 p24蛋白检测药物对HIV-1复制的抑制作用,计算EC50[12-13]。
1.8 匹伐他汀与ETR等9个药联合用药对HIV-1IIIB急性感染C8166细胞中病毒复制的抑制作用 96孔板内,按匹伐他汀、ETR、FTC、AZT、3TC、TDF、DTG、RAL、IDV和DRV单药对急性感染C8166细胞中抑制 HIV-1IIIB复制的 EC50值,设置 8× EC50、4 × EC50、2 × EC50、EC50、0.5 × EC50、0.25 × EC50、0.125 × EC50、0.0625×EC50共8个药物梯度,分别设置单药组和联合用药组。将C8166细胞悬液与HIV-1IIIB(2000 TCID50)混匀,在 37 ℃下感染 4 h,1×PBS缓冲液洗涤2次以便去除游离的病毒,用培养基重悬细胞备用。
取上述100 μL细胞接种到含有100 μL不同浓度梯度稀释化合物的96孔板上,置37℃,5% CO2培养箱培养。第3天收集培养上清,用终浓度为5% Triton X-100裂解灭活。ELISA测定HIV-1 p24蛋白检测药物对HIV-1复制的抑制作用,计算EC50。用CompuSyn 软件计算联合指数(combination index,CI)和剂量降低系数(dose reduction index,DRI)[14-15]。
2 结果
2.1 他汀类药物对C8166细胞的毒性 本研究采用MTT法检测了他汀类药物对C8166细胞的毒性,发现普伐他汀、瑞舒伐他汀、辛伐他汀、洛伐他汀对C8166 细胞无毒性作用,CC50>200 μmol·L-1;匹伐他汀和阿托伐他汀对C8166细胞有一定的毒性作用,CC50分别为105.67±1.68、99.49±2.08 μmol·L-1(图2,表 1)。
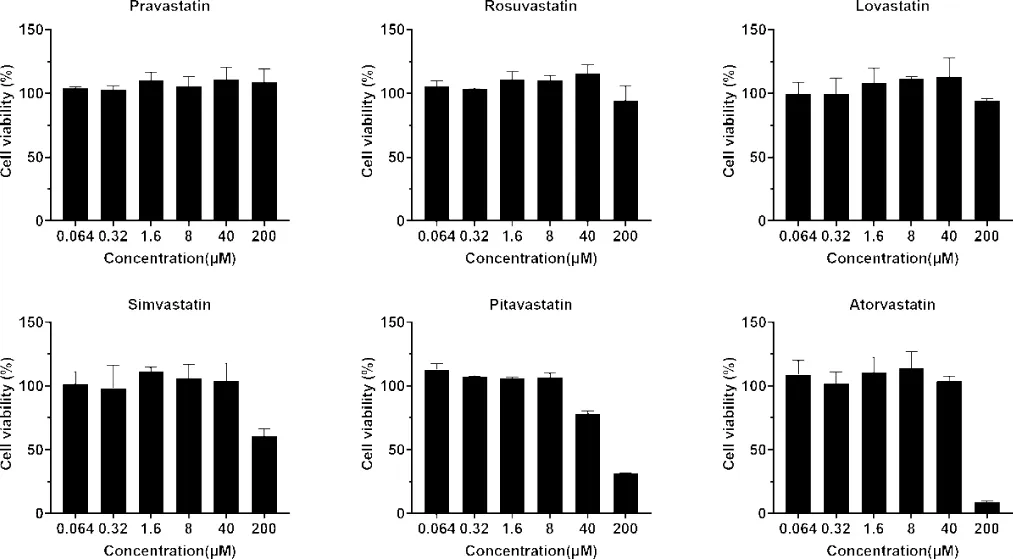
图2 他汀类药物对C8166细胞的毒性作用
2.2 他汀类药物的体外抗HIV-1活性 采用合胞体计数和ELISA检测p24抗原的方法评估了他汀类药物的体外抗HIV-1活性。研究发现普伐他汀、瑞舒伐他汀、阿托伐他汀、辛伐他汀、洛伐他汀的治疗指数未超过10,无抗HIV活性。匹伐他汀经2种方法检测均有一定的抗病毒效应,EC50分别为5.12±1.44、9.88 ±4.55 μmol·L-1,因此,我们选择匹伐他汀进行进一步研究(表1)。
表1 他汀类药物体外抗HIV-1活性(±s,n=2)

表1 他汀类药物体外抗HIV-1活性(±s,n=2)
注:CC50,半数细胞毒性浓度;EC50,半数有效浓度;TI,治疗指数。
E C 50(μ m o l·L-1) T I s y n c y t i u m p 2 4 s y n c y t i u m p 2 4 P r a v a s t a t i n >2 0 0 >2 0 0 >2 0 0 i n a c t i v e i n a c t i v e R o s u v a s t a t i n >2 0 0 1 0 5.5 6±3 2.6 1 9 2.3 1±1 7.8 1 >1.8 9 >2.1 6 P i t a v a s t a t i n 1 0 5.6 7±1.6 8 5.1 2±1.4 4 9.8 8±4.5 5 2 0.6 3 1 0.6 9 A t o r v a s t a t i n 9 9.4 9±2.0 8 2 1.3 3±2.4 2 1 8.6 6±1.4 7 4.6 6 5.3 3 S i m v a s t a t i n >2 0 0 1 2.5 1±2.1 4 9 2.4 9±9.2 2 >1 5.9 8 >2.1 6药物 C C 50(μ m o l·L-1)L o v a s t a t i n >2 0 0 5 9.0 5±0.0 4 9 2.7 7±8.6 8 >3.3 8 >2.1 6
2.3 匹伐他汀与其它抗HIV药物的联合用药 HIV与心血管疾病风险增加有关,心血管并发性严重影响患者的生存质量和预期寿命,可能需服用他汀类药物的治疗。我们发现匹伐他汀除了降血脂外,还有一定的抗HIV-1活性,因此,进一步研究匹伐他汀与其它抗HIV药物联合的抗病毒效应。采用周氏中效模型原理设计联合用药的实验方案和数据处理[16-18],主要评价参数为CI值和DRI值。当CI值>1.1时,药物间呈现拮抗作用;0.9≤CI值≤1.1时,药物间呈现相加作用;CI值<0.9,药物间呈现协同作用[19]。DRI值是指达到同一效应时药物联用的剂量比药物单用剂量降低的倍数。DRI值越大,则表明药物联合时剂量降低得越多,可降低药物毒副作用的发生和减缓耐药病毒株的出现。
结果如表2所示,匹伐他汀与核苷类逆转录酶抑制剂(nucleoside reverse transcriptase inhibitors,NRTIs)TDF、FTC、3TC、AZT 联合用药时的联合指数分别为 0.56±0.14、0.67±0.15、0.69±0.11、0.80±0.12,药物间呈现协同作用;匹伐他汀与蛋白酶抑制剂(protease inhibitor,PI)IDV和DRV联合用药时联合指数分别为0.76±0.17、0.58±0.15,药物间呈现协同作用;匹伐他汀与非核苷类逆转录酶抑制剂(non-nucleoside reverse transcriptase inhibitors,NNRTIs)ETR联合用药时的联合指数为1.18±0.05,药物间呈现拮抗作用;匹伐他汀与整合酶链转移抑制剂(Integrase strand transfer inhibitors,INSTIs)RAL 和 DTG 联合用药时的联合指数分别为1.03±0.04、1.03±0.02,药物间呈现相加作用。匹伐他汀与其他抗HIV药物联用时,每组单药的DRI值均>1,两药联用时剂量比药物单用剂量降低1.10~14.50倍。
表2 匹伐他汀与不同抗HIV药物联合用药(±s,n=2)

表2 匹伐他汀与不同抗HIV药物联合用药(±s,n=2)
注:CI值,联合用药指数;DRI值,剂量降低指数。
E D 50 E D 75 E D 90 E D 95 P i t a v a s t a t i n+T D F P i t a v a s t a t i n 2.9 9±0.9 1 3.3 4±0.5 8 3.7 8±0.1 5 4.1 2±0.2 2 0.5 6±0.1 4 协同T D F 2.3 2±1.0 4 3.1 0±1.3 2 4.1 4±1.6 6 5.0 4±1.9 4 P i t a v a s t a t i n+F T C P i t a v a s t a t i n 9.4 3±7.0 7 9.8 7±3.5 4 1 1.4 4±1.1 6 1 3.4 5±5.4 9 0.6 7±0.1 5 协同F T C 1.5 7±0.3 7 1.6 9±0.4 4 1.8 3±0.5 1 1.9 3±0.5 6 P i t a v a s t a t i n+3 T C P i t a v a s t a t i n 5.1 4±0.5 2 5.7 7±1.9 4 7.0 9±5.0 7 8.5 2±7.8 0 0.6 9±0.1 1 协同3 T C 1.5 6±0.0 4 1.7 9±0.0 5 2.0 6±0.0 7 2.2 6±0.0 8 P i t a v a s t a t i n+A Z T P i t a v a s t a t i n 1 4.3 4±1 2.9 9 8.0 5±3.9 3 5.1 9±0.2 9 4.2 1±1.8 0 0.8 0±0.1 2 协同A Z T 1.1 2±0.1 7 1.4 3±0.3 0 1.8 2±0.4 8 2.1 5±0.6 4 P i t a v a s t a t i n+I D V P i t a v a s t a t i n 2.6 8±0.2 0 4.0 9±0.1 7 6.2 6±0.9 7 8.4 0±1.9 5 0.7 6±0.1 7 协同I D V 1.3 7±0.2 9 1.6 0±0.3 9 1.8 7±0.5 1 2.0 7±0.6 1 P i t a v a s t a t i n+D R V P i t a v a s t a t i n 5.7 5±0.6 3 5.5 6±1.1 8 5.4 1±1.6 9 5.3 3±2.0 2 0.5 8±0.1 5 协同D R V 2.8 8±0.3 1 2.7 4±0.2 0 2.6 5±0.6 6 2.6 2±0.9 6 P i t a v a s t a t i n+E T R P i t a v a s t a t i n 3.1 8±0.0 8 3.8 9±0.2 8 4.7 7±0.5 6 5.4 7±0.8 1 1.1 8±0.0 5 拮抗E T R 1.0 4±0.1 1 1.0 4±0.0 3 1.0 4±0.0 4 1.0 5±0.0 9 P i t a v a s t a t i n+R A L P i t a v a s t a t i n 4.0 5±2.1 4 3.2 7±1.0 0 2.7 2±0.1 8 2.4 5±0.2 5 1.0 3±0.0 4 相加R A L 1.5 2±0.5 6 1.5 1±0.2 9 1.5 3±0.0 0 1.5 6±0.2 0 P i t a v a s t a t i n+D T G P i t a v a s t a t i n 2.0 5±0.4 1 2.1 1±0.6 3 2.1 9±0.8 7 2.2 4±1.0 4 1.0 3±0.0 2 相加药物 单药 D R I值 C I值 联合效果D T G 1.6 0±0.2 3 1.5 7±0.1 3 1.5 5±0.0 3 1.5 4±0.0 4
3 讨论
HIV相关的血脂异常和HIV感染者的心血管疾病通常使用他汀类药物作为初始治疗,然而他汀类药物与PIs、可比西他、依法韦仑会存在药物相互作用,并且药物剂量的高低也会影响治疗效果,在某种程度上限制了临床应用[20-21]。HIV相关的心血管疾病日益受到关注,他汀类药物具有诸多优势且显现出越来越多“老药新用”的功效,如预防淋巴瘤的形成、增强生物或放化疗制剂的效果、降低阿尔兹海默症风险、降低心衰患者的癌症风险及相关死亡率等[22-24],需根据药物间相互作用调整剂量选择合适的用药方案充分利用他汀类药物。
Elahi等[25]研究发现阿托伐他汀通过甲戊二羟酸途径上调p21,从而抑制HIV-1的复制。本文对几种他汀类药物初步筛选之后发现只有匹伐他汀在体外具有抗HIV-1活性作用,但相关的作用机制研究目前尚未完全阐明,有待进一步研究。阿托伐他汀无体外抗病毒活性,与先前报道的结果不一致,可能是由于所选用的细胞系、HIV-1病毒株以及检测方法不同所导致的。
此外,我们进一步评估了匹伐他汀与其他类抗HIV药物联合时所呈现的药物间相互作用是协同、相加或拮抗。本研究中匹伐他汀是一种羟甲戊二酰辅酶A还原酶抑制剂,与其它抗HIV药物作用机制不同,同时鉴于药物联合模型应用的简便高效性,采用周氏中效模型原理设计联合用药方案并用相关软件进行数据处理。当前的cART治疗是由2种NRTIs+1种NNRTI或PI或INSTI组成[26],本研究对临床治疗中常用的9种抗艾滋病药物与匹伐他汀进行联合抗HIV-1药效分析,研究结果显示匹伐他汀除了与NNRTI-ETR联用呈现拮抗作用外,与NRTIs、INSTIs、PIs均呈现相加或协同作用。目前他汀类药物与抗逆转录病毒药物相互作用研究中关于匹伐他汀的支持证据有限,本研究为临床治疗方案的选择提供了一定的参考价值。

