进展性缺血性脑卒中患者血清NGB、MCP-1、IMA的动态变化及临床意义
赵婷 鲁慧 闫秋月 谷聚贤 刘丽鸽 李猛
进展性缺血性脑卒中(progressive ischemic stroke,PIS)系指临床治疗后一段时间内出现的神经功能缺失症状呈进行性加重的缺血性脑卒中,与非PIS患者比较,PIS患者神经功能缺损程度更重,病死率和致残率更高[1]。因此,对PIS进行严重程度和进展程度评估具有重要的临床意义。脑红蛋白(neuroglobin,NGB)是一种神经保护因子,在神经损伤时高度表达,能够保护神经元不受缺血缺氧损伤,并促进神经功能恢复[2]。单核细胞趋化蛋白 1(monocyte chemotaxis protein-1,MCP-1)属趋化因子家族,是单核细胞募集的标志物,其过度表达会促进血管平滑肌细胞增殖,现已被证实参与动脉粥样硬化性疾病发病和进展[3]。缺血修饰蛋白(ischemia modified albumin,IMA)是新型心肌缺血标志物,可敏感地反映心肌缺血状况,近年来研究发现急性脑梗死患者血清IMA水平显著升高,在急性脑梗死的诊断及病情评估等方面颇具应用前景[4]。目前,NGB、MCP-1、IMA与PIS的病情和进展关系尚不明确,因此,本研究探讨血清NGB、MCP-1、IMA水平在PIS患者血清中的动态变化,分析这些指标与PIS发病、疾病严重程度和进展情况的关系,探讨其临床意义,现将结果报道如下。
1 对象和方法
1.1 对象 选择2017年10月至2019年2月沧州市中心医院神经内科收治的缺血性脑卒中患者120例,依据是否为PIS分为PIS组58例,非PIS组62例。PIS组男 30 例,女 28 例,年龄 53~72(62.31±2.35)岁。非 PIS组男 35 例,女 27 例,年龄 51~73(61.95±2.16)岁。纳入标准:(1)符合2014年中国急性缺血性脑卒中诊断标准[5];(2)颅脑CT或MRI提示存在与神经功能定位对应的梗死病灶;(3)发病后第3~7天美国国立卫生研究院卒中量表(national institutes of health stroke scale,NIHSS)评分较发病时≥18%[6];(4)发病至入院<24 h,住院时间>1周;(5)入院前未接受溶栓、抗凝等治疗。排除标准:(1)脑出血、既往脑血管病史、癫痫、阿尔茨海默病等;(2)合并颅脑恶性肿瘤、周围血管疾病;(3)有近3个月急慢性感染、心肌梗死、心绞痛病史;(4)合并肝肾功能不全、免疫系统疾病。另选择同期本院健康体检者50例作为健康对照组,男29例,女21例,年龄50~71(61.05±2.34)岁。3组对象性别、年龄比较差异均无统计学意义(均P>0.05)。本研究经本院医学伦理委员会批准[审批文号:伦(审)A20170419003],受试者或家属均签署同意书。
1.2 方法
1.2.1 病史收集及生化指标检测 收集并比较PIS组、非PIS组高血压、糖尿病、高脂血症病史及入院第1天NIHSS评分。采用日立7600全自动生化分析仪、雅培I2000全自动化学发光免疫分析仪检测PIS组、非PIS组入院48 h内,健康对照组体检当天的血清TC、TG、LDL-C、HDL-C及FPG。
1.2.2 治疗方法 入院后根据PIS组、非PIS组患者自身疾病情况,给予阿司匹林、氯吡格雷抗血小板聚集、阿托伐他汀降脂、硝苯地平等降血压、二甲双胍降血糖、20%甘露醇降颅内压、维生素B6注射液等神经保护等对症支持治疗。
1.2.3 血清NGB、MCP-1、IMA水平检测 PIS与非PIS组患者分别于入院后第1、2、3、7天采集静脉血5 ml(健康对照组于体检当日采集血样)。经4℃3 000 r/min离心15 min,离心半径10 cm,取血清保存于-80℃超低温冰箱保存,48 h内完成检测。采用BIOBASE2000全自动酶联免疫分析仪,测定NGB、MCP-1水平,试剂盒购自北京健乃喜生物技术有限公司。采用日立7600全自动生化分析仪检测血清IMA水平。
1.2.4 疾病严重程度评估 入院后24 h内采用NIHSS评价患者神经功能缺损情况[7]。依据NIHSS评分将PIS组患者分为3个亚组:NIHSS评分≤4分为轻度神经功能损伤患者(轻度亚组),19例;NIHSS 5~14分为中度神经功能损伤患者(中度亚组),26例;NIHSS评分≥15分为重度神经功能损伤患者(重度亚组),13例。
1.2.5 疾病进展情况评估 入院后第7天采用斯堪的纳维亚卒中量表(Scandinavian stroke scale,SSS)[8]评估患者疾病严重程度,分别从意识、强烈局部刺激、凝视功能、面瘫、言语、肌力(上肢、手、下肢)、步行能力评估,总分0~45分。依据SSS评分将PIS组患者分为3个亚组:0~15分为轻型亚组15例;16~30分为中型亚组29例;31~45分为重型亚组14例。
1.3 统计学处理 应用SPSS 25.0统计软件,符合正态分布的计量资料以表示,多组间比较采用单因素方差分析,两两比较采用LSD-t检验,两组间比较采用成组t检验,组内比较采用配对t检验。计数资料以百分率表示,比较采用 χ2检验。NGB、MCP-1、IMA水平与NIHSS、SSS评分的相关性分析采用Pearson相关,并采用logistic回归分析PIS发病的危险因素。P<0.05为差异有统计学意义。
2 结果
2.1 3组对象病史、入院第1天NIHSS评分及生化指标比较 见表1。
由表1可见,PIS组FPG、LDL-C水平高于非PIS组和健康对照组,非PIS组FPG、LDL-C水平又高于健康对照组,差异均有统计学意义(均P<0.05)。PIS组糖尿病和高脂血症比例、入院第1天NIHSS评分均高于非PIS组,差异均有统计学意义(均P<0.05)。3组TC、TG、HDL-C水平比较,差异均无统计学意义(均P>0.05)。

表1 3组对象病史、入院第1天NIHSS评分及生化指标比较
2.2 3组对象不同时点血清NGB、MCP-1、IMA水平比较 健康对照组体检当日的血清NGB、MCP-1、IMA水平分别为(10.12±2.03)μg/ml、(153.26±20.46)pg/ml、(23.51±6.57)U/ml。两组患者不同时点血清 NGB、MCP-1、IMA水平比较见表2。

表2 两组患者不同时点血清NGB、MCP-1、IMA水平比较
由表2可见,PIS组、非PIS组入院后各时间点血清NGB、MCP-1、IMA水平均高于健康对照组,差异均有统计学意义(均P<0.05)。PIS组入院后各时间点血清NGB、MCP-1、IMA水平均持续增高且高于非PIS组,差异均有统计学意义(P<0.01)。非PIS组入院后前3 d血清NGB、MCP-1、IMA水平均持续增高,但第7天低于第3天,差异均有统计学意义(均P<0.05)。
2.3 不同疾病严重程度PIS患者血清NGB、MCP-1、IMA水平比较 见表3。

表3 不同疾病严重程度PIS患者血清NGB、MCP-1、IMA水平比较
由表3可见,重度亚组、中度亚组血清NGB、MCP-1、IMA水平高于轻度亚组,重度亚组上述指标水平高于中度亚组,差异均有统计学意义(均P<0.05)。
2.4 不同疾病进展程度PIS患者血清NGB、MCP-1、IMA水平比较 见表4。
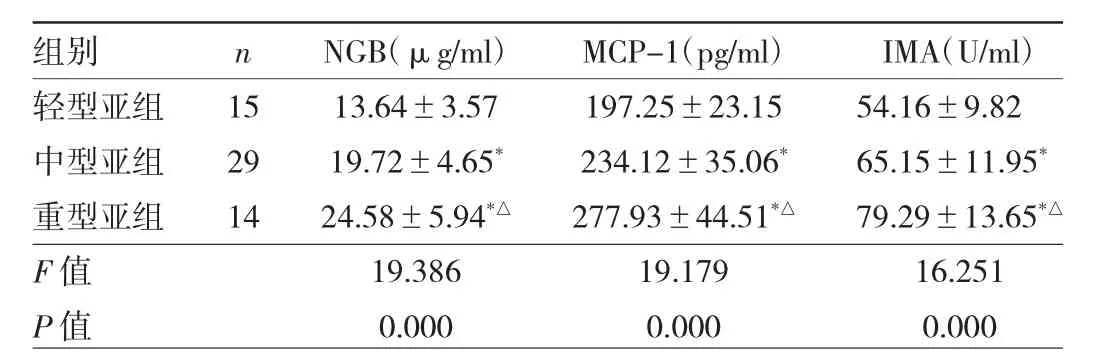
表4 不同疾病进展程度PIS患者血清NGB、MCP-1、IMA水平比较
由表4可见,重型亚组、中型亚组血清NGB、MCP-1、IMA水平高于轻型亚组,重型亚组上述指标水平高于中型亚组,差异均有统计学意义(均P<0.05)。
2.5 PIS患者血清NGB、MCP-1、IMA水平与NIHSS评分、SSS评分的相关性 Pearson相关分析结果显示,PIS患者血清NGB、MCP-1、IMA水平均与NIHSS评分、SSS评分呈正相关(r=0.612、0.594、0.635,0.597、0.712、0.682,均 P<0.05)。
2.6 PIS发病的多因素logistic回归分析 构建PIS发病的logistic回归模型,以是否发生PIS为因变量,纳入FPG、合并糖尿病、合并高脂血症、入院后第1天NIHSS评分、LDL-C、血清 NGB、MCP-1、IMA 为自变量,结果显示LDL-C、NGB、MCP-1、IMA是PIS发病的危险因素(均 P<0.05),见表 5。

表5 PIS发病的多因素logistic回归分析
3 讨论
PIS属于难治性缺血性脑卒中,在发病早期神经功能缺损可能相对较轻,但可呈进行性加重,直至出现严重的神经功能障碍,脑卒中发病后PIS发病率可达34.32%[9]。PIS具有神经缺损更持久、更严重等特点,这大大增加患者残疾率和病死率,因此确定与PIS密切相关的因素和指标有助于早期干预、病情评估和临床结局预判。
NGB是神经组织特异性新型携氧球蛋白,广泛分布于大脑皮质、小脑、下丘脑、海马等脑组织的神经元细胞质和线粒体中,发挥保护神经细胞的功能[10]。本研究观察NGB在PIS组和非PIS组均升高,且PIS组的水平更高,说明PIS组神经组织损伤更为严重,脑组织缺血缺氧刺激诱导下NGB的生成更多,导致血清NGB水平更高。本研究发现非PIS组NGB在升高后出现下降趋势,Xue等[11]观察缺血性脑卒中患者入院72 h血清NGB水平达峰值,与本研究非PIS组血清NGB变化水平较为一致,而PIS组在入院后1周内血清NGB水平一直保持较高水平且持续升高,这与PIS持续神经损伤的病理机制相符合。高NGB水平缺血性脑卒中患者病情重于低NGB水平患者,NGB水平与缺血性脑卒中不良预后有关[12],提示NGB参与缺血性脑卒中疾病进展和不良神经预后的过程,但NGB在PIS病情、疾病进展的报道相对少见。本研究观察发现PIS组血清NGB水平随着病情加重、疾病进展而逐渐升高,NGB水平与NIHSS评分、SSS评分均呈正相关,NGB水平升高是PIS发病的危险因素,提示NGB水平升高参与PIS发病以及持续性神经缺损进展,可能的机制为:PIS患者在脑组织缺血缺氧刺激下NGB大量释放,通过降低氧耗、清除氧自由基和活性氧、保护线粒体功能、抑制神经细胞凋亡、促神经发生等途径抵抗缺血缺氧对脑组织损伤[10]。
MCP-1由内皮细胞、血管平滑肌细胞、成纤维细胞等释放,可特异性趋化单核巨噬细胞黏附聚集,放大炎症反应,是炎症反应的始动因子[13]。动脉粥样硬化是脑卒中发病的主要机制,炎症因子在动脉粥样硬化斑块形成中发挥重要作用,MCP-1被认为是动脉粥样硬化斑块炎症反应标志物[14]。缺血性脑卒中患者血清MCP-1水平明显升高,MCP-1在PIS患者中表达特点尚不清楚,本研究发现,与非PIS比较,PIS患者血清MCP-1水平更高,且这种高水平状态持续时间更久,可能的原因为PIS缺血缺氧程度更为严重,内皮细胞、单核细胞等产生更多的MCP-1,导致更为激烈的炎症反应,炎症介质释放进一步诱导单核巨噬细胞释放更多的MCP-1,提示MCP-1可反映缺血性脑卒中患者入院后疾病进展,为PIS早期诊断提供一定依据。本研究发现MCP-1同样与PIS发病、疾病严重程度和疾病进展程度有关,说明通过监测血清MCP-1动态水平可评估患者疾病进展和神经缺损程度,为预后判断提供参考。MCP-1参与PIS疾病进展的机制为:高浓度MCP-1与其趋化因子受体2结合进而趋化诱导单核巨噬细胞向血管内皮受损部位迁移,大量吞噬脂质形成泡沫细胞,导致动脉粥样硬化斑块形成,MCP-1介导的炎症反应可进一步加剧斑块形成、不稳定斑块脱落和血栓形成,导致脑组织缺血缺氧加重,引起更严重的神经缺损症状[15]。
IMA是急性缺血性事件早期诊断中非常有价值的生化标志物,是一种被降解修饰的人血清白蛋白,发生缺血再灌注时,其氨基酸序列被自由基等破坏,继而与过渡金属结合而产生[16]。急性脑梗死患者血清IMA水平高于正常人群,可作为急性脑梗死早期诊断的敏感指标[17],本研究观察血清IMA水平在PIS患者发病1周内逐渐增高,而非PIS患者血清IMA水平相对较低,提示IMA参与了缺血性脑卒中疾病进展和PIS发病。PIS患者血清IMA水平持续升高的原因为:长时间脑缺血区域灌注不能恢复,导致缺血半暗带持续低灌注,发生不可逆缺血性坏死,不利于侧支循环的建立,低灌注导致氧自由基和代谢产物不断增加,进而导致IMA持续产生,血清水平持续增高[18]。本研究结果证实IMA与PIS发病以及神经缺损程度和疾病进展存在密切关系,分析原因为:自由基反应是IMA形成的关键环节,IMA水平受氧化应激影响,PIS持续脑缺血缺氧造成能量代谢障碍,引起兴奋性神经介质释放,增加钙离子内流,产生大量氧自由基,诱发神经细胞死亡和血脑屏障破坏,氧自由基通过血脑屏障进入血液循环,产生大量IMA[19]。IMA水平升高意味着脑组织过度氧化应激反应和神经组织进行性损伤[20],IMA与NIHSS评分、SSS评分呈正相关,提示监测血清IMA水平或可弥补NIHSS评分、SSS评分不足,更灵敏、准确地评价PIS疾病严重程度和疾病进展程度,为临床诊疗提供参考。
综上所述,PIS患者血清NGB、MCP-1、IMA水平明显升高,且经治疗后在入院7 d内保持较高水平,非PIS组患者经治疗后NGB、MCP-1、IMA水平在短期升高后逐渐回落,血清NGB、MCP-1、IMA水平的动态检测或可作为PIS诊断和评估疾病进展的辅助手段。

