H19基因rs2839698多态性与结直肠癌患病风险的相关性
陈佳园 陈成帷 陈怡 余炳取 陈烁 张益光
结直肠癌是世界第四大致命性癌症,每年约有90万人因结直肠癌死亡[1]。根据2015年中国癌症数据显示,结直肠癌分别位居女性最常见癌症的第4位和男性最常见癌症的第5位[2]。结直肠癌的发病机制复杂,影响因素很多,如吸烟、酗酒、过度肥胖、缺乏体育锻炼、食用大量红肉等[1,3-4],但仍有很多患者并未暴露于这些危险因素中,提示遗传易感性在结直肠癌的发病机制中可能起重要作用[1]。长链非编码RNA(long non-coding RNA,lncRNA)是长度>200个核苷酸的非蛋白质编码转录本,具有转录调控、基因重排、表观遗传修饰、异染色质化等作用[5-6],与影响癌症易感性的各种生物学过程有关[7-8]。H19基因是第一个被发现的lncRNA,位于人类染色体11p15.5上,包含4个内含子和5个外显子[9]。单核苷酸多态性可能影响基因表达和功能,增加癌症易感性。有研究探索了H19基因rs2839698多态性与患癌风险的关系[6,10-13],但不同类型癌症的研究结果是相互矛盾的。Li等[12]发现H19基因rs2839698多态性会增加结直肠癌的发病风险,故本研究对两者的关系作进一步探讨,现将结果报道如下。
1 对象和方法
1.1 对象 选取2012年1月至2018年1月在浙江中医药大学附属温州中西医结合医院接受手术治疗(术前未接受过放化疗)的结直肠癌患者315例为病例组,同期在医院体检且性别、年龄均匹配的健康者441例为对照组,均为汉族。排除有癌症或消化系统疾病家族史、其他来源转移、放化疗史的患者。病例组男60例,女255例;年龄(63.35±7.33)岁;BMI(25.18±1.45)kg/m2;有吸烟史204例;有饮酒史277例;有家族史44例;肿瘤直径>4 cm 165例,≤4 cm 150例;TNM分期:Ⅰ期67例,Ⅱ期90例,Ⅲ期93例,Ⅳ期65例;淋巴结转移133例;组织学分级:高分化32例,中分化248例,低分化35例;组织学分型:腺癌300例,鳞癌13例,其他2例;肿瘤位置:结肠癌113例,直肠癌202例。对照组男87例,女354例;年龄(62.50±7.33)岁;BMI(25.15±1.51)kg/m2;有吸烟史203例;有饮酒史220例。两组对象性别、年龄、BMI比较,差异均无统计学意义(均P>0.05);在吸烟史、饮酒史比较,差异均有统计学意义(均P<0.05)。本研究经浙江中医药大学附属温州中西医结合医院医学伦理委员会审查通过,所有对象签署知情同意书。
1.2 方法
1.2.1 临床资料收集 收集患者人口学信息(性别、年龄、吸烟情况、饮酒情况、家族史等)以及肿瘤直径、肿瘤位置、TNM分期、组织学分级、淋巴结转移、病理组织学分型等。
1.2.2 基因分型检测 采集所有对象外周血2 ml,使用TIANAMP血液DNA试剂盒[DP348-03,200次,天根生化科技(北京)有限公司]提取外周血白细胞基因组DNA;使用 NanoDrop 3300(美国 Thermo Scientific公司)在波长260和280 nm处测定并提取DNA的质量和浓度。本研究采用基于荧光的限制性片段长度多态性方法进行基因分型,用于核苷酸延伸反应的正向引物为CATCGTCCCCAGCTGATGTC,反向引物为GGAGTGATGACGGGGTGGAG;扩增体系为25 μl反应混合液,包括 1.25 μl基因分型 Assays(20×)、20 ng DNA、12.5 μl基因分型Master Mix(2×)。PCR条件:96 ℃ 5 min;96 ℃30 s,57 ℃ 40 s,35 个循环;72 ℃ 5 min。随机抽查约10%的样本进行两次分型,以保证基因分型的准确性。
1.3 统计学处理 采用SPSS 22.0统计软件。采用Hardy-Weinberg平衡检验评估对照组中实际频数与预期频数之间的偏差[14-15]。H19基因rs2839698多态性与结直肠癌风险的关系采用logistic回归分析,计算OR值及其95%CI。P<0.05为差异有统计学意义。
2 结果
2.1 H19基因rs2839698多态性与结直肠癌患病风险的关系 等位基因A与结直肠癌患病风险降低有关(P<0.05),野生型基因AA、变异型基因AA+GA携带者患结直肠癌的风险明显降低(均P<0.05);调整性别、年龄后,结果显示AA+GA携带者患结直肠癌的风险明显降低(P<0.05),见表1。在不吸烟人群中,相对于GG,AA携带者患结直肠癌的风险明显降低(OR=0.49,95%CI:0.25~0.93,P<0.05);在不饮酒人群中,相对于 GG,GA携带者患结直肠癌的风险明显降低(OR=0.22,95%CI:0.10~0.51,P<0.05);在年龄≥60 岁人群中,相对于GG,AA携带者患结直肠癌的风险明显降低(OR=0.47,95%CI:0.27~0.81,P<0.05);在 BMI≥24 kg/m2人群中,相对于GG,AA携带者患结直肠癌的风险明显降低(OR=0.50,95%CI:0.30~0.84,P<0.05)。
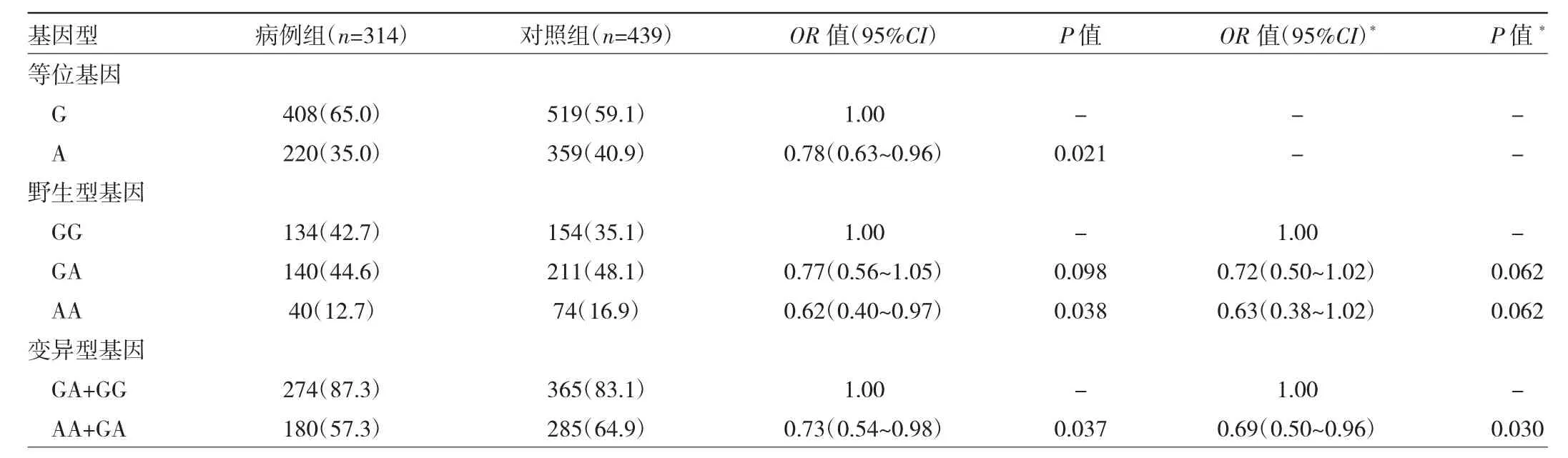
表1 H19基因rs2839698多态性与结直肠癌患病风险的关系[例(%)]
2.2 H19基因rs2839698多态性与结直肠癌临床病理特征的关系 相对于GG,携带GA、AA、GA+AA的结直肠癌患者均不易发生淋巴结转移,肿瘤直径均更小(≤4 cm),差异均有统计学意义(均P<0.05);但组织学分级、TNM分期、家族史、组织学分型、肿瘤位置等临床病理特征与H19基因rs2839698多态性未见关联(均P>0.05),见表 2。
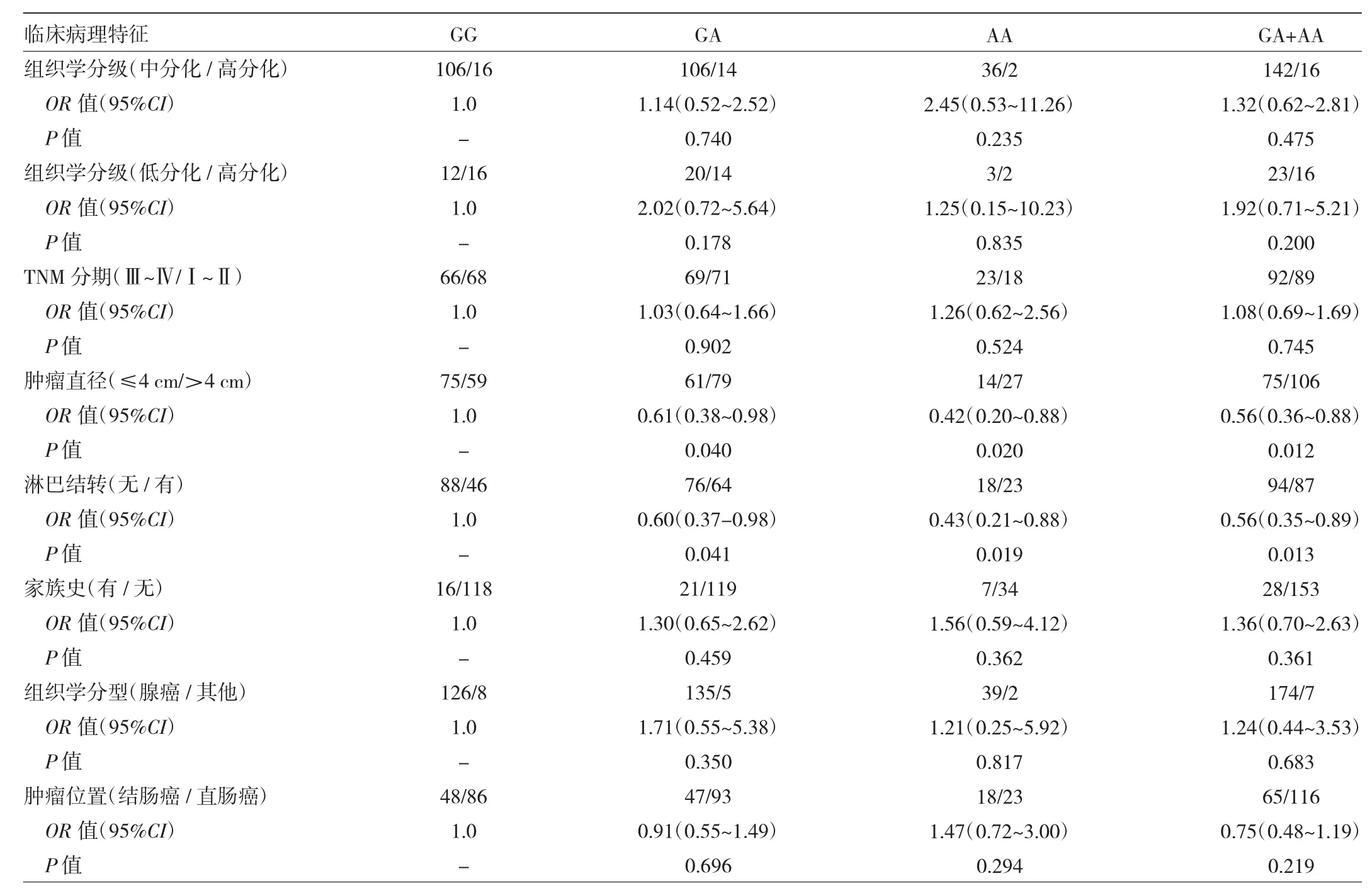
表2 H19基因rs2839698多态性与结直肠癌临床病理特征的关系(例)
3 讨论
lncRNA是人类转录本的主要成分[16],通过干扰某些癌症类型的基因表达来参与生物学过程[17-18]。最近研究表明,lncRNA在癌症发生、发展过程中起关键作用[19-23]。另有研究表明,一些lncRNA参与调节细胞的增殖、凋亡、侵袭、迁移等[20]。Verhaegh 等[24]发现,rs2839698 多态性(携带TC)能降低膀胱癌发病风险,特别是非肌肉浸润性膀胱癌。但另一项针对中国人群(1 049例膀胱癌患者与1 399例对照者)的研究表明,rs2839698多态性与膀胱癌发病风险无关[13]。Gong等[11]研究发现H19基因rs2839698多态性与肺癌易感性之间未见关联,但与肺癌的铂类化疗反应有关。Yang等[10]研究发现,中国汉族人群H19基因rs2839698多态性会增加胃癌患病风险,其中CT、TT与H19 mRNA相对表达量升高有关。Li等[12]观察到rs2839698多态性(携带A)者结直肠癌患病风险增加,该单核苷酸多态性可能改变了关键的折叠结构和H19基因的靶向微小RNA。
本研究结果显示,A、AA、AA+GA与结直肠癌患病风险降低有关;调整性别、年龄后,AA+GA与结直肠癌患病风险仍有统计学差异。分层分析显示,在不吸烟、年龄≥60岁、BMI≥24 kg/m2人群中,相对于GG,AA携带者患结直肠癌的风险均明显降低;在不饮酒人群中,相对于GG,GA携带者患结直肠癌的风险明显降低。这与Li等[12]的研究结果不一致。分析原因,可能有以下4个方面:(1)本研究数据显示H19基因rs2839698多态性与某些暴露因素存在明显的交叉作用;(2)不同地区人群的饮食习惯和生活环境不同;(3)不同研究的基因分型方法及纳入标准不同;(4)不同研究的结直肠癌恶性程度及病理类型不同。此外,本研究发现H19基因rs2839698多态性与结直肠癌患者的淋巴结转移、肿瘤直径明显相关。
综上所述,H19基因rs2839698多态性与结直肠癌患病风险及淋巴结转移、肿瘤直径等临床病理特征有关。携带AA、GA者患病风险降低,特别是不吸烟、不饮酒、年龄≥60 岁、BMI≥24 kg/m2者。

