食管癌免疫浸润特点及其与生存预后的关系
——基于TCGA数据库分析
俞仪萱 杨涛 张静怡 鲁星妤 董慧静 胡紫馨 崔慧娟
食管癌是一种以进行性吞咽困难为主要表现的消化道恶性肿瘤。我国食管癌的死亡率位居恶性肿瘤的第六位[1],5年生存率仅20%[2]。近年来,食管癌免疫治疗技术不断进展[3]。基于KEYNOTE-590的研究结果[4],美国国立综合癌症网络(national comprehensive cancer network,NCCN)恶性肿瘤临床实践指南推荐将帕博利珠单抗(pembrolizumab)作为程序性死亡蛋白配体 1(programmed death protein-ligand 1,PD-L1)高表达或错配修复缺陷、微卫星高度不稳定食管癌患者的二线标准治疗方案。然而,仅有小部分食管癌患者能从免疫治疗中取得良好效果,筛选潜在获益人群的相关生物标志物仍亟待探索。肿瘤免疫浸润特点是指肿瘤微环境中各类浸润性免疫细胞聚集分布的特征。研究证实,免疫浸润特点是影响食管癌免疫治疗临床获益的关键因素[5-6],同时,浸润性免疫细胞可用于评估预后[7]或作为候选的治疗靶点[8]。本研究采集癌症基因组图谱(the cancer genome atlas,TCGA)数据库中食管癌组织的基因转录本与患者的临床特征,采用CIBERSORT算法[9],对食管癌组织中22种浸润性免疫细胞的构成比进行测算,分析它们与预后的相关性,并构建生存预后模型,揭示食管癌的免疫微环境,为免疫治疗相关生物标志物的研究提供参考。
1 材料和方法
1.1 数据获取 食管癌患者食管癌组织的基因转录本及临床特征均从TCGA数据库(https://cancergenome.nih.gov/)获取,包含160例食管癌组织样本和11例正常食管组织样本。患者的临床特征包括性别、生存状态、生存时间、肿瘤分期、TNM分期等,共183例。并在R软件中使用limma包对转录本特征进行校正。同时,从基因表达综合(gene expression omnibus,GEO)数据库(http://www.ncbi.nlm.nih.gov/geo/)下载包含食管癌组织和正常食管组织样本的基因表达谱芯片数据集GSE26886用于验证。
1.2 研究方法 采用CIBERSORT算法计算食管癌组织及正常食管组织基因转录本中浸润性免疫细胞的构成比,使用标准基因表达数据评估样本中22种浸润性免疫细胞的构成比。使用R软件中的survival包、survivalROC包对浸润性免疫细胞的构成比与临床特征进行相关性分析,建立Cox比例风险回归模型。
1.3 统计学处理 采用SPSS 20.0和R 4.0.3统计软件。计量资料组间比较采用独立样本t检验或秩和检验,计数资料组间比较采用χ2检验或秩和检验。采用Kaplan-Meier法绘制生存曲线,采用Cox比例风险回归模型分析浸润性免疫细胞与临床生存情况的关系。P<0.05为差异有统计学意义。
2 结果
2.1 食管癌组织的免疫浸润特点 经CIBERSORT算法测算后,筛选P<0.05的样本,得到食管癌组织样本94例,正常食管组织样本5例。计算样本中22种浸润性免疫细胞的构成比,结果发现,在食管癌组织中占比最高的3种浸润性免疫细胞分别为未活化的CD4+记忆性T细胞(20.28%)、M0巨噬细胞(16.64%)和M2巨噬细胞(11.50%)。
相关性热图反映了食管癌组织中浸润性免疫细胞之间的关联,见图1(插页),结果显示,活化的CD4+记忆性T细胞与CD8+T细胞呈正相关(r=0.49,P<0.05),滤泡辅助性T细胞(T cells follicular helper,Tfh)与未活化的 CD4+记忆性 T 细胞呈负相关(r=-0.47,P<0.05)。
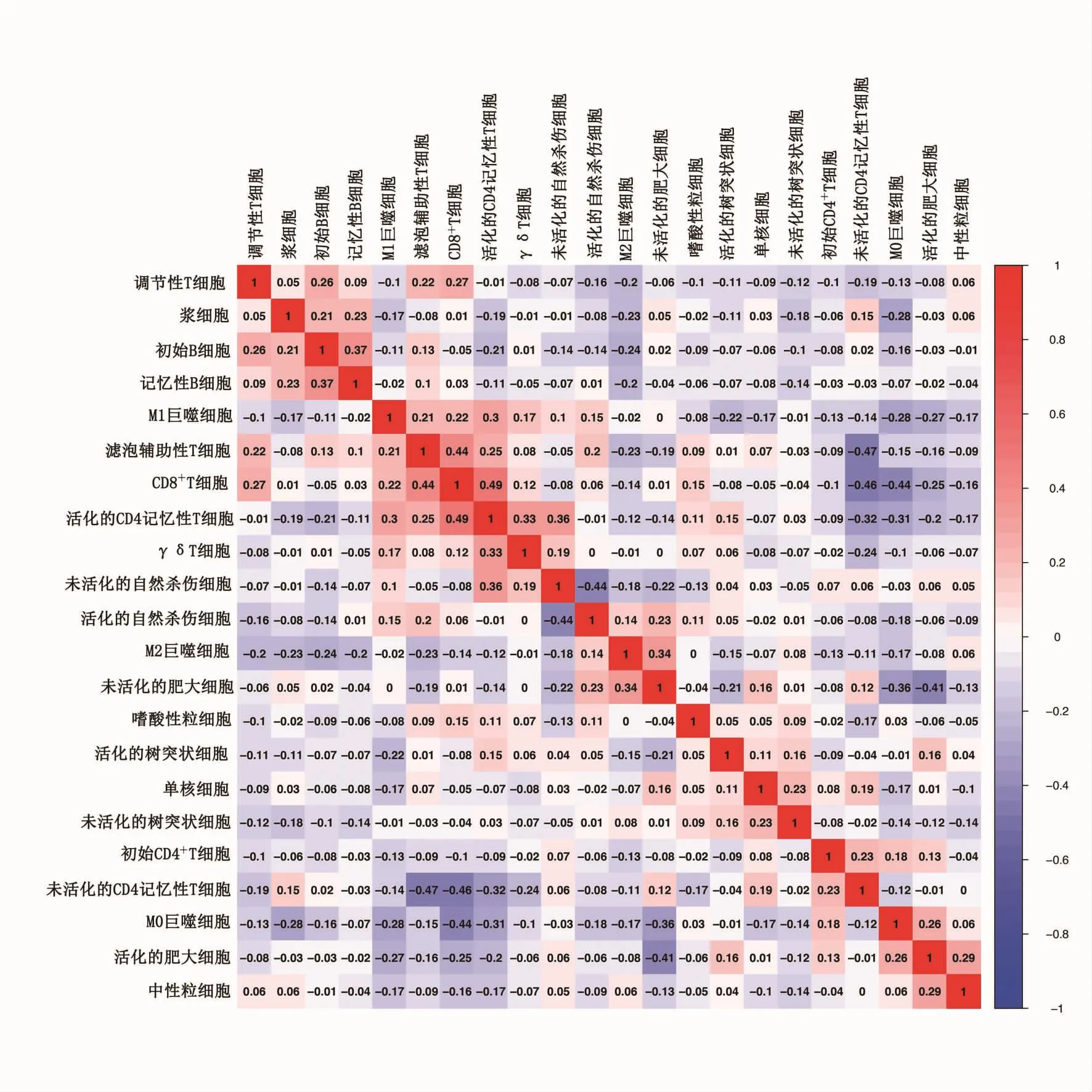
图1 食管癌组织免疫细胞相关性热图
2.2 食管癌组织与正常食管组织免疫浸润特点比较比较食管癌组织与正常食管组织中浸润性免疫细胞构成比的差异,并使用GSE26886的数据集进行验证。结果表明,树突状细胞(dendritic cells,DCs)(P<0.05)、未活化的肥大细胞(P<0.05)和M0巨噬细胞(P<0.05)的构成比在两组样本间存在差异。其中,未活化的肥大细胞在食管癌组织中的构成比低于正常食管组织,M0巨噬细胞在食管癌组织中的构成比高于正常食管组织。
2.3 食管癌组织样本临床基本特征 从TCGA数据库下载183例食管癌组织样本的临床基本特征,对其进行统计,见表1。其中临床特征未知者,统计该项时予以剔除。
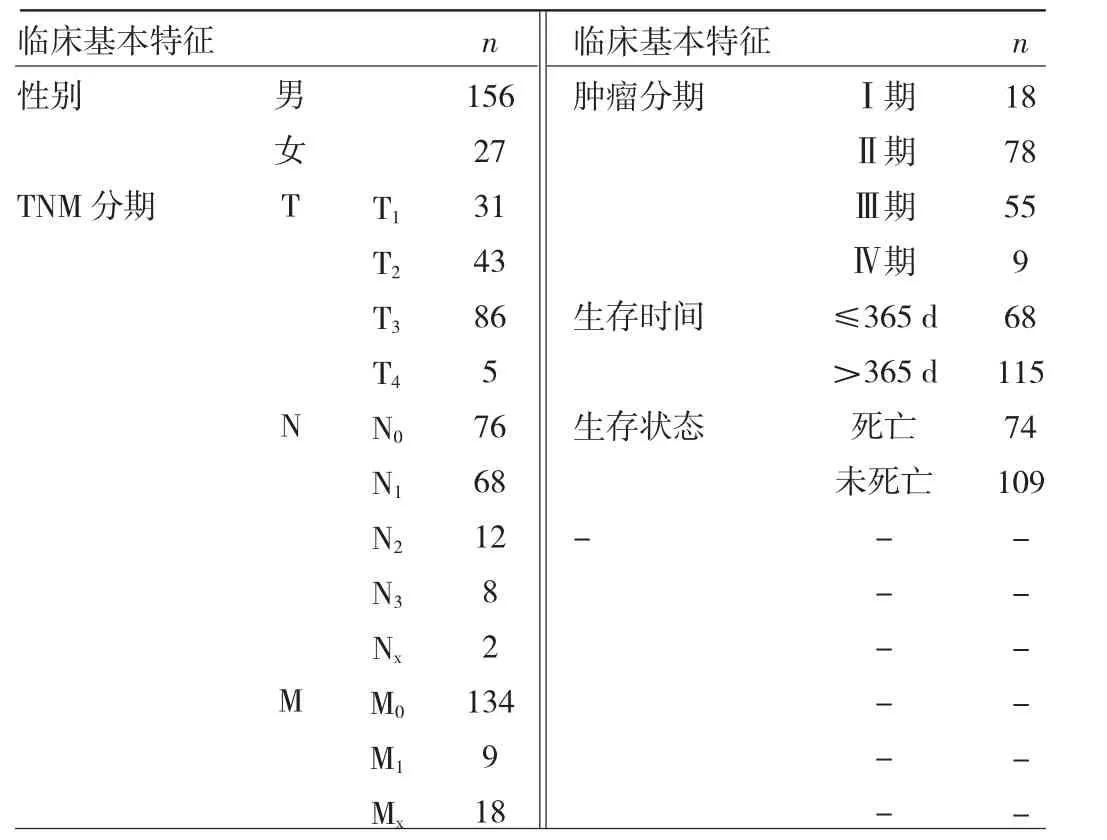
表1 食管癌组织样本临床基本特征
2.4 食管癌组织浸润性免疫细胞构成比与临床特征的关系 分析食管癌组织浸润性免疫细胞构成比与临床基本特征(包括性别、肿瘤分期、TNM分期等)的关系。结果显示,男性食管癌患者具有更高构成比的未活化的肥大细胞(P<0.05),高构成比的活化的DCs与食管癌较低的T分期有关(P<0.05),见图2。
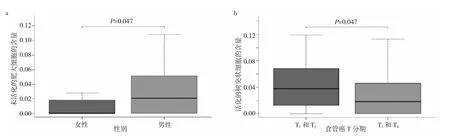
图2 两种浸润性免疫细胞构成比与临床特征的关系
2.5 浸润性免疫细胞构成比与生存预后的关系 以每种浸润性免疫细胞在所有食管癌组织样本中的中位值为界,将样本划分为低构成比组(Low)与高构成比组(High),通过Kaplan-Meier法分析发现,高构成比未活化的DCs可能预示着较短的生存时间(P<0.05),见图3。

图3 未活化的树突状细胞(DCs)低构成比组与高构成比组患者生存曲线比较
2.6 食管癌浸润性免疫细胞相关生存预后模型的建立将样本中浸润性免疫细胞的构成比纳入Cox比例风险回归模型,结果表明,高表达的Tfh(P<0.05)与未活化的DCs(P<0.05)细胞提示较差的生存预后,见图4a。结合Kaplan-Meier法分析结果及相关研究[10],将两者纳入生存预后模型的构建,得到食管癌患者5年生存期预后的公式:5年生存率=0.4047×Tfh的比例+0.3181×未活化的DCs的比例。
在此基础上,根据风险评分的中位数,将患者分为低免疫风险评分组和高免疫风险评分组。生存曲线提示,低免疫风险评分组相比高免疫风险评分组的预后更好,差异有统计学意义(P<0.05)。ROC曲线反映该模型可以较好预测患者的5年生存率(AUC=0.732),见图4b。

图4 食管癌免疫浸润Cox风险比例回归模型的评价(a:高、低免疫风险评分组的生存曲线;b:生存预后模型评价的ROC曲线)
3 讨论
食管癌免疫微环境与肿瘤的发生、发展、预后关系密切[11],同时,免疫浸润特点会影响患者对免疫检查点抑制剂(immune checkpoint inhibitors,ICIs)的反应[12]。以往通过免疫组化、流式细胞学等方式测定肿瘤组织中浸润性免疫细胞的构成比具有一定的难度,很难展现食管癌组织的免疫全景。同时,传统的免疫标志物如肿瘤突变负荷(tumor mutation burden,TMB)、PD-L1 等[13]尚不能精准地预测免疫治疗的疗效。研究者们致力于探索更简便的方式筛选食管癌免疫疗法获益的潜在人群。
本研究发现,在食管癌组织的浸润性免疫细胞中,肿瘤相关巨噬细胞(tumor associated macrophage,TAM)[14]的构成比较正常食管组织高,未活化的肥大细胞的构成比较正常食管组织低,笔者认为它们可能与食管癌的发生、发展有关;而Tfh和DCs则与食管癌患者生存预后有关。
TAM包括未活化的M0巨噬细胞、促炎症的M1巨噬细胞及免疫抑制性M2巨噬细胞[15],它们与炎症反应及肿瘤抑制有关,在肿瘤组织附近聚集,塑造着肿瘤免疫微环境。以往的研究与本研究均证实了食管癌组织中TAM构成比较正常食管组织更高[16],但并非所有亚型都表达出了明显的差异,比如M2巨噬细胞。TAM亚型的表达构成比可能与食管癌患者预后有关[17],但本研究的结果并没有充分表达这一特点。目前,针对TAM的疗法[18]及评估PD-1/PD-L1表达和TAM构成比联系的研究[19]正在进行,而TAM亚型或可成为治疗的新靶标。
未活化的肥大细胞在正常食管组织、食管癌组织中构成比不同,不同性别中也存在差异。既往的研究无法明确高构成比的肥大细胞对于机体免疫能力的调节作用[20-21],Derakhshani等[22]的研究发现,肥大细胞所发挥的作用取决于肿瘤类型等多种因素。本研究对肥大细胞的分析较为局限,然而,随着性别对于免疫疗法尤其是免疫检查点抑制剂的影响逐渐受到关注与肯定[23-24],未来或可加深对浸润性免疫细胞亚型与性别联系的研究。
本研究以Tfh、未活化的DCs为指标构建出了食管癌生存预后的模型,结果表明高构成比的未活化DCs和Tfh提示着较差的生存预后。DCs与食管癌的免疫浸润特点关系密切,研究中它显示出了与T分期、生存预后等的联系。高表达的活化的DCs与食管癌较低的T分期相关,与既往的研究结果相符[25-26]。但同时说明,DCs可能只影响原位癌的分期,与淋巴结、远处转移关系不强。然而,研究中高构成比的未活化的DCs又与较差的生存预后相关,似乎与“较低的T分期”这一结果相左。这种可能是DCs的活化状态不同所导致的:食管癌微环境中含有大量肿瘤抗原,更多的成熟DCs提供了更强的抗原提呈力,则T分期低。未活化的DCs抗原提呈力弱,伴随着较低的免疫效能,故预后差。这提示不同活化状态的DCs可能是独立在食管癌发生、发展、临床预后中发挥作用的。但是,Nishimura等[27]应用免疫组化法测定食管鳞癌组织的DCs,认为更精确的生存模型需建立在对DCs表型LAMP-3的测定之上,只有表达出LAMP-3的成熟DCs,才直接主导了食管癌患者的免疫反应。这或可为近年来基于DCs的疫苗开发提供支持[28]。
Tfh的构成比在本研究中也显示出与较差的预后相关。Tfh可以帮助B细胞建立生发中心,间接调节体液免疫,在食管癌及其他实体瘤的肿瘤微环境中起到调控作用[29]。已有的研究指出,Tfh的构成比与乳腺癌[30]、肺癌[31]等的生存预后有关。Tfh细胞上高表达PD-1,高构成比的Tfh可能是由于PD-1/PD-L1信号通路被阻断而产生的[32],这不仅使肿瘤免疫整体趋向体液免疫,同时也不利于机体发挥免疫作用。
综上所述,本研究呈现了食管癌免疫浸润的特点,揭示了22种浸润性免疫细胞与食管癌临床特征、预后的关系,为食管癌发生发展机制的探索、免疫治疗效果预测的生物标志物和治疗靶点的选择提供了参考。但本研究仍存在一定的局限:(1)TCGA数据库中包含的正常食管组织样本较少,尽管本研究使用了GEO数据集进行了验证,但未来仍需纳入更多的外部数据提高结果的可靠性;(2)某些临床数据缺乏年龄、分级、无进展生存期等特征,且各组间食管癌样本数量分布不均,导致本研究无法全面评估免疫浸润特点与临床特征的关系;(3)缺乏亚洲来源的样本,由于种族间的免疫差异,研究对于我国食管癌患者的适用性仍需进一步验证。

