基于LIGHT/HVEM 通路研究白藜芦醇对子痫前期大鼠肾损伤的保护作用研究
符海内汪洪林张林静张 蕾符大天
(1.海南省妇幼保健院(海南省妇女儿童医学中心)妇产科,海口 570206;2.海南省妇幼保健院(海南省妇女儿童医学中心)药剂科,海口 570206;3.海南医学院第一附属医院药剂科,海口 570102)
子痫前期(preeclampsia,PE)是指妊娠期间特有的严重并发症,以血压升高、蛋白尿及肾损伤等为最主要病理表现的疾病[1-2]。 PE 发病率较高,是导致孕产妇和围生儿患病及死亡的主要原因之一,可累及全身多器官系统,肾是其损伤的主要靶器官之一[3-4]。 PE 机制复杂,是临床研究的热点之一。近来研究发现, 淋巴毒素类似物(lymphotoxin analog,LIGHT)/疱疹病毒介入体(herpes virus entry mediator,HVEM)不仅可调节线粒体功能,参与胰岛细胞、肿瘤细胞及神经细胞的损伤[5-6],还可通过调节免疫炎症反应,参与肾损伤过程[7-8]。 但LIGHT/HVEM 是否参与调控PE 肾损伤过程,还未见报道。白藜芦醇(Resveratrol,RSV)是从葡萄、藜芦、虎杖等植物中提取的一种芪类结构的非黄酮类多酚化合物,具有抗肿瘤、抗心血管疾病、抗炎免疫和雌激素样活性等药理作用,对冠心病、阿尔茨海默病、糖尿病肾病等多种疾病具有明显的改善作用[9-10]。 但RSV 对PE 肾损伤的保护作用未见报道。 本研究建立大鼠PE 肾损伤模型,通过阻断LIGHT/HVEM 通路表达,探讨RSV 对PE 肾损伤的保护机制,为临床合理用药提供参考。
1 材料和方法
1.1 实验动物
清洁级同遗传背景SD 大鼠,雄性30 只,雌性60 只,8 周龄,体重200~220 g,购自广东省医学实验动物中心[SCXK(粤)2019-0002],所有大鼠于海南省妇女儿童医学中心实验室中进行常规饲养[SYXK(琼)2019-0012],大鼠在室温,50%相对湿度的环境下自由饮食进水。 本实验经医院伦理委员会批准(IACUC-01(20190916)),实验严格遵循3R 原则。
1.2 主要试剂与仪器
白藜芦醇(原料药,高效液相色谱(HPLC)纯度99%,批号:D0051,购自上海宝曼生物科技有限公司);亚硝基左旋精氨酸甲酯(L-nitro arginine methyl ester,L-NAME) 试剂(HPLC 纯度≥98%,批号:MB3015,购自美仑生物科技有限公司);淋巴毒素β受体(lymphotoxin β receptor,LTβR-Ig)融合蛋白(批号:YBA481Hu01,购自上海钰博生物科技有限公司);苏木精-伊红(HE)染色液(批号:G1120,购自北京索莱宝科技有限公司);血清肌酐(serum creatinine,Scr)、 酶 联 免 疫 吸 附 (enzyme linked immunosorbent assay,ELISA) 试剂盒(批号:LM-12785-ES,购自上海联迈生物工程有限公司);血尿素氮(blood urea nitrogen,BUN)、ELISA 试剂盒(批号:LM-13351-ES,购自上海联迈生物工程有限公司);尿蛋白ELISA 试剂盒(批号:JS15437,购自青岛捷世康生物科技有限公司);TRIzol 试剂盒、逆转录试剂盒、实时荧光定量PCR 试剂盒、蛋白提取试剂盒(批号分别为:R0024FT、D7176M、C0298S、SF1009,均购自碧云天生物技术研究所);LIGHT 抗体、HVEM 抗体、核转录因子-κB(NF-κB)抗体、白细胞介素-6(IL-6)、β-actin 抗体、HRP 羊抗鼠二抗(批号 分 别 为: ab134930、 ab185711、 ab209795、ab233706、ab101123、ab13055,均购自美国 Abcam 公司);智能无创血压计(型号:BP-2010A,购自北京软隆生物技术有限公司);光学显微镜(型号:SMZ745,购自日本尼康公司);实时荧光定量PCR 仪(型号:SLAN-96P,购自上海宏石医疗科技有限公司);凝胶成像仪(型号:GIS-500,购自杭州米欧仪器有限公司)等。
1.3 实验方法
1.3.1 大鼠PE 模型建立及分组给药
取大鼠雄性 30 只,雌性 60 只,按 2 ∶1合笼过夜,所有雌性大鼠于次日早晨发现有阴道栓者视为受孕成功,并将其定为妊娠第1 天,取受孕大鼠50只,随机分为正常孕鼠组(Normal 组)、子痫前期模型组(PE 组)、白藜芦醇(RSV)低(50mg/kg)、高(200 mg/kg)剂量组、LIGHT/HVEM 通路阻断剂(淋巴毒素 β 受体,LTβR-Ig 融合蛋白,1600 μg/kg,LTβR-Ig 组),每组 10 只;除 Normal 组外,其余大鼠均参照文献[11]方法建立PE 模型:雌性大鼠在妊娠第10 天,按300 mg/kg 的剂量腹腔注射L-NAME 溶液5 d,每天1 次,建立PE 模型,并通过测血压、24 h尿蛋白和透射电镜法观察肾结构确认子痫前期大鼠造模成功。 造模成功后开始给药,RSV 低、高剂量组参照文献[12]设置剂量,并用生理盐水配成5 mg/mL、20 mg/mL 的溶液,按 10 mL/kg 剂量灌胃给药;LTβR-Ig 组参照文献[13]设置剂量,并用生理盐水配成 16 μg/μL 溶液,按 100 μL/kg 剂量经尾静脉注射给药;Normal 组和PE 组灌胃+尾静脉注射给予等量生理盐水;各组连续给药5 d,每天1 次。
1.3.2 大鼠血压及妊娠情况观察
末次给药12 h 后,观察妊娠情况,有无流产现象。 将大鼠置于系统固定容器内,于封闭安静环境中,接好智能无创血压计电源并打开主机,设定温度至39℃,将感应器固定于大鼠尾根部(松紧适度),待大鼠安静后,用尾套充气系统自动加压放气,并于血压仪显示屏上,观察血压波形变化并记录,每只大鼠测量时间为30 min。
1.3.3 标本采集
末次给药24 h 后,收集尿液置于-80℃冰箱保存。 麻醉大鼠,取腹主动脉血 3 mL,4℃静置 30 min,3000 r/min 离心10 min,取上清液置于-80℃冰箱保存。 处死大鼠,取左肾组织,剪取部分组织,置于-80℃保存;其余组织迅速置于4%多聚甲醛溶液中固定24 h,经脱水、透明、浸蜡包埋后切成4 μm切片,备用。
1.3.4 肾组织HE 染色
取1.3.3 项下石蜡切片,按HE 试剂盒说明书方法染色后,在显微镜下观察肾组织变化。
1.3.5 各组大鼠肾功能指标血清肌酐(Scr)、血尿素氮(BUN)及尿液中24 h 尿蛋白量
取血清和尿液标本,按ELISA 试剂盒说明方法检测Scr、BUN 及尿蛋白含量,具体操作按说明书方法进行。
1.3.6 实时荧光定量聚合酶链式反应(qRT-PCR)检测各组大鼠肾组织LIGHT mRNA、HVEM mRNA相对表达水平
取-80℃保存的左肾组织,4℃解冻,机械匀浆分离后取上清液,TRIzol 法抽提总RNA,以总RNA为模板逆转录合成cDNA,PCR 试剂盒进行扩增,94℃ 1 min,94℃ 20 s,60℃ 20 s,72℃ 25 s,共进行36 个循环,严格按试剂盒说明建立反应体系,引物由生工生物工程(上海)股份有限公司合成,引物设计见表 1。 以 β-actin 为内参基因,采用 2-ΔΔCt算法计算LIGHT mRNA、HVEM mRNA 相对表达量。

表1 qRT-PCR 引物序列Table 1 qRT-PCR primer sequences
1.3.7 蛋白免疫印迹(Western blot)法检测肾组织LIGHT、HVEM、NF-κB、IL-6 蛋白相对表达水平
取-80℃保存的肾组织,4℃解冻后,机械匀浆分离取上清液,提取蛋白,BCA 法测蛋白总浓度后,取50 μg 蛋白行电泳和转膜反应,滴加5%脱脂牛奶37℃ 封闭 1 h,滴加[LIGHT(1 ∶1000)、HVEM(1 ∶1000)、NF-κB(1 ∶1000)、IL-6(1 ∶1000)、β-actin(内参)(1 ∶2000)]一抗 4℃孵育过夜,滴加二抗(1 ∶2000),37℃孵育1 h,增强化学发光法显色,凝胶成像仪观察拍照,以Image J 软件分析计算蛋白相对表达水平。
1.4 统计学方法
以SPSS 22.0 软件对实验数据进行统计分析,计量资料以平均数±标准差()表示,多组间比较进行单因素方差分析,进一步两组间比较行SNK-q检验,P<0.05 表示差异有统计学意义。
2 结果
2.1 各组大鼠血压及妊娠情况观察结果
与Normal 组相比,PE 组大鼠血压稍有升高,但升高不明显,且受孕20 d 时,有3 只大鼠流产;与PE 组相比,RSV 低、高剂量组、LTβR-Ig 组大鼠血压变化均不明显,且无流产现象。
2.2 各组大鼠肾功能指标血清Scr、BUN 及尿液中24 h 尿蛋白量检测结果
与 Normal 组相比,PE 组大鼠血清 Scr、BUN 及尿液中24 h 尿蛋白量升高(P<0.05);与PE 组相比,RSV 低、高剂量组、LTβR-Ig 组大鼠血清 Scr、BUN 及尿液中24 h 尿蛋白量降低(P<0.05),且RSV 高剂量组大鼠血清Scr、BUN 及尿液中24 h 尿蛋白量均低于RSV 低剂量组;LTβR-Ig 组与RSV 高剂量组上述指标比较差异不显著(P>0.05)。 见表2。
表2 各组大鼠血清Scr、BUN 及尿液中24 h尿蛋白量比较( ,n=10)Table 2 Comparison of serum Scr, BUN and 24 h urine protein in rats of each group

表2 各组大鼠血清Scr、BUN 及尿液中24 h尿蛋白量比较( ,n=10)Table 2 Comparison of serum Scr, BUN and 24 h urine protein in rats of each group
注:与 Normal 组相比,aP<0.05;与 PE 组相比,bP<0.05;与 RSV 低剂量组相比,cP<0.05。Note. Compared with Normal group,aP < 0.05. Compared with PE group,bP < 0.05. Compared with RSV low dose group,cP < 0.05.
组别Groups Scr(μmol/L)BUN(μmol/L)尿液中24 h尿蛋(mg)24 h urinary protein in urine Normal 组Normal group 3.09±0.11 10.86±1.29 16.03±2.01 PE 组PE group 5.98±0.14a 39.61±2.12a 120.21±3.24a RSV 低剂量组RSV low dose group 4.89±0.13ab 30.32±1.82ab 99.16±3.03ab RSV 高剂量组RSV high dose group 4.41±0.12abc 26.67±1.36abc 63.19±2.52abc LTβR-Ig 组LTβR-Ig group 4.46±0.11abc 27.78±1.39abc 64.14±2.28abc
2.3 各组大鼠肾组织HE 染色结果
Normal 组大鼠肾组织形态正常。 与 Normal组相比,PE 组大鼠肾组织可见肾小球内皮细胞弥漫性增生、肿胀、空泡样变性,基底膜增厚及炎性浸润等病理损伤。 与PE 组相比,RSV 低、高剂量组、LTβR-Ig 组大鼠上述病理损伤程度逐渐减轻。 见图 1。

图1 各组大鼠肾组织HE 染色图Note. A, Normal group. B,PE group. C,RSV low dose group. D,RSV high dose group. E, LTβR-Ig group.The same as below.Figure 1 HE staining of renal tissue in each group
2.4 各组大鼠肾组织 LIGHT mRNA、HVEM mRNA 相对水平检测结果
与 Normal 组相比,PE 组大鼠肾组织 LIGHT mRNA、HVEM mRNA 相对水平升高(P<0.05);与PE 组相比,RSV 低、高剂量组、LTβR-Ig 组大鼠肾组织LIGHT mRNA、HVEM mRNA 相对水平降低(P<0.05),且RSV 高剂量组大鼠肾组织LIGHT mRNA、HVEM mRNA 相对水平均低于 RSV 低剂量组;LTβR-Ig 组与RSV 高剂量组,上述指标比较差异不显著(P>0.05)。 见图 2。

图2 各组大鼠肾组织LIGHT mRNA、HVEM mRNA相对水平比较( x- ±s,n=10)Note. Compared with Normal group,aP < 0.05. Compared with PE group,bP < 0.05. Compared with RSV low dose group,cP < 0.05.The same as below.Figure 2 Comparison of the relative levels of LIGHT mRNA and HVEM mRNA in kidney tissue of rats in each group
2.5 各组大鼠肾组织 LIGHT、HVEM、NF-κB、IL-6 蛋白表达结果
与 Normal 组相比,PE 组大鼠肾组织 LIGHT、HVEM、NF-κB、IL-6 蛋白表达升高(P<0.05);与 PE组相比,RSV 低、高剂量组、LTβR-Ig 组大鼠肾组织LIGHT、HVEM、NF-κB、IL-6 蛋白降低(P<0.05),且RSV 高剂量组大鼠肾组织 LIGHT、HVEM、NF-κB、IL-6 蛋白均低于 RSV 低剂量组,LTβR-Ig 组与 RSV高剂量组上述指标比较差异不显著(P>0.05)。 见图 3、图 4。
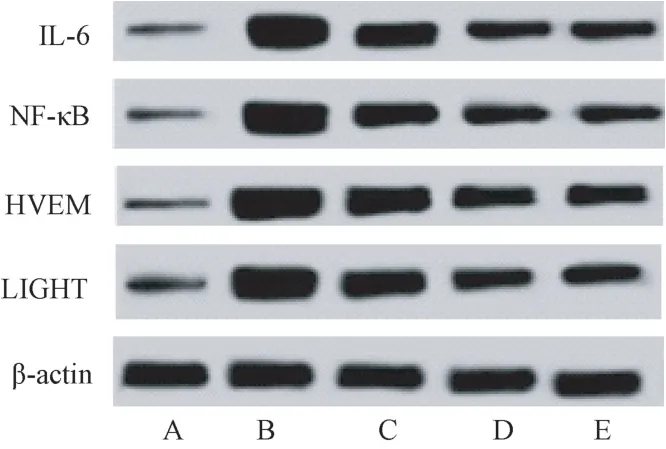
图3 各组大鼠肾组织LIGHT、HVEM、NF-κB、IL-6 蛋白表达免疫印迹图Figure 3 Western blot of LIGHT, HVEM, NF-κB and IL-6 protein expression in renal tissue of rats in each group

图4 各组大鼠肾组织LIGHT、HVEM、NF-κB、IL-6 蛋白相对水平比较( ,n=10)Figure 4 Comparison of relative levels of LIGHT, HVEM,NF-κB and IL-6 protein in kidney tissues of rats in each group
3 讨论
PE 肾损伤发生较早且较为严重,其病理生理变化为肾小球扩张、血管痉挛、肾血流量减少、肾小球滤过率下降,而出现蛋白尿,继续恶化并累及肾小管,造成肾功能异常,从而引起母体内多种血清学指标改变[4]。 PE 机制复杂,动物模型是研究PE 发病机理与开发诊治手段的主要工具,在大鼠饮水中加入L-NAME,虽不能使大鼠血压升高,但可使大鼠在孕晚期出现蛋白尿和肾小球滤过率降低等PE 肾损伤现象[14]。 本研究通过腔注射L-NAME 后发现,与Normal 组相比,PE 组大鼠尿液中24 h 尿蛋白量、肾功能指标血清Scr、BUN 含量升高,肾组织出现肾小球内皮细胞弥慢性增生、肿胀、空泡样变性,基底膜增厚,且有局灶节段性肾小球硬化及膜增生性肾小球肾炎病变。 提示PE 组孕鼠出现蛋白尿、肾功能损伤及肾病理变化,表明造模成功。
RSV 是我国传统中药虎杖中的主要活性成分,现代药理学研究发现,白藜芦醇可抑制肾炎症反应等多种药理作用,从而在肾病防治研究中倍受关注[10]。 He 等[15]研究发现,RSV 可通过调节单磷酸腺苷活化蛋白激酶(AMPK)/还原型烟酰胺腺嘌呤二核苷酸磷酸氧化酶(NOX)/活性氧簇(ROS)通路降低氧化应激反应,减少肾纤维化;Shao 等[16]发现RSV 可通过沉默信息调控因子1(Sirt1)/缺氧诱导因子-1α(HIF-1α)信号途径降低肾小球系膜细胞炎症反应,减少肾损害。 然而RSV 对PE 过程中肾损伤的作用,却未见报道。 本研究发现,与PE 组相比,RSV 低、高剂量组大鼠肾组织病理损伤明显改善,尿液中24 h 尿蛋白量、肾功能指标血清 Scr、BUN 含量均减低,且RSV 高剂量组上述指标变化均优于RSV 低剂量组,表明RSV 肾损伤也具有改善作用,但具体分子机制还不甚明确,本研究对此进行继续探究。
LIGHT 是 T 细胞活化共刺激分子,HVEM 是LIGHT 的配体之一,LIGHT 与 HVEM 结合后,可活化NF-κB 核转录因子或通过激活N 端激酶(JNK)/转录因子激活蛋白-1(AP-1)途径诱导基因转录,并调控细胞生存、细胞因子表达及细胞增殖等生理活动[17-18]。近来研 究发现,LIGHT / HVEM 通路参与PE 病理过程及肾损伤过程,Wang 等[19]发现在PE 怀孕小鼠模型中LIGHT 显著升高,向怀孕小鼠中注入重组LIGHT 会诱发小鼠PE 高血压和蛋白尿形成,而抑制 LIGHT、HVEM 及 LTβR 表达可阻止PE 所致高血压、蛋白尿、胎盘血管生成受损和内皮功能损伤等;Wang 等[20]在人类和小鼠试验研究中发现,LIGHT 信号传导激活可导致胎盘凋亡,血管活性因子分泌增加以及子痫前期母体蛋白尿升高;Wang 等[8]发现HVEM/LIGHT 通路参与肾移植排斥反应过程。 本研究发现,与Normal 组相比,PE 组大鼠肾组织中HVEM mRNA 及蛋白、LIGHT mRNA及蛋白均升高,NF-κB 及 IL-6 蛋白也明显升高;与PE 组相比,RSV 低、高剂量组大鼠肾组织 HVEM mRNA 及蛋白、LIGHT mRNA 及蛋白、NF-κB 及 IL-6蛋白均依次降低,提示LIGHT/HVEM 通路可能参与PE 肾损伤过程,而 RSV 可抑制 LIGHT/HVEM 通路激活,减少炎症因子释放。 另外本研究用LTβR-Ig阻断LIGHT/HVEM 通路,结果发现,与PE 组相比,LTβR-Ig 组大鼠肾组织 HVEM mRNA 及蛋白、LIGHT mRNA 及蛋白、NF-κB 及 IL-6 蛋白亦明显降低,且大鼠尿液中24 h 尿蛋白量、血清 Scr、BUN 含量均减低,肾组织损伤明显减轻,表明抑制HVEM/LIGHT 通路可缓解PE 肾损伤。 RSV 高剂量组各项指标与LTβR-Ig 组无明显差异,推测 RSV 改善PE肾损伤的作用可能与抑制LIGHT/HVEM 通路有关。
综上所述,RSV 可抑制PE 大鼠肾组织LIGHT/HVEM 通路,减轻PE 所致肾损伤,可能为阐明RSV改善 PE 肾损伤作用提供一定参考,但 LIGHT/HVEM 通路靶点较多,RSV 通过抑制LIGHT/HVEM通路激活改善PE 肾损伤机制也较为复杂,这需要后续继续研究。

