红景天苷对小鼠高氧肺损伤的保护作用及对Notch信号通路的调节机制研究
朱文亮黄晓佩邱 实冯凌霄邵换璋
(河南省人民医院重症医学部,郑州 450000)
1 材料和方法
1.1 实验动物
C57BL/6 小鼠 50 只,SPF 级,雌雄各半,6~8 周龄,体重18~22 g,由河南省实验动物中心提供[SCXK(豫)2017-0001],实验于河南省实验动物中心实验室独立动物房[SYXK(豫)2016-0002]进行。研 究 方 案 获 本 院 伦 理 委 员 会 批 准(HNSRMYY2019002),实验严格遵循实验动物使用的3R 原则给予人道关怀。
1.2 主要试剂与仪器
地塞米松磷酸钠注射液(天津天药药业股份有限公司,批号:170123);红景天苷(纯度≥98%,南京泽朗生物科技有限公司,批号20181108);Notch1、HERP、Hes1 兔源单克隆抗体、羊抗兔二抗(美国CST 公司,批号:3608、26730、11988、7074);实验所需耗材均购自北京索莱宝科技有限公司。 倒置显微镜(日本 OLYMPUS 公司);血气分析仪(美国Instrumentation Laboratory Company);氧气浓度分析仪(北京世联博研科技有限公司);二氧化碳监测仪(北京中创汇安科贸有限公司);PCR 仪(美国Applied Biosystems 公司); 凝胶成像仪(美国Syngene 公司)。
1.3 实验方法
1.3.1 分组与造模
将50 只C57BL/6 小鼠随机分为5 组,每组10只。 模型组、阳性对照组、红景天苷高、低剂量组小鼠均建立高氧肺损伤模型。 造模方法:将小鼠置于自制密闭氧气舱内,氧舱连接输氧管、氧气浓度分析仪和二氧化碳监测仪,箱内放置钠石灰用以吸收小鼠呼出的CO2,保持箱内CO2浓度低于0.5%,调节氧气流量,使氧舱内氧浓度高于95%,模型组、阳性对照组、红景天苷高剂量组和低剂量组小鼠均持续暴露于氧气舱内3 d,正常对照组小鼠暴露于室内空气中[8]。
1.3.2 给药方法
造模第2 天开始给药。 根据文献[9]及预实验结果确定各组小鼠给药剂量,红景天苷高剂量组和低剂量组小鼠分别采用50 mg/kg、25 mg/kg 的红景天苷溶液(临用前用蒸馏水配置)灌胃,阳性对照组采用10 mg/kg 地塞米松注射液灌胃。 正常对照组和模型组小鼠灌胃等量生理盐水。 各组小鼠均每天给药1 次,连续7 d。
1.3.3 肺湿干重比(W/D)和血氧分压(PaO2)
张连长安慰道:“不要急嘛,我也很内疚啊!实际情况是,连里是派了爬犁来接我们的,但接连下了几天雨,路被水淹了,爬犁只能在半道迎我们了。我们呢,再走过塔头甸,就能与连队的爬犁会合了。”
处死小鼠,分离其右上肺叶,记录湿重(W),随后放入80℃恒温干燥箱烘干,24 h 后称重,记为干重(D),湿重与干重之比即为W/D。 收集各组小鼠外周动脉血,采用血气分析仪检测小鼠血氧分压(PaO2)。
1.3.4 HE 染色
肺组织4%多聚甲醛固定,制作石蜡组织切片,常规脱蜡复水,行HE 染色观察小鼠肺组织病理变化。
1.3.5 ELISA 检测
取小鼠肺组织,剪碎后置于组织研磨器中,加入预冷PBS 缓冲液于冰盒上研磨成匀浆,10 000 r/min 离心10 min,吸取上清即为待测样品,严格按照试剂盒说明书检测 TNF-α、IL-1β、IL-6、MDA 含量和SOD 活性。
1.3.6 SOD 活性和MDA 含量测定
取小鼠肺组织,剪碎后置于组织研磨器中,加入预冷PBS 缓冲液于冰盒上研磨成匀浆,10 000 r/min 离心10 min,吸取上清即为待测样品,-80℃保存。 ①SOD 活性检测:取待测样品20 μL,依次加入SOD 检测缓冲液、WST-8 工作液和反应启动工作液,37℃孵育30 min,450 nm 波长测吸光度(A)值,根据标准曲线计算待测样品的SOD 酶活力(U/mg)。 ②MDA 含量检测:取待测样品 100 μL,加入工作液、蒸馏水和待测样品,置100℃水浴中孵育60 min,冷却后10 000 r/min 离心10 min,取上清液,测定各组样品 450 nm、532 nm 和 600 nm 处 A 值,计算ΔA450=A450测定-A450空白,ΔA532=A532测定-A532空白,ΔA600=A600测定-A600空白,MDA 含量(nmol/mg)= 5×[12.9×(ΔA532-ΔA600)-2.58×ΔA450]。
1.3.7 Western blot
取小鼠肺组织,BCA 法确定样品的蛋白浓度,按照每孔30 μg 的上样量进行SDS-PAGE 凝胶电泳分离蛋白,电转至PVDF 膜,将PVDF 膜放入各一抗稀释液(1 ∶1 000)中 4℃孵育过夜,TBST 清洗后放入二抗(1 ∶2 000)中37℃孵育2 h,洗膜,加发光液,置凝胶成像系统进行曝光,计算目的蛋白灰度值,并计算蛋白的相对表达量(蛋白相对表达量=目的蛋白灰度值/ GAPDH 蛋白灰度值)。
1.3.8 qRT-PCR
提取各组小鼠肺组织总RNA,逆转录成cDNA,按照说明书进行PCR 扩增。 PCR 引物序列见表1。
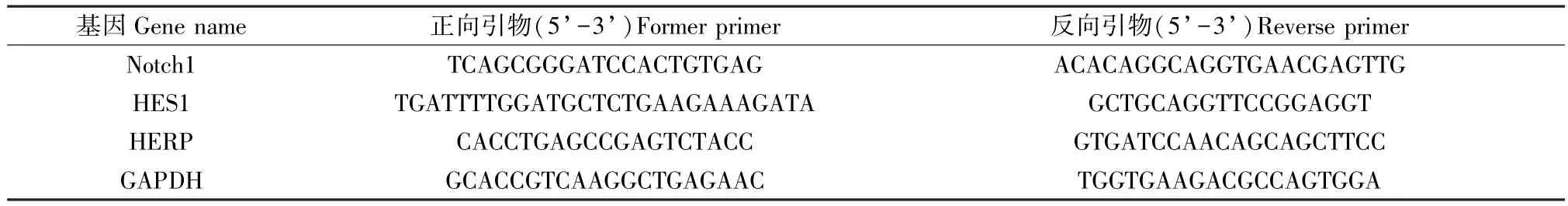
表1 基因引物序列Table 1 Primer sequences of genes
1.4 统计学方法
应用SPSS 25.0 统计软件分析数据,实验重复3次,计量资料以平均数±标准差()表示,多样本比较采用单因素方差分析,两样本比较采用SNK-q检验。P<0.05 为差异有统计学意义。
2 结果
2.1 红景天苷对肺组织W/D 值和PaO2 水平的影响
模型组、阳性对照组、红景天苷高剂量组和低剂量组小鼠肺组织W/D 值显著高于正常对照组,PaO2水平显著低于正常对照组;阳性对照组、红景天苷高、低剂量组小鼠肺组织W/D 值显著低于模型组,PaO2水平显著高于模型组(P<0.05);与阳性对照组比较,红景天苷高剂量组小鼠肺组织W/D值和PaO2水平差异无统计学意义(P>0.05),红景天苷低剂量组小鼠肺组织W/D 值升高,PaO2水平降低(P<0.05)。 见表 2。
表2 各组小鼠肺组织W/D 值和PaO2 水平的比较(,n=10)Table 2 Comparison of W/D value and PaO2 level of lung tissues of mice in each group
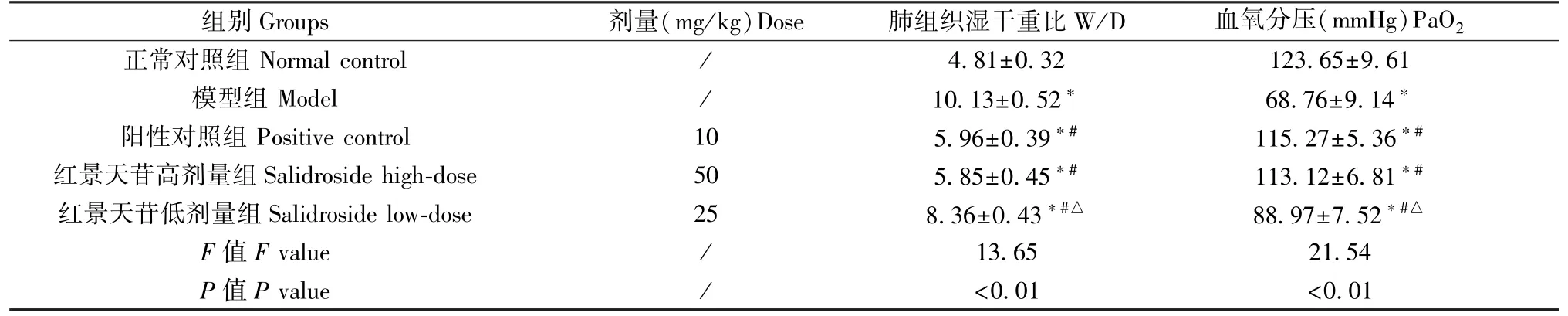
表2 各组小鼠肺组织W/D 值和PaO2 水平的比较(,n=10)Table 2 Comparison of W/D value and PaO2 level of lung tissues of mice in each group
注:与正常对照组比较,*P<0.05;与模型组比较,#P<0.05;与阳性对照组比较,△P<0.05。 下同。Note. Compared with the normal control group,*P<0.05. Compared with the model group,#P<0.05. Compared with the positive control group,△P<0.05. The same as below.
组别Groups 剂量(mg/kg)Dose 肺组织湿干重比W/D 血氧分压(mmHg)PaO2正常对照组 Normal control / 4.81±0.32 123.65±9.61模型组 Model / 10.13±0.52* 68.76±9.14*阳性对照组 Positive control 10 5.96±0.39*# 115.27±5.36*#红景天苷高剂量组Salidroside high-dose 50 5.85±0.45*# 113.12±6.81*#红景天苷低剂量组 Salidroside low-dose 25 8.36±0.43*#△ 88.97±7.52*#△F 值F value / 13.65 21.54 P 值P value / <0.01 <0.01
2.2 红景天苷对小鼠肺组织病理学形态的影响
正常对照组小鼠肺组织结构正常。 模型组小鼠肺组织结构紊乱,肺泡壁明显增厚,失去正常形态,并存在明显炎症浸润现象,肺间质可见胶原蛋白沉淀;与模型组比较,阳性对照组、红景天苷高剂量组小鼠肺组织病变得到显著改善,炎症细胞浸润和胶原蛋白沉积的现象相对较少,红景天苷低剂量组小鼠肺泡结构基本完整,但肺泡壁增厚明显,肺组织间仍存在大量的炎症细胞。 见图1。

图1 各组小鼠肺组织病理学形态比较Note. A, Normal control group. B, Model group. C, Positive control group. D, Salidroside high-dose group. E, Salidroside low-dose group.Figure 1 Comparison of histopathological morphology of the lungs of mice in each group
2.3 红景天苷对肺组织 TNF-α、IL-1β、IL-6 含量的影响
模型组、阳性对照组、红景天苷高、低剂量组小鼠肺组织中 TNF-α、IL-1β、IL-6 含量均高于正常对照组(P<0.05);阳性对照组、红景天苷高、低剂量组TNF-α、IL-1β、IL-6 含量均显著低于模型组(P<0.05);与阳性对照组比较,红景天苷高剂量组TNF-α、IL-1β、IL-6 含量差异无统计学意义(P>0.05),红景天苷低剂量组 TNF-α、IL-1β、IL-6 的含量有所增加(P<0.05)。 见表 3。
表3 各组小鼠肺组织中炎症因子TNF-α、IL-1β、IL-6 含量比较(,n=3)Table 3 Comparison of the levels of inflammatory factors TNF-α, IL-1β and IL-6 in the lung tissues of mice in each group
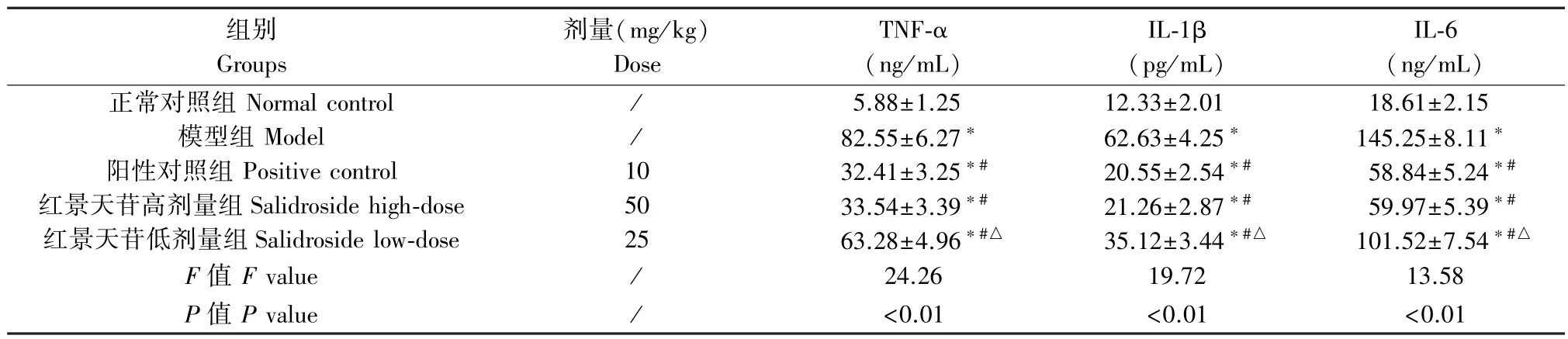
表3 各组小鼠肺组织中炎症因子TNF-α、IL-1β、IL-6 含量比较(,n=3)Table 3 Comparison of the levels of inflammatory factors TNF-α, IL-1β and IL-6 in the lung tissues of mice in each group
组别Groups剂量(mg/kg)Dose TNF-α(ng/mL)IL-1β(pg/mL)IL-6(ng/mL)正常对照组 Normal control / 5.88±1.25 12.33±2.01 18.61±2.15模型组 Model / 82.55±6.27* 62.63±4.25* 145.25±8.11*阳性对照组 Positive control 10 32.41±3.25*# 20.55±2.54*# 58.84±5.24*#红景天苷高剂量组Salidroside high-dose 50 33.54±3.39*# 21.26±2.87*# 59.97±5.39*#红景天苷低剂量组Salidroside low-dose 25 63.28±4.96*#△ 35.12±3.44*#△ 101.52±7.54*#△F 值F value / 24.26 19.72 13.58 P 值P value / <0.01 <0.01 <0.01
2.4 红景天苷对肺组织SOD 活性和MDA 含量的影响
模型组、阳性对照组、红景天苷高、低剂量组小鼠肺组织中SOD 活性均低于正常对照组,MDA 含量均高于正常对照组(P<0.05);阳性对照组、红景天苷高、低剂量组SOD 活性显著高于模型组,MDA含量显著低于模型组(P<0.05);红景天苷高剂量组小鼠肺组织SOD 活性和MDA 含量与阳性对照组比较无显著差异(P>0.05);与阳性对照组比较,红景天苷低剂量组小鼠肺组织SOD 活性降低,MDA 含量增加(P<0.05)。 见表 4。
表4 各组小鼠肺组织SOD 活性和MDA 含量比较(,n=3)Table 4 Comparison of SOD activity and MDA content in lung tissues of mice in each group
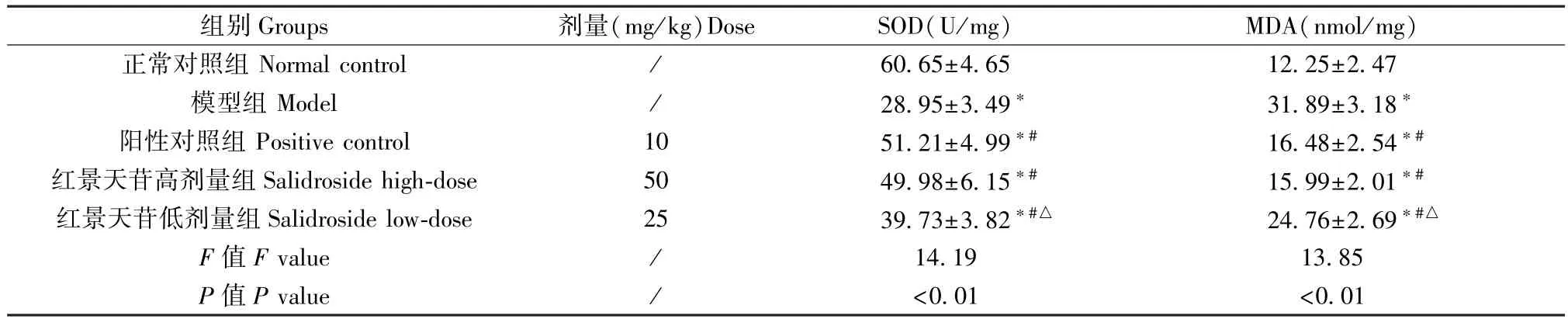
表4 各组小鼠肺组织SOD 活性和MDA 含量比较(,n=3)Table 4 Comparison of SOD activity and MDA content in lung tissues of mice in each group
组别Groups 剂量(mg/kg)Dose SOD(U/mg) MDA(nmol/mg)正常对照组 Normal control / 60.65±4.65 12.25±2.47模型组 Model / 28.95±3.49* 31.89±3.18*阳性对照组 Positive control 10 51.21±4.99*# 16.48±2.54*#红景天苷高剂量组Salidroside high-dose 50 49.98±6.15*# 15.99±2.01*#红景天苷低剂量组 Salidroside low-dose 25 39.73±3.82*#△ 24.76±2.69*#△F 值F value / 14.19 13.85 P 值P value / <0.01 <0.01
2.5 红景天苷对肺组织 Notch1、HERP、HES1 蛋白表达的影响
模型组、阳性对照组、红景天苷高、低剂量组小鼠肺组织Notch1、HERP、HES1 蛋白表达均低于正常对照组(P<0.05);阳性对照组、红景天苷高剂量组和低剂量组小鼠肺组织Notch1、HERP、HES1 蛋白表达均高于模型组(P<0.05);与阳性对照组比较,红景天苷高剂量组Notch1、HERP、HES1 蛋白表达差异无统计学意义(P>0.05),红景天苷低剂量组Notch1、HERP、HES1 蛋白表达降低,差异均有统计学意义(P<0.05)。 见图2,表 5。
表5 各组小鼠肺组织中Notch 信号通路蛋白相对表达水平比较(,n=3)Table 5 Comparison of relative expression levels of Notch signaling pathway proteins in lung tissues of mice in each group
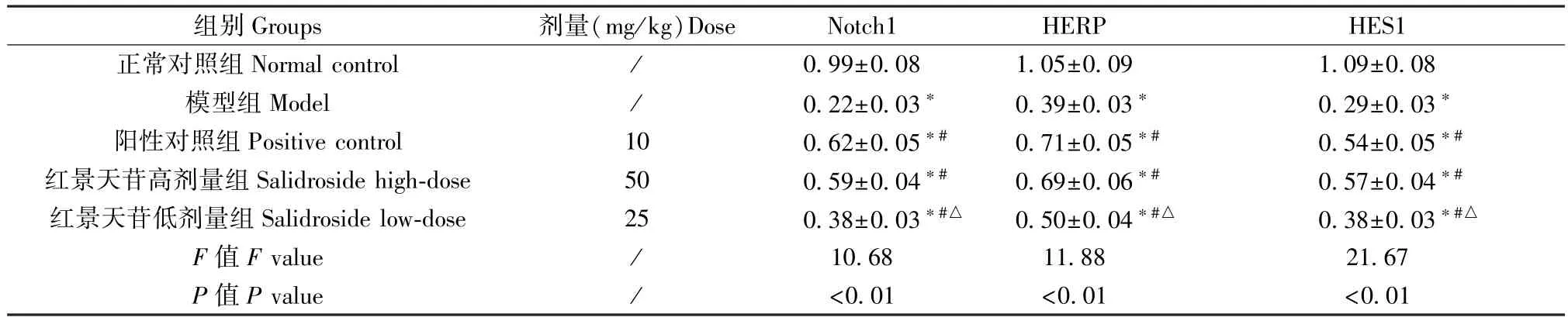
表5 各组小鼠肺组织中Notch 信号通路蛋白相对表达水平比较(,n=3)Table 5 Comparison of relative expression levels of Notch signaling pathway proteins in lung tissues of mice in each group
组别Groups 剂量(mg/kg)Dose Notch1 HERP HES1正常对照组 Normal control / 0.99±0.08 1.05±0.09 1.09±0.08模型组 Model / 0.22±0.03* 0.39±0.03* 0.29±0.03*阳性对照组 Positive control 10 0.62±0.05*# 0.71±0.05*# 0.54±0.05*#红景天苷高剂量组Salidroside high-dose 50 0.59±0.04*# 0.69±0.06*# 0.57±0.04*#红景天苷低剂量组Salidroside low-dose 25 0.38±0.03*#△ 0.50±0.04*#△ 0.38±0.03*#△F 值F value / 10.68 11.88 21.67 P 值P value / <0.01 <0.01 <0.01
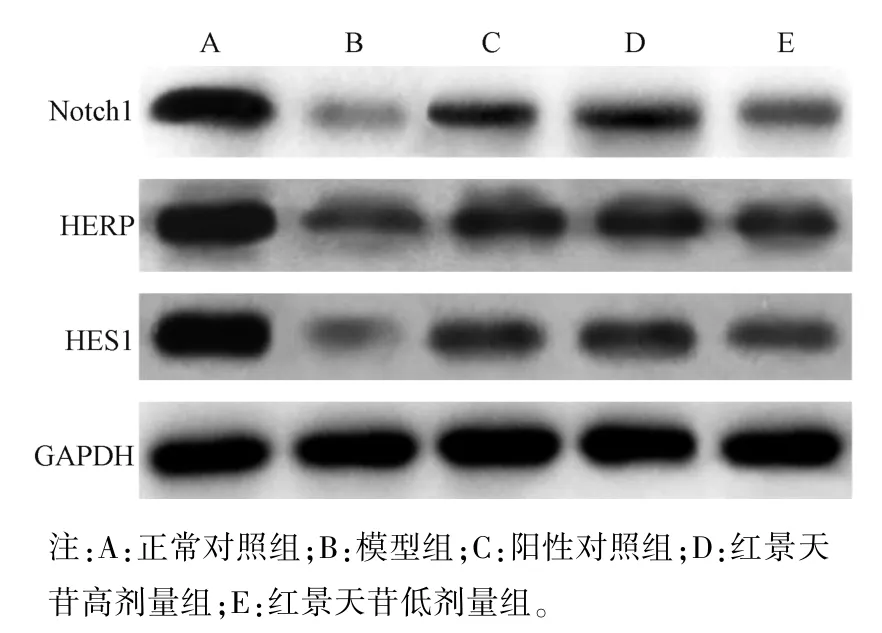
图2 Western blot 法检测各组小鼠肺组织中Notch 信号通路相关蛋白表达情况Note. A, Normal control group. B, Model group. C,Positive control group. D, Salidroside high-dose group. E,Salidroside low-dose group.Figure 2 Western blot method to detect the expressions of Notch signaling pathway related proteins in the lung tissues of each group of mice
2.6 红景天苷对肺组织 Notch1、HERP、HES1 mRNA 表达水平的影响
模型组、阳性对照组、红景天苷高、低剂量组小鼠肺组织 Notch1、HERP、HES1 mRNA 表达均低于正常对照组(P<0.05);阳性对照组、红景天苷高剂量组和低剂量组小鼠肺组织Notch1、HERP、HES1 mRNA 表达均高于模型组(P<0.05);与阳性对照组比较,红景天苷高剂量组 Notch1、HERP、HES1 mRNA 表达差异无统计学意义(P>0.05),红景天苷低剂量组 Notch1、HERP、HES1 mRNA 表达降低,差异均有统计学意义(P<0.05)。 见表6。
表6 各组小鼠肺组织中Notch1、HERP、HES1 mRNA 表达水平比较(,n=3)Table 6 Comparison of Notch1, HERP and HES1 mRNA expression levels in lung tissues of mice in each group
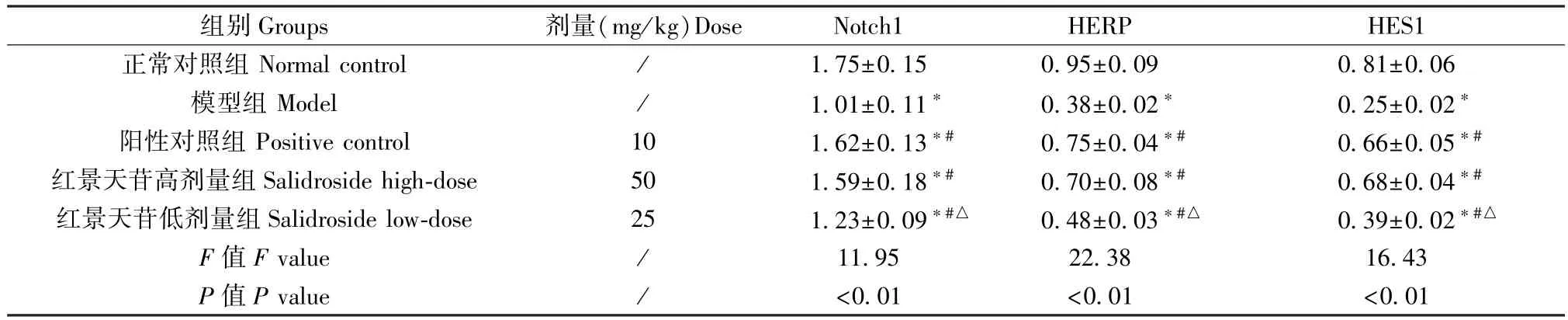
表6 各组小鼠肺组织中Notch1、HERP、HES1 mRNA 表达水平比较(,n=3)Table 6 Comparison of Notch1, HERP and HES1 mRNA expression levels in lung tissues of mice in each group
组别Groups 剂量(mg/kg)Dose Notch1 HERP HES1正常对照组 Normal control / 1.75±0.15 0.95±0.09 0.81±0.06模型组 Model / 1.01±0.11* 0.38±0.02* 0.25±0.02*阳性对照组 Positive control 10 1.62±0.13*# 0.75±0.04*# 0.66±0.05*#红景天苷高剂量组Salidroside high-dose 50 1.59±0.18*# 0.70±0.08*# 0.68±0.04*#红景天苷低剂量组Salidroside low-dose 25 1.23±0.09*#△ 0.48±0.03*#△ 0.39±0.02*#△F 值F value / 11.95 22.38 16.43 P 值P value / <0.01 <0.01 <0.01
3 讨论
在临床治疗中,氧疗是必不可少的急救措施,但长时间暴露在高浓度氧环境下可引起氧中毒,使肺组织产生并释放大量炎性细胞介质,同时使机体呈现氧化应激状态,肺泡毛细血管通透性增加,最终发展为不可逆损伤[10]。 Notch 信号通路是一种高度保守的传导途径,在肺稳态、肺损伤和修复过程中起关键作用,尤其与慢性阻塞性肺疾病(COPD)、哮喘、肺纤维化、肺动脉高压(PAH)、肺癌等多种肺部疾病的发病机制密切相关[11]。 Bai 等[5]研究发现,增强Notch1 和HERP 表达可抑制高氧诱导的Ⅱ型肺泡上皮细胞凋亡和氧化应激损伤,抑制活性氧的产生。 研究证明,红景天苷具有抗衰老、抗炎、抗氧化、抗癌和保肝特性,同时具有高效低毒的特点[12]。 Lan 等[13]研究发现,红景天苷通过上调SIRT1 抑制NF-κB/HMGB1 途径预防并减轻败血症诱导的小鼠急性肺损伤,改善肺水肿和脂质过氧化,降低死亡率。 然而,红景天苷对高氧诱导的小鼠肺损伤是否具有保护和治疗作用尚不清楚,仍需进一步探讨。
肺损伤是临床急性呼吸衰竭的重要因素,目前比较公认的病因是肺内炎症因子释放增加,损伤肺泡上皮细胞和血管内皮细胞,触发氧化应激反应,导致肺功能受损、低氧合、高生理死腔,进而发展为呼吸衰竭[14]。 Lu 等[15]研究证明,红景天苷可降低脂多糖诱导的小鼠急性肺损伤模型W/D 值,改善肺组织病理学改变,显著抑制 TNF-α、IL-1β 和 IL-6等炎症因子的产生。 本研究发现,红景天苷可显著降低小鼠肺组织W/D,升高PaO2水平,降低肺组织炎症因子 TNF-α、IL-1β、IL-6 的含量,同时显著改善小鼠肺组织病理学改变,其中红景天苷高剂量组和阳性对照组小鼠肺组织肺泡结构基本正常,仅有少量炎症细胞浸润,几乎无胶原蛋白沉淀。 在肺损伤中,炎症反应和氧化应激反应是其基本病理过程[16]。 陈少忠等[17]研究发现,红景天苷注射液能够增加脓毒性休克肺损伤大鼠抗氧化酶的活性,减少脂过氧化产物的生成,提高机体抗氧化应激的能力。 本研究显示,红景天苷可提高肺组织 SOD 活性,降低MDA 含量,且高剂量红景天苷的作用与阳性药物的作用比较无显著差异,表明高剂量红景天苷对小鼠高氧肺损伤具有保护作用,可显著抑制氧化应激反应。
肺损伤的发病机制复杂,有研究证明,Notch 信号通路在肺损伤的发生发展进程中具有重要的调控作用[18]。 马建齐等[19]研究发现,姜黄素通过抑制Notch2 和HES1 的表达减轻脓毒症大鼠急性肺损伤的炎症反应。 但邓健[20]研究发现,高氧暴露可使 Notch1、HERP、HES1 表达下调,肺组织出现相应的病理损伤,促进Notch 信号通路的表达则可发挥药物对高氧肺损伤的保护作用。 本研究结果显示,红景天苷可增加高氧诱导型小鼠肺损伤模型Notch信号通路 Notch1、HERP、HES1 蛋白和 mRNA 表达水平,与阳性对照组比较,红景天苷高剂量组Notch1、HERP、HES1 的表达水平差异无统计学意义,表明红景天苷可能通过调控高氧肺损伤模型Notch 信号通路的表达达到肺损伤的保护作用。 另外,已有毒理学研究证明,红景天苷在动物实验中未出现遗传毒性,副作用低,安全性良好,对呼吸系统具有显著保护作用,是临床治疗急性肺损伤的潜在单体药物,具有广阔的应用前景[21]。
综上所述,红景天苷能够减轻高氧诱导的小鼠肺损伤,其机制可能与Notch 信号通路表达变化有关。

