环磷酰胺腹腔注射诱导建立大鼠间质性膀胱炎模型的优化
陈 彪董熙远
(华中科技大学同济医学院附属同济医院妇产科,武汉 430030)
间质性膀胱炎/膀胱疼痛综合征(interstitial cystitis/Bladder Pain Syndrome, IC/BPS)是一种病因尚不明确的可导致病人严重精神衰弱的临床综合征, 主要表现为膀胱功能紊乱及下腹疼痛,严重影响患者生活质量[1-2]。 虽有多种理论假说试图解释IC/BPS 的发病原因,然而其机制仍不明确,基于动物模型的科学研究成为探索IC/BPS 等泌尿系统疾病发病机制及治疗方法的重要途径[3]。
目前,环磷酰胺(cyclophosphamide, CYP)腹腔注射诱导建立的大鼠间质性膀胱炎模型是IC/BPS的科学研究中使用最多的实验动物模型之一[4]。在前期工作中,我们发现文献报道中多种剂量的环磷酰胺被用于腹腔注射建立大鼠IC/BPS 模型开展IC/BPS 研究,如毛厚平等[5]用 75 mg/kg CYP 腹腔注射建立大鼠IC/BPS 模型探索透明质酸治疗IC/BPS 的机制,而 Smaldone 等[6]采用 150 mg CYP 腹腔注射建立大鼠IC/BPS 模型探索IC/BPS 的尿液生物标志物。 此外,不同剂量的环磷酰胺可不同程度的改变膀胱感觉和功能,即使相同剂量的环磷酰胺在不同的研究中对膀胱功能的影响也并不一致[7]。 Juszczak 等[8]用 200 mg CYP 单次腹腔注射建立模型发现CYP 引起显著的膀胱炎性改变并增加排尿期膀胱最大收缩力;而 Büyüknacar 等[9]采用150 mg CYP 腹腔注射却发现大鼠排尿期膀胱收缩幅度并未改变。 可靠和一致的动物模型是开展病理生理研究和整合不同研究成果的前提,因此,开展系统性的研究以明确环磷酰胺用量及评估其建模效率显得非常重要和迫切。
临床上,膀胱疼痛和功能紊乱是IC/BPS 患者的主要症状,部分患者伴有明显的躯体痛觉过敏。近年来越来越多的证据支持炎症在IC/BPS 病理生理过程中发挥核心作用,多种炎症因子被证实在IC/BPS 患者膀胱组织中表达增高[10-11]。 前期研究发现150 mg/kg CYP 腹腔注射建立的IC/BPS 模型大鼠尿液和膀胱组织中的 IL-1β 表达显著升高[12-13]。 本课题基于环磷酰胺单次腹腔注射的方法,将Sprague-Dawley (SD)大鼠随机分组后腹腔注射不同剂量的环磷酰胺,比较各组大鼠膀胱功能、疼痛感知和膀胱组织炎症状态及IL-1β 表达情况,探索环磷酰胺剂量和建模效率的最佳契合点,以期建立规范的环磷酰胺腹腔注射建立大鼠IC/BPS 模型的方法。
1 材料和方法
1.1 实验动物
健康清洁级雌性成年SD 大鼠70 只,每只体重200~220 g,购自湖北省实验动物中心[SCXK(鄂)2017-0012]。 大鼠在华中科技大学实验动物中心适应性饲养一周后进行实验[SYXK(鄂)2016-0057]。 本课题得到华中科技大学同济医学院附属同济医院实验动物伦理委员会批准(20170828037),符合3R 原则。
1.2 主要试剂与仪器
环磷酰胺(纯度 98.9%, PHR1404,Sigma-Aldrich );乌拉坦(纯度 99.8%, U2500,Sigma-Aldrich);Von-Frey 纤毛(Aesthesio, Danmic);电子天平(Mettler Toledo); 生理记录仪(PowerLab 26T,AD Instruments);逆转录试剂盒(Thermo Fisher);荧光定量试剂盒(DBI Bioscience);荧光定量PCR 仪(LightCycler®96, Roche)。
1.3 实验方法
1.3.1 建模方法
将环磷酰胺溶于生理盐水配置成质量分数30 mg/mL 溶液,大鼠采用随机数字表法随机分成七组,每组10 只。 对照组大鼠腹腔注射1 mL/100 g体重生理盐水,其余六组按50 mg/kg、100 mg/kg、150 mg/kg、200 mg/kg、250 mg/kg 或 300 mg/kg 分别取上述环磷酰胺溶液用生理盐水稀释并按1 mL/100 g 体重腹腔注射建立模型。
1.3.2 自发性内脏疼痛评分
环磷酰胺腹腔注射48 h 后,将大鼠置于安静环境中,避免一切不必要的噪音,同时在进行评分前给予足够的时间适应实验室环境。 参照文献[14],将大鼠单独放入透明观察笼内,疼痛行为的观察及打分按下述标准执行:毛色光亮,活动正常=0 分;皮毛缺乏光泽伴毛发竖立=1 分,呼吸急促费力伴活动减少=2 分;精神萎靡伴眼上睑下垂=3 分;蹲坐不动且舔抚腹壁=4 分;跛行或弓背蜷缩=5 分。 上述行为持续1 min以上即进行记录,连续观察2 h,累积相加得出疼痛评分。 由两位研究者独立评分,再进行比较分析。
1.3.3 Von-Frey 躯体疼痛测定
参考文献方法[15],将大鼠单独放置于透明树脂包围的不锈钢网底鼠笼内,使用校正过的不同粗细的 Von-Frey 纤毛(1 g,1.4 g,2 g,4 g,6 g,8 g,10 g,15 g,26 g)按up-down 法垂直刺激大鼠足底和下腹盆部正中膀胱体表区域。 大鼠出现以下行为则认定为盆部区域刺激阳性反应:腹部急剧回缩、跳跃或者刺激后立即舔触、搔抓盆部皮肤;急剧缩腿或用舌头舔足则认定为足底刺激阳性。 每个区域重复3 次,取最低值作为机械痛阈。
1.3.4 尿动力学测定
乌拉坦(质量分数20%,1 g/kg 体重)腹腔麻醉成功后,大鼠取仰卧位,消毒外阴后经尿道置入PE50 管。 打开生理记录仪仪并取实验台平面置零。将测压导管、微量输液泵及尿动力仪与三通相连。按压排空膀胱后,生理盐水以10 mL/h 的速度灌注膀胱,生理记录仪描计膀胱充盈过程中膀胱内压力变化, 标记开始灌注和出现排尿的时间。 排尿开始即停止灌注,排尿后轻压下腹部排空膀胱 , 排出的尿液作为膀胱残余尿量 。 每只大鼠至少测定3 个排尿周期。 最大膀胱容量=灌注时间×灌注速率;排尿容积则根据公式1 g = 1 mL 换算获得;最大膀胱压、膀胱基础压、阈值膀胱压、非排尿性膀胱收缩均从生理记录仪记录的动态压力记录数据中分析获取。
1.3.5 膀胱大体标本观察
大鼠结束尿动力学测定后打开腹腔,切取膀胱。 棉签轻拭吸取残存尿液后,使用电子天平秤量新鲜膀胱组织重量和游标卡尺测量膀胱顶部中心厚度后记录数据。 同时,体视显微镜下观察并采用1999 年Assreuy 等[16]提出的标准评估膀胱水肿和出血严重程度来评价膀胱炎症程度。 每例标本分两份,1 份质量分数为4%的多聚甲醛溶液固定,用于组织切片HE 染色,另一份置于液氮中保存用于分子生物学实验。
1.3.6 膀胱组织学评估
膀胱组织常规石蜡包埋切片,HE 染色,光镜下观察膀胱壁粘膜层和肌层的水肿、渗出、出血及炎性细胞增多等炎症表现。
1.3.7 IL-1β mRNA 的 PCR 检测
自液氮罐中取出组织,冰上解冻后采用TRIzol法抽提总RNA,进行 RNA 纯度分析后,取3 μg 总RNA 根据试剂盒说明书逆转录合成第一链cDNA。根据试剂盒说明书操作,运用SYBGreen 染料作为指示剂,以 β-actin 作为内参(引物序列 5’ -CGTTGACATCCGTAAAGACCTC/TAGGAGCCAGGG CAGTAATCT-3’),利用 IL-1β 特异性引物(引物序列 5’ -CCTCGTGCTGTCTGACCCAT/ GACAAACCGC TTTTCCATCTTC-3’)实时定量扩增目标DNA,采用2-△△Ct法比较分析各组大鼠膀胱组织内 IL-1β 的表达水平。
1.4 统计学方法
2 结果
2.1 一般观察及自发性内脏和躯体痛觉评估
CYP 注射后,200 mg/kg、250 mg/kg 组和 300 mg/kg 组分别有 1 只、4 只和 5 只大鼠在 48 h 内死亡。 如图 1 所示,50 mg 和 100 mg CYP 腹腔注射并不引起大鼠自发性内脏疼痛,躯体痛觉阈值测试同样发现50 mg 和100 mg 组与对照组无明显统计学差异。 150 mg、200 mg、250 mg 和 300 mg CYP 腹腔注射均显著(P< 0.05)增加大鼠的自发性内脏疼觉(图1A) 和降低躯体疼痛阈值 (图1B) 。
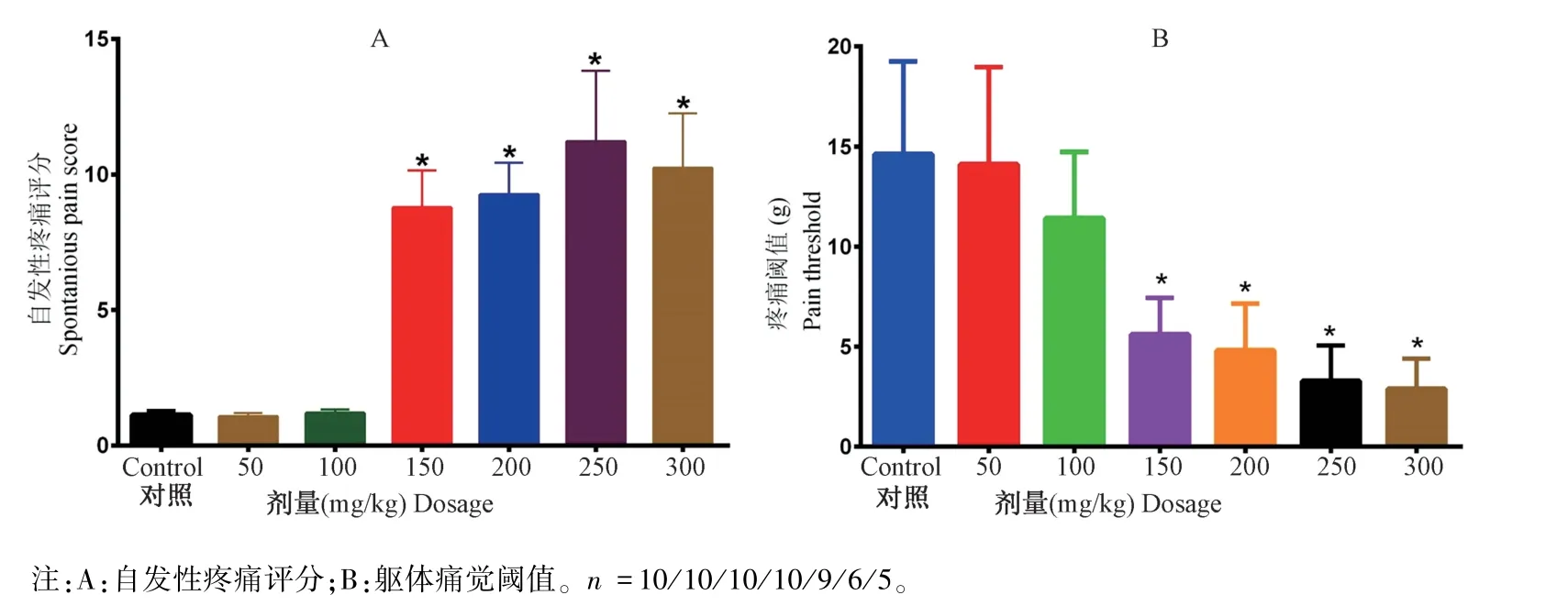
图1 不同剂量CYP 腹腔注射对大鼠疼痛感觉的影响Note. A, Spontaneous visceral pain. B, Somatic nociception. n =10/10/10/10/9/6/5.Figure 1 Impact of cyclophosphamide on rat sensitivity to pain sensation
2.2 各剂量组大鼠尿动力学测定结果
如表1 所示,环磷酰胺腹腔注射后48 h 行尿动力学测定发现,与对照组相比较,50 mg 组大鼠膀胱功能未见明显改变;100 mg 组大鼠残余尿量明显增多(P< 0.05),最大膀胱容积和最大膀胱压未见明显改变;150 mg 和200 mg 组大鼠最大膀胱容量较对照组明显减少(P< 0.05),而残余尿量明显增多(P< 0.05),同时最大膀胱压未见明显改变;250 mg和300 mg 组大鼠的最大膀胱容量明显减少(P<0.05),残余尿量明显增多(P< 0.05),而最大膀胱压明显下降(P< 0.05)。 综上说明,50 mg CYP 腹腔注射不影响膀胱功能,100 mg、150 mg 和200 mg CYP 腹腔注射引起膀胱功能紊乱,但不影响膀胱收缩力,而250 mg 和300 mg CYP 腹腔注射明显破坏膀胱收缩力。
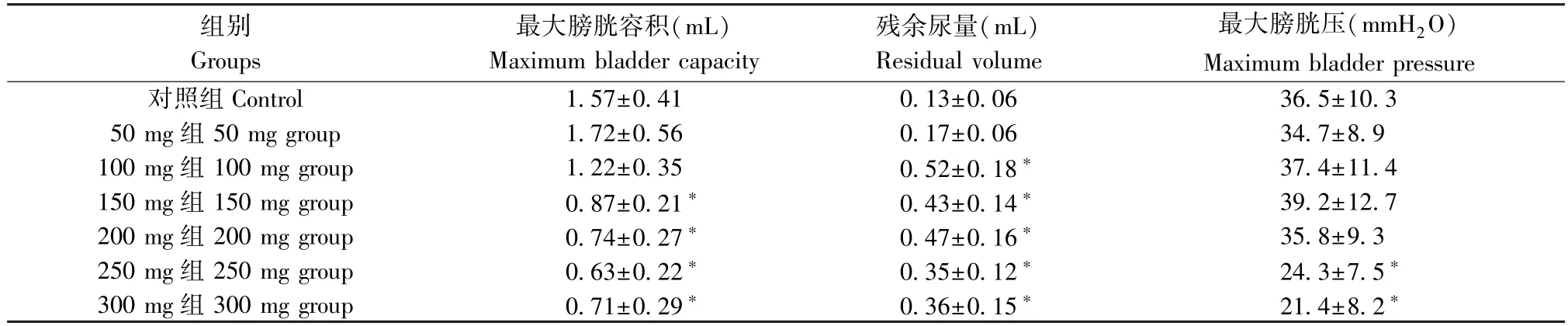
表1 大鼠尿动力学参数Table 1 Rat urodynamic parameters
2.3 膀胱炎性改变
2.3.1 大体标本观察
如表2 所示,50 mg 和100 mg 组大鼠膀胱重量、厚度和出血与对照组未见明显差异,而150~300 mg CYP 腹腔注射均显著(P< 0.05)增加大鼠膀胱重量和厚度,同时引起明显的膀胱组织水肿和出血(P< 0.05)。
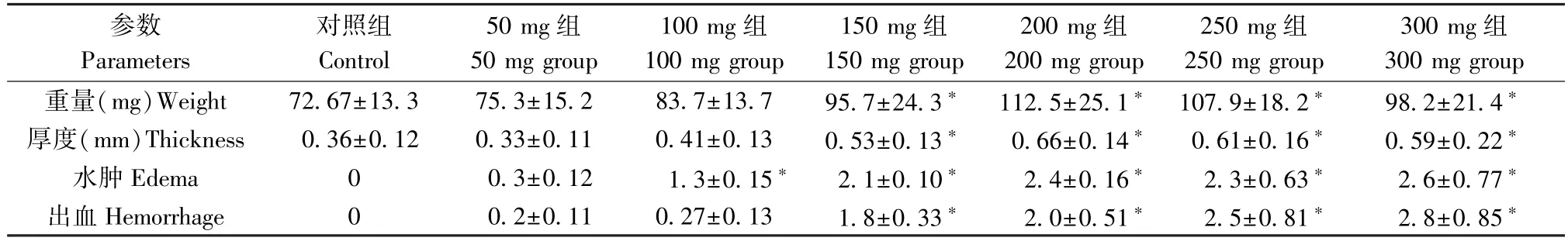
表2 大鼠膀胱炎症参数Table 2 Inflammation parameters of rat bladders
2.3.2 组织学改变
如图2 所示,50 mg 组(A)大鼠膀胱基本没有炎症改变,100 mg 组(B)部分区域可见粘膜水肿,未见出血及坏死;150 mg 组(C)和200 mg 组(D)开始出血较广泛水肿及局灶性出血,主要累及粘膜和粘膜下层,肌层可见水肿但无明显出血坏死性改变;250 mg 组(E)和300 mg 组(F)出现广泛水肿及严重出血坏死,累及肌层,可见肌纤维肿胀,部分区域伴随肌组织溶解。
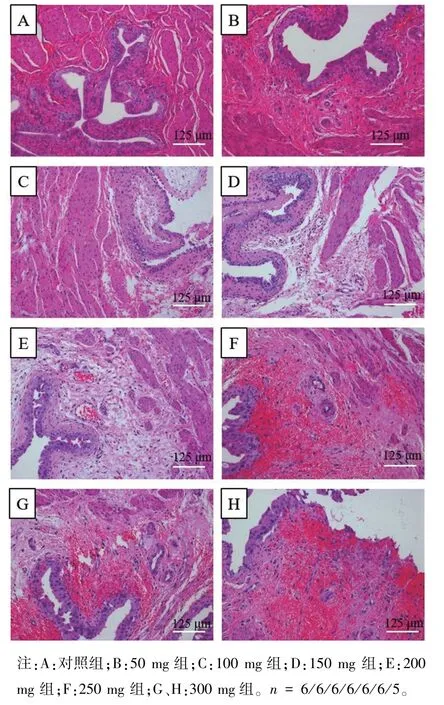
图2 大鼠膀胱组织切片HE 染色Note. A, Control group. B,50 mg group. C,100 mg group. D,150 mg group. E, 200 mg group. F, 250 mg group. G/H, 300 mg group. n = 6/6/6/6/6/6/5.Figure 2 Rat bladder sections stained with haematoxylin and eosin
2.4 IL-1β 的表达
如图3 所示,50 mg 组和100 mg 组大鼠膀胱内IL-1β 的表达较对照组未见明显差异,而150 mg、200 mg、250 mg 和 300 mg CYP 腹腔注射均显著(P< 0.05)增加大鼠膀胱内IL-1β 的表达,证实炎症反应的存在。
3 讨论
间质性膀胱炎/膀胱疼痛综合征是无明确下尿路感染和病变而出现与膀胱充盈相关的疼痛症状,伴有其他排尿异常症状如尿频、尿急、夜尿增多等的一种临床综合征,IC/BPS 病人的最主要症状是耻骨上区的疼痛和下尿路症状[17-18]。 然而,IC/BPS的发病机制目前在很大程度上仍未阐明,基于实验动物模型的相关研究在认识IC/BPS 的病理和病理生理中发挥着重要作用。
腹腔注射环磷酰胺诱导的大鼠膀胱炎模型由于较好的模拟了IC/BPS 的两大特征-疼痛过敏和膀胱炎症而被广泛用于IC/BPS 的研究[4,7],但文献报道中采用多种剂量用于大鼠模型的建立使得基于非一致模型的研究成果难以整合。 本文作者选择雌性成年大鼠作为实验对象,用50 mg/kg 至300 mg/kg 的梯度浓度CYP 行腹腔注射诱导膀胱炎模拟IC/BPS,从病理生理和器官功能两个角度对模型进行量化分析,系统性阐明了不同剂量CYP 腹腔注射建立IC/BPS 模型的病理生理和行为特征。 如图1 和图2 所示,50 mg/kg CYP 腹腔注射不引起膀胱炎性改变和大鼠痛觉敏化,显然不是建立大鼠IC/BPS 模 型 的 理 想 选 择。 Lantéri-Minet 等[19]和Boucher 等[14]使用雄性大鼠腹腔注射100 mg/kg CYP 发现,CYP 腹腔注射成功诱导大鼠膀胱出现显著的炎症改变并导致雄性大鼠内脏疼痛。 而我们基于雌性大鼠却发现,100 mg/kg CYP 虽然引起雌性大鼠一定程度的膀胱组织学炎症和功能紊乱(图2 和表1),但未升高其膀胱组织IL-1β 水平和诱发自发性内脏疼痛及敏化躯体痛觉(图1 和图3),说明性别差异在建立大鼠IC/BPS 模型时值得重视。与前期研究一致,我们发现150 mg/kg 和200 mg/kg CYP 腹腔注射较对照组引起显著的膀胱炎性改变和功能紊乱(图1 和图3),并且诱发大鼠内脏疼痛过敏和躯体痛觉敏化(图1),较好的重现了IC/BPS的两大临床症状,然而我们在200 mg/kg 组观察到大鼠死亡[14,20]。 既往研究发现CYP 腹腔注射后,膀胱炎性病理改变随着 CYP 剂量的增加而加重[14],但更高剂量的CYP 腹腔注射是否更适合用于大鼠IC/BPS 模型建立未见报道。 我们发现,250 mg/kg 和300 mg/kg CYP 腹腔注射虽然引起显著的膀胱炎症和膀胱痛觉过敏(图1 和图2),也引起膀胱组织IL-1β 显著升高(图3),但病理检查提示存在膀胱逼尿肌损伤且尿动力学测定提示膀胱收缩能力受损(图2 和表1),这些改变明显与IC/BPS 的临床特征不符,同时两组均观察到高比率的(4/10只和5/10 只)大鼠48 h 内死亡。
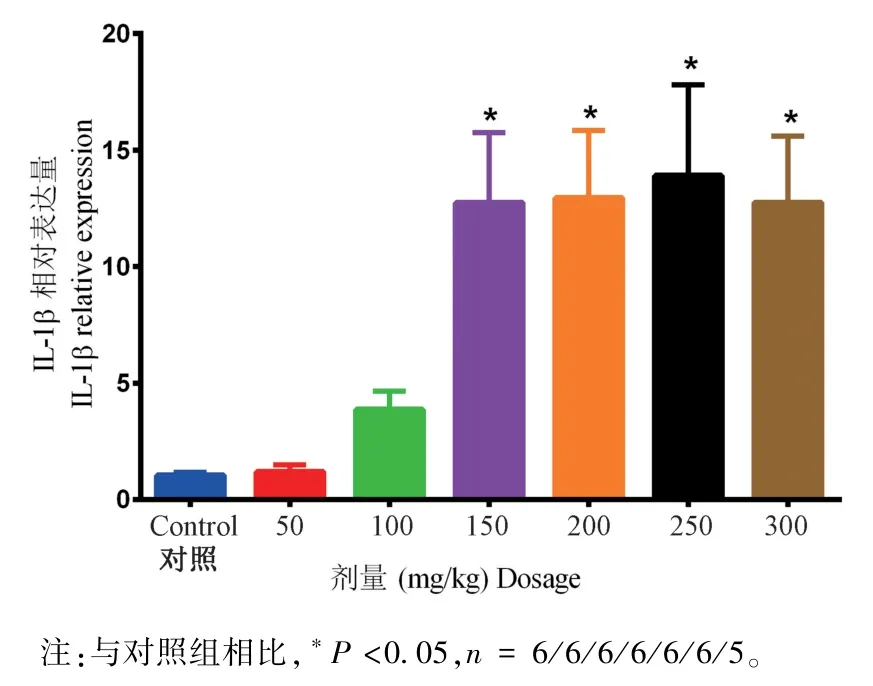
图3 IL-1β 在大鼠膀胱内的表达Note. Compared with control group,*P< 0. 05,n = 6/6/6/6/6/6/5.Figure 3 Expression of IL-1β in rat bladders
由于150 mg/kg 体重CYP 腹腔注射建立的大鼠IC/BPS 模型较好的兼顾了IC/BPS 的组织学病理改变和疼痛敏化的功能改变,并且在观察期内未见大鼠死亡,推荐作为建立大鼠IC/BPS 模型的理想剂量。 此外,大鼠性别是影响CYP 腹腔注射诱导建立IC/BPS 模型的重要因素。 由于临床上绝大多数IC/BPS 发生于女性患者,且本文数据支持性别差异与CYP 腹腔注射诱导的大鼠内脏和躯体痛觉过敏相关,因此有理由认为,雌性大鼠是利用CYP腹腔注射建立IC/BPS 模型的更佳选择。 然而,年龄及饲养条件等因素是否也影响大鼠CYP 腹腔注射诱导建立IC/BPS 模型虽然截至目前未见相关文献报道,需要进一步探索。 综上,作者推荐基于雌性大鼠采用150 mg/kg 体重CYP 腹腔注射作为建立IC/BPS 模型开展科学研究的理想方法。

