琥珀蚕孵化酶基因AaHE的克隆及启动子活性分析
陈安利, 董占鹏, 唐顺明, 刘增虎, 李 涛, 廖鹏飞, 李琼艳,*
(1. 云南省农业科学院蚕桑蜜蜂研究所, 云南蒙自 661101; 2. 安康学院陕西省蚕桑重点实验室, 陕西安康 725000;3. 江苏科技大学生物技术学院, 江苏镇江 212003)
大多数昆虫在胚胎发育完成后,利用特殊的破卵构造,如刺、骨化板、能翻缩的囊等破坏卵壳后孵化而出,这类构造常被称为破卵器。一般半翅目(Hemiptera)、脉翅目(Neuroptera)和虱目(Anoplura)昆虫在孵化前不久,胚胎外面产生一层暂时性的表皮质被膜,包裹着整个虫体,破卵器就发生在这层被膜上。没有这种被膜的昆虫,如双翅目(Diptera)的线角类、蚤目(Siphonaptera)和鞘翅目(Coleoptera)的叶甲等,它们的破卵器直接发生在幼虫的表皮上,特别是头部,一直保留到第一次蜕皮前(彩万志等, 2001)。鳞翅目(Lepidoptera)昆虫与以上昆虫存在较大差异,大多以上颚直接咬破卵壳,在此过程中孵化酶(hatching enzyme, HE)发挥了重要的作用。
1937年,Slifer研究发现蝗虫卵孵化时需要一种几丁质酶参与降解蝗虫卵白壳区域(Slifer, 1937),这是有资料可查的最早的关于昆虫卵孵化的分子生物学的研究。直到1999年,澳大利亚科学家Bowles课题组对寄生绵羊铜绿蝇Luciliacuprina卵的孵化相关的蛋白酶进行了探索研究,认为丝氨酸蛋白酶和金属蛋白酶参与了其孵化过程;2007年该课题组对人类害虫虱子卵孵化过程研究发现金属蛋白酶扮演了重要角色(Youngetal., 2000; Bowlesetal., 2008)。孵化酶在绢丝鳞翅目昆虫卵孵化过程中同样发挥了重要作用,在幼虫咬破卵壳之前,孵化酶先软化卵壳,以保护蚁蚕脆嫩的口器。唐顺明小组先后对绢丝鳞翅目昆虫家蚕Bombyxmori(Luetal., 2010; 唐顺明等, 2010; Tangetal., 2012)、野桑蚕Bombyxmandarina(唐顺明等, 2011)、柞蚕Antheraeapernyi(唐顺明等, 2011)和桑树主要害虫之一桑蟥Rondotiamenciana(王焕英, 2014)的卵孵化分子机理进行了较为系统地研究,克隆获得的孵化酶基因编码的氨基酸序列具有孵化酶特有的功能域,在进化上比较保守。该基因在体外表达系统表达获得的蛋白对家蚕卵壳底物有一定的活性(唐顺明等, 2010),孵化酶的酶学特征调查表明,一些金属螯合剂对其有较强的抑制作用,同时以孵化酶基因为靶点,利用RNAi技术有效抑制了蚕卵的孵化。
琥珀蚕Antheraeaassama属鳞翅目大蚕蛾科(Saturniidae)柞蚕属Antheraea的绢丝昆虫(Arunkumaretal., 2012; Singhetal., 2012),琥珀蚕丝与桑蚕丝相比,具有更好的强伸力、更强的吸湿性、呈金黄色金属光泽且不易褪色,经济利用价值较高(Freddietal., 1994; Ahmadetal., 2004; Unnietal., 2008)。云南省农业科学院蚕桑蜜蜂研究所于2010年在云南地区收集到琥珀蚕,经过几年的探索,成功实现了琥珀蚕的室内饲养。但由于琥珀蚕驯化程度不高,蚕卵孵化不齐,成为制约琥珀蚕大规模室内饲养的关键因素。本研究以琥珀蚕为研究对象,克隆获得琥珀蚕卵孵化酶基因cDNA全长和启动子序列,并分析其序列组成、表达特征和启动子活性,为选择合适的抑制剂或促进剂调节琥珀蚕卵的孵化率提供参考。
1 材料与方法
1.1 供试材料
供试琥珀蚕由云南省农业科学院蚕桑蜜蜂研究所于2010年从野外收集并驯养保存。蚕卵在室温下催青孵化,幼虫置于室内用天竺桂Cinnamomumpedunculatum新鲜叶片饲养,自然温度和光照,相对湿度在75%~80%之间。取5龄第3和4天幼虫的丝腺、马氏管、头、中肠、脂肪体、表皮、血液、精巢和卵巢组织,同时从母蛾产下受精卵开始每天收集卵,置于液氮中速冻后,于-80℃保存备用。
1.2 总RNA的提取和cDNA的合成
取1.1节中的各组织(每个组织为2头蚕的混合物,3次生物学重复)和卵(多个母蛾同一天产下的卵混收,每天取30粒卵,分3组,每组10粒卵)加液氮研磨成粉末,加入1 mL TRIzol (Life Technologies公司),按照RNA提取操作手册提取总RNA。提取的总RNA经琼脂糖凝胶电泳检测质量,并用BIOMATE 3S微量分光光度计(Thermo)测定浓度后取各组织的500 ng总RNA,用反转录试剂盒PrimeScriptTMRT Reagent Kit with gDNA Eraser (TaKaRa)合成cDNA,cDNA用BIOMATE 3S微量分光光度计检测其浓度和质量,稀释5倍后于-20℃保存备用。
1.3 目的基因全长cDNA的克隆和生物信息学分析
参照鳞翅目昆虫孵化酶基因的保守序列HEWMHILGFLHMHATYNR和Met-转角基序SCLHY,合成简并引物(F: 5′-GCCSAACRACACCG TYGTYTGGGA-3′; R: 5′-ACWCCYTCGTGYTCCYK CAGAGC-3′),以琥珀蚕中肠cDNA为模板PCR扩增目的基因CDS的部分序列。PCR体系: ddH2O 13.8 μL, 10×Ex Taq Buffer (20 mmol/L Mg2+plus) 2 μL, dNTP Mixture (各2.5 mmol/L) 1 μL, 上下游引物(10 μmol/L)各1 μL, cDNA模板1 μL, TaKaRa Ex Taq (5 U/μL) 0.2 μL。PCR扩增程序: 94℃ 5 min; 94℃ 30 s, 58℃ 30 s, 72℃ 1 min, 共33个循环;72℃延伸10 min。扩增产物委托生工生物工程(上海)股份有限公司进行测序。以测序鉴定后的序列为参考,设计目的基因5′-RACE和3′-RACE特异性引物(表1)。
以琥珀蚕中肠总RNA为模板,参照SMARTer® RACE 5′/3′ Kit (TaKaRa)说明书反转录获得cDNA。以合成的cDNA第1链为模板,用含有部分接头序列的通用引物UPM (表1)为上游引物,以目的基因的5′-RACE特异性引物为下游引物,PCR扩增获得目的基因cDNA的5′末端序列。以合成的cDNA第1链为模板,用目的基因的3′-RACE特异引物为上游引物,以含有部分接头序列的通用引物UPM为下游引物,PCR扩增获得目的基因cDNA的3′末端序列。PCR产物克隆进pMD19-T载体(TaKaRa)中,转化大肠杆菌EscherichiacoliTOP10感受态细胞,用含氨苄青霉素(Amp)的LB平板筛选阳性克隆。用M13引物(表1)进行菌液PCR鉴定重组质粒,鉴定后的质粒委托生工生物工程(上海)股份有限公司进行测序。测序正确的序列拼接后获得目的基因完整的cDNA序列。
利用Compute pI/Mw Tool (http:∥web.expasy.org/compute_pi/)预测目的基因编码的蛋白质的分子质量与等电点;采用SMART(http:∥smart.embl-heidelberg.de/)预测蛋白的信号肽和结构域;目的蛋白的氨基酸序列在NCBI中进行Blast。选择Blast结果中的前25个序列,用MEGA 6.0 软件(Tamuraetal., 2013)的最大似然(maximum likelihood)法构建系统进化树,重复运行1 000次判断是否属于直系同源序列。
1.4 qRT-PCR检测目的基因的表达
参照目的基因的CDS序列,设计qRT-PCR引物SYBR-F/SYBR-R(表1)。以1.2节中各组织和不同发育时期的卵的cDNA为模板,以β-actin(表1)为内参基因(陈安利等, 2018),在荧光定量PCR仪StepOnePlus Realtime PCR System (Applied Biosystems)上进行PCR反应,每个反应设置3次生物学重复(每个重复的幼虫各组织来自2头虫体、不同发育时期的卵10粒)。反应体系: 2×SYBR Premix ExTaq(Roche) 10 μL, 上下游引物(10 μmol/L)各0.8 μL, cDNA模板1 μL, ddH2O 7.4 μL。PCR扩增程序: 95℃ 1 min; 95℃ 30 s, 58℃ 1 min, 共40个循环。通过2-ΔΔCt计算目的基因在各个组织中的相对表达量。
1.5 目的基因启动子序列的克隆
以琥珀蚕5龄第4天幼虫的中肠组织为材料,参照动物基因组DNA快速抽提试剂盒[生工生物工程(上海)股份有限公司]的说明书提取基因组DNA。以1.3节获得的目的基因CDS序列为参考设计引物CDS-F/CDS-R (表1),以基因组DNA为模板进行PCR扩增,获取第一内含子序列。PCR体系: ddH2O 13.3 μL, 10×Ex Taq Buffer (20 mmol/L Mg2+plus) 2 μL, dNTP Mixture (各2.5 mmol/L) 1.5 μL, 上下游引物(10 μmol/L)各1 μL, cDNA模板1 μL, TaKaRa Ex Taq (5 U/μL) 0.2 μL。PCR扩增程序: 94℃ 5 min; 94℃ 30 s, 56℃ 30 s, 72℃ 80 s, 共33个循环;72℃延伸10 min。以第1外显子和第1内含子序列为参考设计3条同向且退火温度较高的特异性引物SP1, SP2和SP3(表1),参照Genome Walking Kit (TaKaRa)说明书,与试剂盒中提供的4种经过特别设计的退火温度较低的简并引物AP1, AP2, AP3和AP4进行热不对称PCR反应,通过3次巢式PCR反应获取上述已获得序列的侧翼序列。使用MiniBEST Agarose Gel DNA Extraction Kit Ver. 4.0 (TaKaRa)切胶回收扩增产物条带。用SP3引物对PCR纯化产物进行测序,鉴定纯化产物与上述已获得序列的同源性。使用DNA Ligation Kit (TaKaRa)将与上述已获得序列有同源性的纯化产物与pMD19-T连接,热转化至大肠杆菌感受态细胞 (TaKaRa)中,涂布平板37℃过夜培养。挑选阳性菌落植菌后提取质粒,使用M13F, M13R, P1和P2引物对质粒进行测序。以测序结果两端的序列为参考,设计引物,以基因组DNA为模板进行PCR扩增,鉴定测序结果的准确性。用启动子在线分析软件(https:∥www-bimas.cit.nih.gov/molbio/proscan/)分析获得的侧翼序列,预测启动子的核心区。设计特异性引物-727~-1F/-727~-1R (表1)扩增5′-UTR上游包含启动子核心区的序列。
1.6 目的基因启动子的活性检测
用SalⅠ和HindⅢ对1.5节中启动子扩增序列和pIZ-EGFP载体进行双酶切,将启动子扩增产物连接到昆虫细胞表达载体pIZ-EGFP的EGFP基因上游,替换pIZ-EGFP载体上的OpIE-2启动子序列,构建昆虫细胞重组表达载体。对pIZ-EGFP载体酶切位点分析时发现,在切除OpIE-2启动子序列的同时,也切除了OpIE-2启动子上游的SV40 poly (A) signal序列。为了排除SV40 poly (A) signal序列的切除对基因表达的影响,我们设计了一对引物PIZ-F/PIZ-R (表1),以pIZ-EGFP载体序列为模板,扩增了SV40 poly (A) signal序列。扩增获得的SV40 poly (A) signal序列与启动子扩增序列一起通过无缝克隆构建了重组昆虫细胞表达载体pIZ-AaHE-EGFP。无缝克隆参照In-Fusion® HD Cloning Kit试剂盒(TaKaRa)的说明书进行。构建后的重组表达载体转化大肠杆菌TOP10感受态细胞,用博来霉素(zeocin)的LB平板筛选阳性克隆。挑选阳性菌落植菌后提取质粒,质粒(1 μg)经脂质体介导转染家蚕卵巢细胞株BmN,72 h后将细胞置于倒置荧光显微镜下观察。脂质体介导参照Cellfectin Reagent试剂盒(Invitrogen)说明书进行。通过观察转染后绿色荧光蛋白EGFP的表达情况,确定获得的启动子序列是否具有活性。
2 结果
2.1 琥珀蚕孵化酶基因的cDNA全长
PCR扩增获得一条长度为516 bp的目的片段。去除两端简并引物后,最终获得的序列片段大小为469 bp。以获得的序列为参考设计目的基因的特异性RACE引物,与通用接头引物UPM一起进行PCR扩增,获得目的基因5′和3′末端的cDNA序列。利用BioEdit软件对测序片段进行拼接,获得目的基因的全长cDNA序列,长993 bp(GenBank登录号: KT336227.1),其中5′UTR长15 bp,3′UTR长65 bp,poly(A)尾巴长28 bp,CDS长885 bp,编码294个氨基酸(图1)。3′UTR含有典型的低G+C区域,并在距离poly(A)尾巴上游的13 bp处有典型的多聚腺苷酸化信号(图1)。
2.2 琥珀蚕孵化酶的氨基酸序列特征
目的蛋白的分子质量为33.7 kD,理论等电点为5.17,含有1个信号肽(1-16 aa)和1个ZnMc结构域(92-242 aa),ZnMc结构域内含有1个HExxH锌结合位点(图1)。将目的基因编码的氨基酸序列在NCBI中进行Blast分析,结果显示目的蛋白的氨基酸序列与柞蚕Antheraeapernyi类孵化酶蛋白(hatching enzyme like) ApHEL的氨基酸序列一致性最高,达到93.17%,其次是樗蚕Samiacynthiacynthia孵化酶蛋白SccHE,氨基酸序列一致性为89.80%,这与柞蚕、樗蚕和琥珀蚕同为大蚕蛾科绢丝昆虫相符。系统进化树结果显示,目的蛋白与蛾类亲缘关系明显高于与蝶类的(图2),这与琥珀蚕为大蚕蛾科昆虫相符,另外与目的蛋白亲缘关系最近的9个蛋白中有8个为孵化酶蛋白(图2),因此将其命名为琥珀蚕孵化酶蛋白AaHE(GenBank登录号: AKS39779.1)。
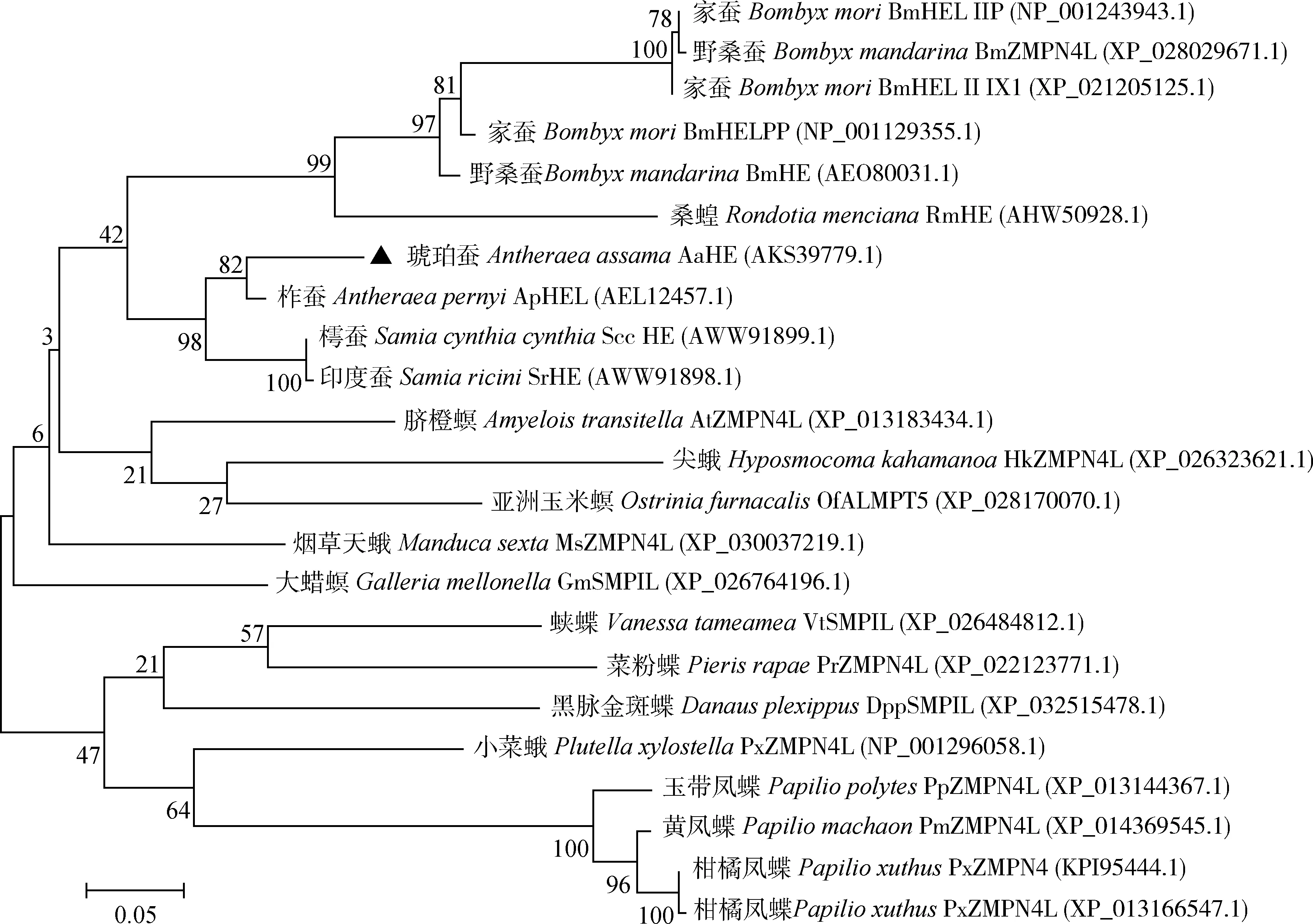
图2 最大似然法构建的基于氨基酸序列的琥珀蚕AaHE和其他同源蛋白的系统进化树
2.3 AaHE的表达谱
qRT-PCR检测结果显示,AaHE在琥珀蚕5龄第4天幼虫的中肠组织中表达量明显高于其他组织(图3),这可能与该基因参与调控中肠组织的消化吸收有关(Rawlings and Barrett, 1995)。另外,在胚胎发育过程中,AaHE表达量在胚胎发育前中期维持在很低的水平,在胚胎发育后期特别是卵孵化前(卵产下后第9天),AaHE基因的表达量迅速升高(图4),这可能与孵化过程中需要大量的孵化酶软化卵壳有关。
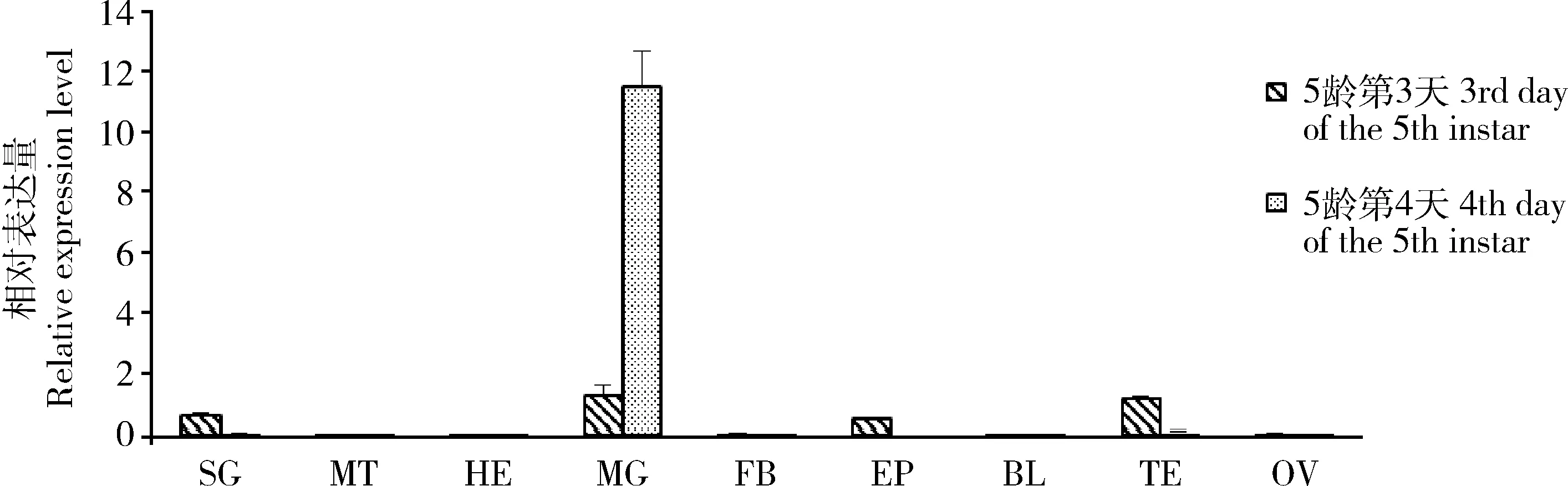
图3 AaHE在琥珀蚕5龄幼虫各组织中的相对表达量
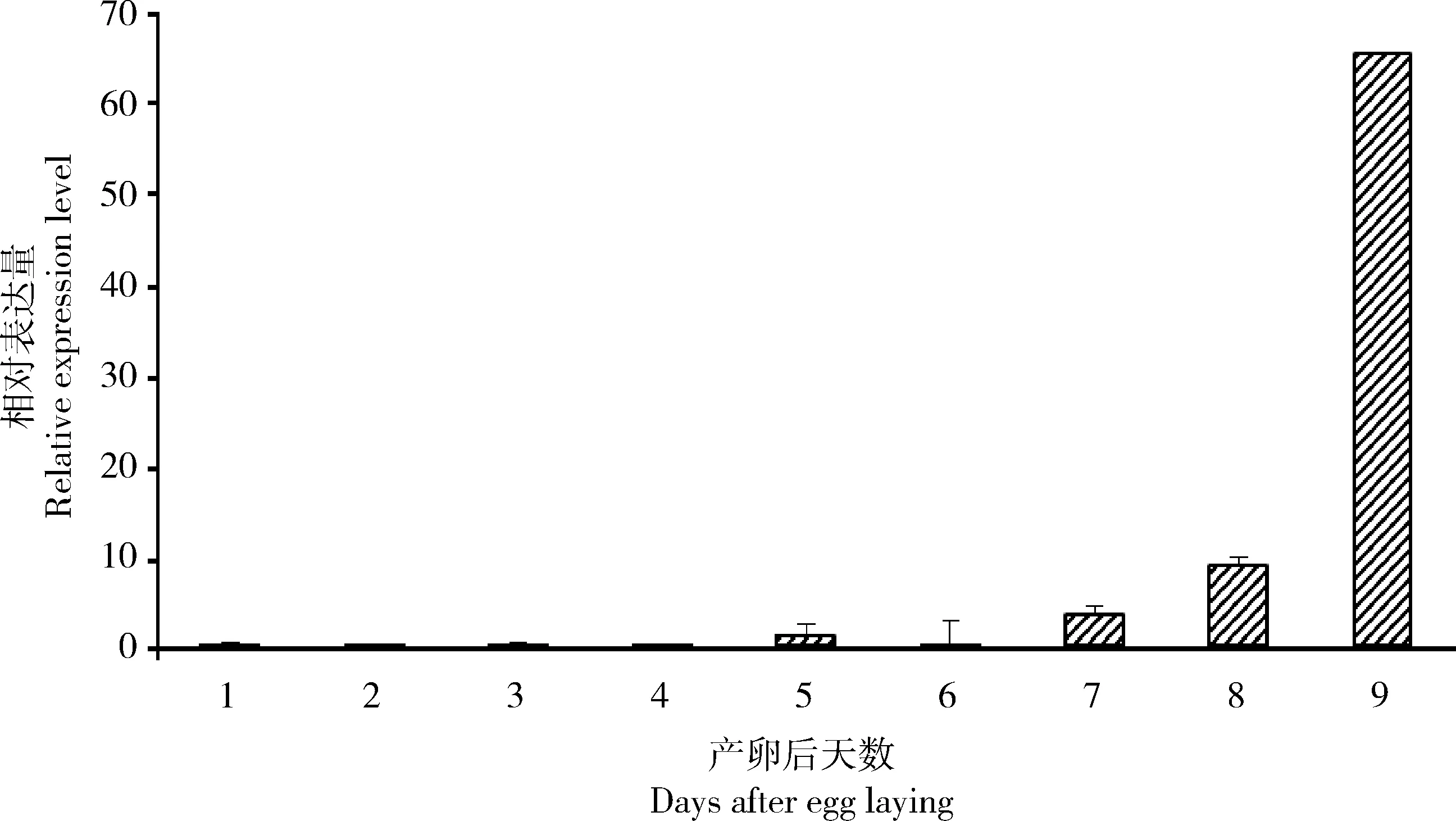
图4 AaHE在琥珀蚕胚胎不同发育阶段的相对表达量
2.4 AaHE基因启动子
克隆获得了大小为1 419 bp的第1内含子序列,以此为参考进行染色体步移,最终获得5′UTR上游共2 792 bp的序列(图5)。用在线启动子分析软件(https:∥www-bimas.cit.nih.gov/molbio/proscan/)对获得的2 792 bp序列进行分析,预测了两个启动子核心区(5′UTR的起始碱基记作+1,与之相邻的侧翼序列碱基记作-1;核心区1:-727~-477 bp;核心区2:-2 337~-2 086 bp),两个核心区均存在启动子的核心序列TATA盒和其共有序列TATAAAA(图5)。根据预测的核心区的位置,我们选择距离起始密码子较近的核心区1作进一步分析。核心区1内存在8个转录因子结合位点,其中6个为基础转录因子TFIID的结合位点,1个为转录因子EivF/CREB结合位点,1个为转录因子CP1结合位点。
2.5 AaHE基因启动子的活性
重组昆虫细胞表达载体pIZ-AaHE-EGFP经脂质体介导转染家蚕卵巢细胞株BmN,72 h后,将细胞置于倒置荧光显微镜下可以观察到明显的绿色荧光(图6),说明AaHE5′UTR上游-727~-1的序列具有启动子活性,能够启动EGFP基因的表达。
3 讨论
本研究对琥珀蚕孵化酶基因AaHE的cDNA序列分析表明,AaHE是一种含有HExxH锌结合基序的锌依赖性金属蛋白酶基因,与柞蚕、家蚕、野蚕的孵化酶基因属于同一类,该类蛋白酶既是肽酶,同时又是一种消化酶(Rawlings and Barrett, 1995)。琥珀蚕卵壳相较于家蚕,硬度更高,卵壳不经过软化,幼虫无法直接咬破卵壳。AaHE在琥珀蚕卵孵化过程中特异性高表达,可能是利用其裂解肽作用软化卵壳,起到保护幼虫口器的作用,而AaHE在中肠中特异性高表达(图3),可能与其具有的消化酶属性有关。研究者(唐顺明等, 2010)对柞蚕孵化酶的酶学特征调查表明,一些金属螯合剂对其有较强的抑制作用,而琥珀蚕孵化酶蛋白AaHE与柞蚕、蓖麻蚕Philosamiacynthiaricini、家蚕等孵化酶蛋白相似,均含有ZnMc结构域,通过分析琥珀蚕孵化酶蛋白的氨基酸序列,可为下一步选择合适的抑制剂或促进剂调节琥珀蚕卵的孵化率提供帮助。
本研究对AaHE基因启动子核心区的序列分析显示,核心区存在8个转录因子结合位点,其中6个为基础转录因子TFIID的结合位点,1个为转录因子EivF/CREB结合位点,1个为转录因子CP1结合位点(图5)。TFIID是寡聚蛋白,由TATA结合蛋白(TATA binding protein, TBP)和13个TBP相关因子(TBP associated factors, TAFs)组成(Goodrich and Tjian, 2010; Mulleretal., 2010)。当TFIID与启动子结合后,TAFs可以与转录激活因子、共激活因子、染色质修饰因子、转录延伸因子等发生相互作用,使TFIID接受来自不同方面的调控信号,从而调控基因的表达(Aaslandetal., 1995; Bell and Tora, 1999; Garbettetal., 2007; Lauberthetal., 2013)。研究表明,TFIID在配子发生和早期胚胎发育过程中发挥了重要作用(郝国礼和于海泉, 2014),但其是否会影响昆虫卵的孵化,目前尚未见报道。转录因子EivF和CREB具有相同的识别位点,二者均是从HeLa细胞中分离而来,通过结合腺病毒早期III区(EIII)和早期IV区(EIV)启动子中的CRE(cAMP response element)促进转录(Cortesetal., 1988)。EivF与腺病毒EIV启动子特异性结合,CREB能够与腺病毒EIV启动子中的CRE以及腺病毒EIII启动子中的两个DNA元件(ATF和AP1)结合(Merinoetal., 1989; Mirallesetal., 1989),两者之间的相互作用关系目前还不清楚。转录因子CP1的报道较少,研究表明CP1对酿酒酵母甲硫氨酸生物合成 (methionine biosynthesis, MET)基因的转录起到促进作用(O'Connelletal., 1995)。本研究为进一步采用凝胶电泳阻滞法确定特异性结合的转录因子或蛋白,通过调控特异性转录因子的表达进而达到调节AaHE表达的目的提供了参考。

