超声辅助糖基化改性卵白蛋白乳化性能的研究
闫雨洁,董明英,陶加明,杭方学
(广西大学 轻工与食品工程学院,南宁 530004)
目前,有多种天然或改性蛋白质在食品配方中作为乳化剂或乳化稳定剂被用于制备纳米乳液,其可以充当脂溶性营养物质的递送系统,具有有效保护油的氧化、抑制精油的蒸发等作用[1-2]。卵白蛋白具有降压、抗菌、抗氧化、调节免疫活性等极高的应用价值[3]。但由于自身结构以及在特殊的食品加工条件下会发生变性,导致OVA的乳化能力较差[4]。因此,研究合适的方法改善OVA的乳化性能有重要意义。
超声波技术作为一种操作简单、清洁无污染的处理手段,在食品加工领域应用越来越广泛。它不仅可以加快反应速度,提高反应产率,还可以改善产物的功能特性[5-7]。文献[8]研究发现,超声辅助糖基化反应制备赖氨酸-木糖接枝物比传统湿热法产物得到了更高浓度的调味化合物。李素云等[9]研究了超声和未超声处理下的小麦蛋白与壳聚糖接枝物,发现在低超声功率下制备的接枝物稳定性更高。文献[10]研究了超声处理获得的接枝物的理化性质与结构变化对乳化性能提高的影响。目前对超声辅助糖基化改性产物的功能性质研究较多,但在超声辅助糖基化改性蛋白的乳化体系中,对乳液稳定性的影响和乳液稳定机理的研究相对较少。
本试验在超声波处理下,将卵白蛋白与木糖接枝在一起,并将其制备成乳液。考察了乳液的加速测试稳定性、冻融稳定性、热稳定性和盐稳定性,并将其与传统湿热法进行了比较,揭示了通过超声波改变构象的蛋白质与糖形成接枝物对乳液性能的影响。该研究将为以OVA为原料在食品配方中作为乳化剂提供参考。
1 材料和方法
1.1 材料与试剂
卵清蛋白(OVA,A5253,分子量为45 kDa):Sigma公司;木糖(Xyl,分子量为150.13 Da)、邻苯二甲醛、十二烷基硫酸钠、β-巯基乙醇:分析纯,麦克林化学试剂有限公司;大豆油:益海嘉里食品科技有限公司。
1.2 主要仪器
Scientz-IID超声波细胞破碎仪 宁波新芝生物科技有限公司;Cenlee 18R冷冻离心机 湖南湘立科学仪器有限公司;IRTracer-100傅里叶红外光谱仪 日本岛津公司;Ultra-Turra T18高速剪切分散器 德国IKA公司;Malvern Nano ZS90激光粒度分析仪 英国Malvern公司;Olympus CKX41显微镜 日本奥林巴斯公司。
1.3 试验方法
1.3.1 超声波辅助卵白蛋白糖基化产物的制备
超声处理是通过超声波细胞破碎仪将超声探头直接浸入溶液中进行的,超声处理条件设置为500 W时具有脉冲模式(3 s打开和2 s关闭)。超声波辅助卵白蛋白糖基化产物的制备是将OVA与木糖按照质量比为1∶3溶于0.1 mol/L,pH 8.0的磷酸盐缓冲液中,配制浓度为80 mg/mL的溶液,搅拌直至完全溶解。混合物在65 ℃水浴中加热120 min,其中包括在反应的初期持续20 min,将OVA与木糖的混合溶液进行超声辅助水浴加热,然后进行水浴加热(非超声处理),可累积100 min。反应完成后,将溶液放置在冰水浴中直至温度降低到室温。最后将接枝物冷冻干燥并保存在4 ℃下以便进一步分析。此外,接枝物也采用传统湿热法制备。
1.3.2 糖基化程度(DG)的测定
采用过邻苯二甲醛(OPA)法测定蛋白质的游离氨基含量,进而来计算DG。准确称取40 mg邻苯二甲醛溶解于1 mL的甲醇中,分别加入20% (W/V)的十二烷基硫酸钠(SDS)2.5 mL、0.1 mol/L的硼砂25 mL和100 μL β-巯基乙醇,最后用蒸馏水定容至50 mL,此为OPA试剂,OPA试剂应现用现配。测定时取OPA试剂4 mL于试管中,分别注入200 μL适当稀释的样品液,混匀后于35 ℃反应2 min,然后在340 nm下测得样品吸光值。以在OPA 试剂中加入200 μL蒸馏水作为空白样,赖氨酸用作计算游离氨基含量的标准。通过下式计算原始OVA 和接枝物的DG:
DG/%=(C0-Ct)/C0×100。
式中:C0和Ct分别为原始OVA 和接枝物的游离氨基含量。
1.3.3 傅里叶变换红外光谱(FTIR)
通过FTIR分析接枝物的二级结构变化。在测量之前,将样品与经高温烘干的溴化钾混合并压成薄片,使用FTIR光谱在500~4000 cm-1波段进行扫描获取光谱。
1.3.4 乳液活性(EAI)和乳化稳定性(ESI)的测定
乳液活性(EAI)和乳化稳定性(ESI)的测定根据比浊法稍作修改。将5 mL接枝物溶液和10 mL磷酸盐缓冲液(pH 7.0,0.01 mol/L)混合并水合15 min。将5 mL大豆油添加到混合物中,并通过高速剪切分散器在10000 r/min均质2 min,然后立即用移液器从容器底部吸取50 μL的乳液添加到5.0 mL 0.1% SDS中,测量其在500 nm处的吸光度值,EAI和ESI按下式计算:
式中:A0和A10是0 min和10 min时在500 nm处测量的吸光度;N是稀释因子(100);C是蛋白质浓度,g/mL;φ是油体积分数(0.25);L是比色皿的路径长度(1 cm)。
1.3.5 乳液制备
将浓度为1%(W/V)的接枝物溶液和5%(V/V)的大豆油混合,并使用高速剪切分散器以10000 r/min将混合物预乳化2 min,制成粗乳液。之后使用超声波细胞破碎仪将混合物处理15 min。超声处理条件设置为400 W,具有脉冲模式(脉冲持续时间设置为2 s打开和2 s关闭)。乳化过程使用冰水浴,以避免温度过高。
1.3.6 液滴尺寸测量
乳液制备后直接测定乳液样品的粒径。使用激光粒度分析仪在25 ℃下测量乳液的平均液滴尺寸。在测量之前,将样品稀释100倍,以避免多重散射效应。
1.3.7 乳液微结构
使用显微镜的10倍放大倍率研究乳液的微观结构。将一小滴乳液滴在显微镜载玻片上,并盖上盖玻片观察。
1.3.8 加速测试的稳定性分析
使用高温下的加速试验评估乳液的长期稳定性。将制备好的乳液密封在10 mL透明的旋盖小瓶中,以最大程度地减少蒸发,然后将乳液储存在设定为60 ℃的烘箱中。在不同的储存时间,即0,3,5,7 d,将乳液取出进行粒度测量。
1.3.9 冻融稳定性分析
将制备好的乳液密封在10 mL透明的旋盖小瓶中,立即将其放入温度为-18 ℃的冰箱中24 h。冷冻后将样品置于25 ℃的水浴中融化2 h以解冻。重复此冻融程序2次,并在每个循环后对乳液进行粒度测量和显微镜观察。
1.3.10 对高温和高盐浓度的稳定性分析
为了研究乳液的耐盐和耐温性,制备NaCl浓度为0.2 mol/L的乳液,并在90 ℃的水浴中处理30 min,然后将样品置于冰水中将其冷却至室温,将乳液取出进行粒度测量和显微镜观察。
1.3.11 数据统计分析
所有试验重复3次,结果表示为平均值±标准差。使用SPSS 26.0统计软件对结果进行统计分析,采用单因素方差分析(ANOVA)和邓肯多重范围检验(Duncan's)来评估显著性差异(p<0.05),采用Origin 9.0软件绘图。
2 结果与分析
2.1 接枝度(DG)分析
样品的接枝度(DG)通常被用来作为反映美拉德反应进程的指标。DG的增加代表着游离氨基的减少。OVA、OVA-X接枝物和uOVA-X接枝物的DG值见表1。
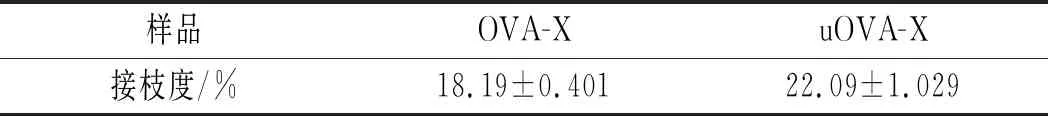
表1 OVA、OVA-X接枝物和uOVA-X接枝物的DG值Table 1 DG values of OVA,OVA-X conjugates and uOVA-X conjugates
由表1可知,糖基化反应后,OVA-X的接枝度为18.19%,表明在加热过程中OVA与糖之间发生了美拉德反应。蛋白质的游离氨基与糖的还原端羰基之间的缩合反应可降低蛋白质中游离氨基的含量[11]。DG表明糖成功地与OVA结合。而超声处理后,接枝度增加为22.09%,表明超声处理可以加快OVA与木糖之间的接枝反应。这是因为在超声处理过程中,超声空化过程中能够为接枝反应提供更多能量[12],这导致分子快速运动,从而使反应基团更接近,加速蛋白质和糖之间的糖基化。此外,超声处理可能破坏蛋白质的三级和四级结构,从而导致蛋白质分子结构内部的游离氨基逐渐暴露于分子表面参与接枝反应[13]。
2.2 FTIR分析
蛋白质与糖发生反应,FTIR光谱中会出现新的谱带,或者谱带的吸收强度或位置会发生变化,可以用来分析蛋白质-碳水化合物系统。OVA、OVA-X接枝物和uOVA-X接枝物的FTIR光谱见图1。
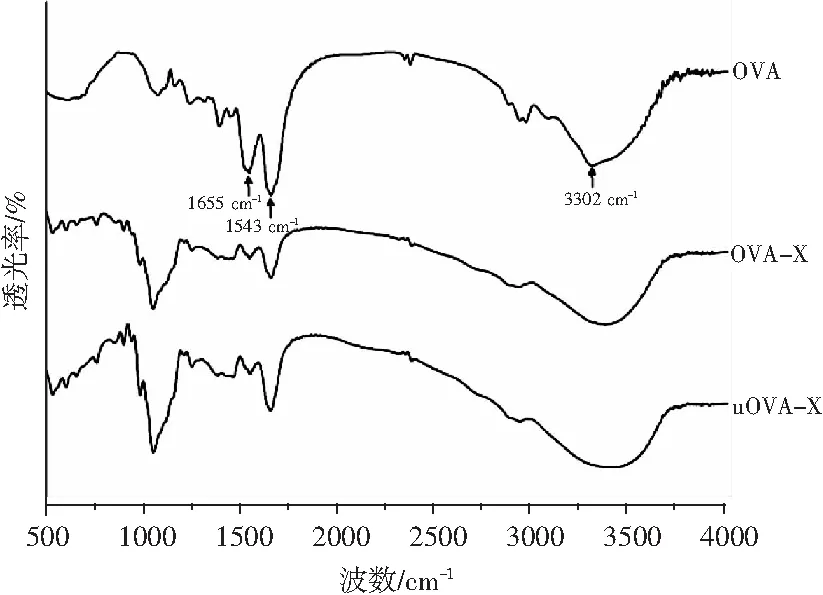
图1 OVA、OVA-X接枝物和uOVA-X接枝物的红外光谱图Fig.1 FTIR spectra of OVA,OVA-X conjugates and uOVA-X conjugates
由图1可知,与OVA相比,接枝物OVA-X、uOVA-X的峰值在3600~3000 cm-1变宽,并且吸收峰从3302 cm-1移至更高的吸收强度,这些变化是由于游离和键合的羟基和氨基基团能够与蛋白质中肽键的羰基形成氢键[14]。OVA的酰胺II和酰胺III的谱带分别在1543,1238 cm-1处观察到,接枝物OVA-X、uOVA-X的吸收峰均移至更高波数,同时酰胺I、酰胺II谱带的吸收强度降低,这归因于在美拉德反应期间消耗了部分氨基,以上结果表明OVA和糖发生了接枝反应,改变了OVA的结构[15]。与OVA-X相比,uOVA-X红外光谱的吸收峰位置和强度发生了细微变化,但红外光谱显示出相似的特征。
2.3 超声改性接枝物的乳化性能
OVA、OVA-X接枝物和uOVA-X接枝物的乳化活性和乳化稳定性见图2。

图2 OVA、OVA-X接枝物和uOVA-X接枝物的乳化活性(EAI)与乳化稳定性(ESI)Fig.2 Emulsification activity (EAI)and emulsification stability (ESI)of OVA,OVA-X conjugates and uOVA-X conjugates注:不同小写字母表示差异显著(p<0.05),下同。
由图2可知,OVA-糖接枝物的EAI和ESI均优于OVA。这是因为接枝物更具两亲性,能够迅速扩散,吸附到油滴表面,形成大分子稳定层,增强乳状液滴表面的空间排斥,从而阻止油滴的絮凝和聚集[16]。通过超声处理获得的OVA-糖接枝物的EAI和ESI比OVA-X显著提高(P<0.05),这与DG值一致。这些结果表明,超声处理下的OVA糖基化反应可能是提高OVA 乳化性能的更有效方法。其EAI和ESI的改善可以从两个方面进行解释;一方面归因于通过超声处理,其蛋白质内部疏水基团更易与糖中的还原端羰基反应,从而达到新的疏水-亲水平衡,这有利于乳液的形成和稳定。另一方面,超声处理可能会由于与空化有关的效应而导致蛋白质在水中进一步延伸,分子结构的形态从紧密的球形结构转变为松散,暴露出内部疏水基团。这些作用是通过暂时分散聚集体和破坏聚合物链中的共价键而引起大分子解聚,从而增加蛋白质分子的迁移率,更有利于其在油-水界面上的吸附和展开[17]。
2.4 加速测试对超声改性接枝物的乳液稳定性的影响
在食品工业中,乳液需要具有一定的长期稳定性。因此,需要了解乳液在储存过程中的物理稳定性。故通过在60 ℃下的加速试验评估天然OVA、OVA-X和uOVA-X制备乳液的长期稳定性。乳液在60 ℃加速测试时的平均粒径见图3。
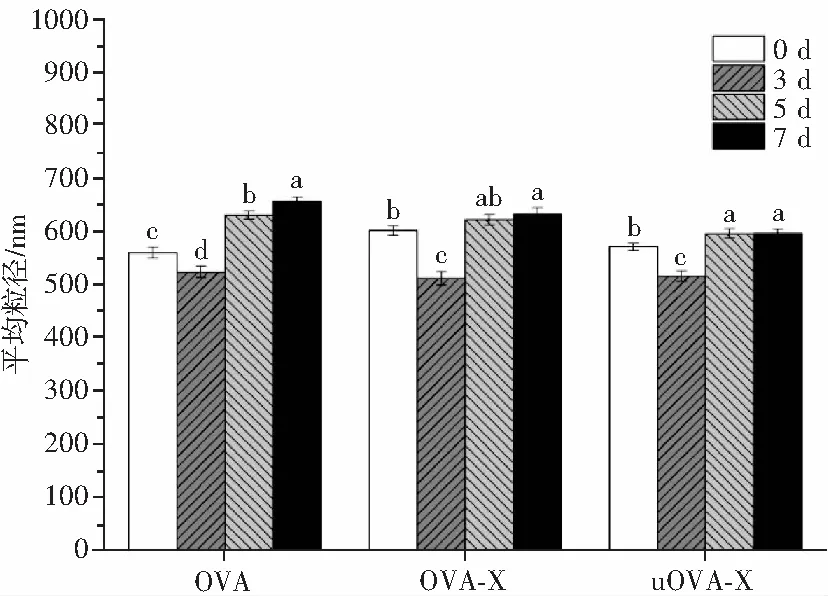
图3 乳液在60 ℃加速测试时的平均粒径Fig.3 The average particle size of emulsion at 60 ℃ acceleration test
由图3可知,乳液OVA-X的平均粒径增大。这是因为木糖的引入增加了乳液的平均粒径。此外,在超声处理下乳液 uOVA-X的平均粒径随之减小。这可能是由于超声空化作用引起的强烈剪切力使乳液液滴破裂,变得更小。这有助于接枝物在水油界面的迁移和在油滴表面的吸收率,从而阻止了液滴重力分离和聚集。对于在储存过程中乳液液滴尺寸的变化,天然OVA在储存7 d后显著增加(p<0.05),这表明OVA制备的乳液稳定性较差。由OVA-X制备的乳液在储存期的第5天和第7天观察到乳液平均粒径变化不明显。相比之下,对于uOVA-X制备的乳液,乳液平均粒径在第5天和第7天的变化几乎可以忽略不计。结果表明,接枝物能够提供足够的乳液稳定性来对抗加速试验,而增加超声处理更有利于乳液稳定性的提升。这是因为在糖基化反应后,接枝物可以比天然蛋白在油滴周围形成一个更厚的弹性粘膜并产生位阻,从而可以增强油滴之间的排斥性空间力,保护相邻液滴免于絮凝和聚集[18]。而在超声处理下,会导致更多蛋白质内部疏水基团的暴露,使其达到新的疏水-亲水平衡,有利于乳液的稳定,从而增强了抗加速稳定性。
2.5 连续冻融对超声改性接枝物的乳液稳定性的影响
近年来,对于类似蛋黄酱这一类冷冻储存后在使用前解冻的乳液,其潜在的应用正在增加。然而大多数用天然蛋白制备的乳液在冷冻和融化后变得不稳定,甚至完全分解成油相和水相,限制了OVA在冷冻食品中的利用。因此,提高OVA乳液的冻融稳定性具有重要意义。循环冻融前后乳液的平均粒径见图4。

图4 循环冻融前后乳液的平均粒径Fig.4 The average particle size of emulsion before and after freeze-thaw cycles
由图4可知,在冻融发生后,OVA制备的乳液的平均粒径变化较大,而OVA-X和uOVA-X制备的乳液的平均粒径变化较小,表明其对冷冻具有很大的耐受性。同时,在图5中显示了用OVA、OVA-X和uOVA-X制备的乳液的显微镜图像,当第一次冻融发生后,由OVA制备的乳液具有许多明显的多分散性大油滴和不规则形状的聚集体。这是因为OVA制备的乳液的空间位阻不足以抵抗油滴之间的聚集,油滴之间的排斥力降低,OVA乳液的油滴发生絮凝。而OVA-X和uOVA-X制备的乳液的显微镜图像几乎没有变化,仍表现出内部密集且均匀分布的小油滴。冻融循环后,OVA制备的乳液液滴发生了更严重的絮凝和聚结,同时生成了更大的油滴,这主要归因于冷冻过程中冰晶的形成可以穿透被吸附的蛋白质层,从而促进油滴的絮凝[19]。另外,低温条件可能改变了蛋白质的构象结构,从而可能导致膜层保护功能丧失[20]。而OVA-X制备的乳液在第二次冻融发生后似乎比OVA保持了更好的稳定性,因为除了出现多分散性的大液滴,乳液的絮凝和聚结并不明显。由uOVA-X制备的乳液的显微镜图像几乎没有变化。OVA-X制备的乳液在油滴表面上形成较厚的界面层,使冷冻时形成的晶体难以渗透并破坏油滴周围的界面膜,从而防止了冻融循环后的聚结。而通过超声制备的乳液可能由于其具有较高净电荷的液滴,产生更强的静电排斥力以减少聚集[21]。

图5 乳液2次冻融循环前后的微观结构Fig.5 The microstructure of emulsion before and after two freeze-thaw cycles
2.6 高温和高盐对超声改性接枝物的乳液稳定性的影响
食品工业中通常采用热处理技术来防止食品变质。之前有研究表明,由蛋白质制备的水包油乳液,本质上是热力学不稳定的递送系统,对高温和高盐浓度敏感,乳液体系易发生聚集、絮凝和相分离。这是由于高温和高盐浓度会导致OVA变性,从而导致疏水性氨基酸和二硫键基团暴露,通过疏水性相互作用和二硫键促进进一步的絮凝[22]。因此,有必要了解乳液在高温和高盐浓度情况下的物理稳定性。加热前后乳液的平均粒径见图6。
由图6可知,加热30 min后,OVA制备的乳液的平均粒径较OVA-X制备的乳液显著增大,而uOVA-X制备的乳液的平均粒径几乎没有变化。超声处理进一步增加了乳液的耐高温和高盐浓度的稳定性。显微镜图像进一步支持了OVA、OVA-X和uOVA-X三者制备的乳液稳定性的差异,见图7。
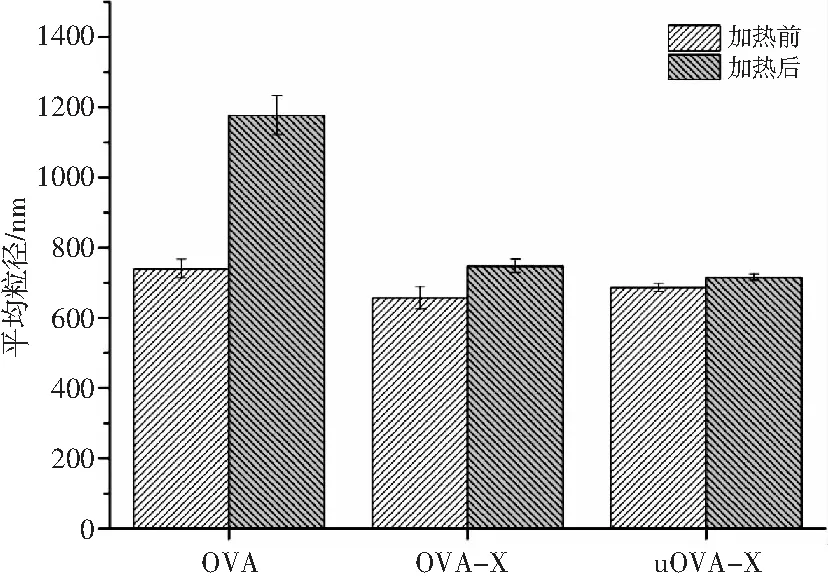
图6 加热前后乳液的平均粒径Fig.6 The average particle size of emulsion before and after thermal treatment

图7 乳液加热前后的微观结构Fig.7 The microstructure of emulsion before and after thermal treatment
由图7可知用OVA、OVA-X和uOVA-X制备的乳液的显微镜图像,当盐浓度为0.2 mol/L,在90 ℃条件下加热30 min时,由OVA制备的乳液油滴发生了絮凝和聚结。而OVA-X和uOVA-X制备的乳液的显微镜图像几乎没有变化,仍表现出内部密集且均匀分布的小液滴。结果表明,糖基化反应对高盐高热诱导聚集具有抑制作用。这是因为糖基化反应增加了空间位阻,从而降低了液滴之间的吸引力。试验结果表明,当乳液为高温高盐体系,相对于天然OVA,OVA-X和uOVA-X制备的乳液表现出更好的稳定性,这为OVA-X和uOVA-X在食品工业中作为乳化剂进行热巴氏灭菌提供了可能性。
3 结论
本试验对OVA、OVA-X、uOVA-X制备的乳液稳定性进行了系统研究。经超声处理的糖基化改性蛋白乳液具有更小的液滴尺寸以及更好的加速测试稳定性、冻融稳定性和耐高温高盐稳定性。初步明确了适当的超声处理可以导致OVA的空间构象和分子结构发生变化,促进糖基化反应的进行,这有利于乳液稳定。此外,超声处理通过暂时分散聚集体等行为阻止了乳液在不良条件下油滴的重力分离和聚集。因此,通过超声波辅助糖基化反应提高OVA乳化性能是可行的,这为扩大OVA在食品工业中的应用提供了有用的信息。

