骨肉瘤细胞中miR-215-5p和eIF2a靶向关系及临床意义
张 哲,程漠松,庄 鹤,田晓东
(锦州市第二医院,辽宁 锦州 121000)
骨肉瘤的形成涉及机体多种遗传因子,包括DNA、RNA等分子遗传改变。近年研究显示骨肉瘤的发病率呈明显的升高趋势[1-3]。蛋白质合成是维持细胞稳态和肿瘤细胞增殖的关键步骤,在蛋白质翻译过程中真核细胞翻译起始因子常发生变化,对于调控下游的肿瘤性增殖起重要作用。真核细胞翻译起始因子2a(Eukaryotic translation initiation factor 2a,eIF2a)参与其中,其对细胞增殖、肿瘤细胞迁移及上皮间质转化均有重要价值[2]。eIF2a发挥作用过程中受多种因子的调控,微小RNA(microRNAs,miRNAs)是eIF2a上游调控的重要因子[4-7],本研究经数据库初筛和前期实验的筛选,选择可能与eIF2a有结合位点的miR-215-5p进行相关实验研究。本实验基于骨肉瘤细胞进行实验设计,探讨miR-215-5p与eIF2a的靶向关系,分析二者表达的临床意义。
1 材料与方法
1.1 实验材料 人骨肉瘤细胞系Saos2购于中国科学院上海细胞生物学研究所。TRIZOL、细胞培养基PRMI1640及胎牛血清购自美国Gibco公司,ECL显色液购自美国Thermo公司,eIF2a购自苏州睿瀛生物技术公司,GAPDH、DAB和二抗购自北京中杉金桥生物技术公司。RIPA裂解液、胰酶消化液、质粒提取试剂盒、逆转录试剂盒购自武汉三鹰生物公司。Lipofetamine 2000和双荧光素酶试剂盒购自美国Invitrogen公司。引物由上海吉玛生物合成。酶标仪为Thermo公司生产的MK3。PCR仪为美国Bio Rad IQ5。
1.2 研究对象 选择2018年1月至2020年12月在我院确诊为骨肉瘤并行手术治疗的患者38例作为观察对象。病例纳入标准:①均有术后病理诊断,且符合WHO中的标准;②首次发病并确诊;③临床随访资料完整。排除标准:①伴有其他器官恶性肿瘤;②家族遗传性疾病;③术前行放、化疗。患者中男20例,女18例,年龄5~78岁,平均(18.1±4.5)岁。留取术后肿瘤组织新鲜标本(-80 ℃保存)和石蜡包埋标本。研究经医院伦委员会批准同意,符合《赫尔辛基宣言》中的要求,家属签定知情同意书。
1.3 实验方法
1.3.1 细胞培养:人骨肉瘤细胞系Saos2应用10%胎牛血清、1%青霉素的RPMI1640培养基,在37 ℃、5%CO2培养箱中培养,当细胞生长至80%时进行传代,调整细胞浓度为5×105个/ml接种于12孔板中,每孔1 ml。构建质粒进行细胞转染,建立阴性对照组、无关序列组、miR-21-5p mimic组、miR-21-5p inhibitor组。操作严格按说明书操作,减少污染及人为误差。
1.3.2 双荧光素酶报告基因实验:应用双荧光素酶报告基因实验观察miR-215-5p与eIF2a 3’UTR的结合情况。将含有eIF2a mRNA 3’UTR的野生型(pGL3-eIF2a-WT)和突变型(pGL3-eIF2a-MT)报告质粒,分别同miR-215-5p mimic、阴性对照组(NC)共转染到细胞系Saos2中,4 h后换液,继续培养48 h后观察荧光素酶的活性。
1.3.3 miR-215-5p的检测:应用实时荧光定量PCR(Real time fluorescence quantitative PCR,qPCR)检测miR-215-5p的表达。TRIZOL提取总RNA并进行验证。miR-215-5p引物上游:5’-TCGTGTCGTAGTGTGACTGTGG-3’,下游:5’-GCCTGTATAGGACACGTACT-3’。U6为内参,引物上游:5’-GGCAGACGCGAAGATTAGC-3’,下游:5’-TTGGAACGCAAATTCCG-3’。应用逆转录试剂盒合成cDNA。扩增程序:95 ℃ 5 min;95 ℃ 25 s,64 ℃ 20 s,72 ℃ 20 s,31个循环后进行延伸。读取Ct值,以2-ΔΔCt法表示结果。ΔΔCt=[Ct目的基因(未知样品)-Ct对照(未知样品)]-[Ct目的基因(校正样品)-Ct对照(校正样品)]。
1.3.4 Western blot实验:应用Western blot法检测eIF2a的表达。以GAPDH作为内参。依次行蛋白提取、浓度测定、变性、加样、电泳、电转及免疫杂交进行实验后,取出膜加入发光液 3 min,显影20 s。以目的蛋白与GAPDH的比值作为结果进行半定量分析,应用Image J分析完成。严格按实验步骤操作,做好质控工作。
1.3.5 免疫组化实验:组织常规行取材、脱水、石蜡包埋后,切取4 μm切片,应用免疫组化Envision 法检测eIF2a的表达,DAB显色,严格按实验步骤操作,设阳性对照,做好质控工作,减少人为误差。结果由病理医师进行判读,应用盲法,eIF2a的显色部位是细胞质,以黄色-棕褐色为阳性。应用着色强度及阳性率的综合评分法。着色强度:无着色为0分,弱为1分,中为2分,强为3分。阳性率:选择热点区进行观察,共选择5个400倍视野,以阳性率<5%为0分,5%~10%为1分,以11%~25%为2分,以26%~50%为3分,以>50%为4分。两者相乘为最终评分,总分范围0~12分。以≤5分为阴性,以>5分为阳性。计算阳性率。

2 结 果
2.1 数据库检索的结果 Target Scan数据库显示miR-215-5p与eIF2a具有可能结合的碱基序列。见图1。

图1 Target Scan数据库检索结果
2.2 eIF2a在不同组别细胞系中的表达 miR-215-5p mimic组中eIF2a的表达明显低于阴性对照组和无关序列组,miR-215-5p inhibitor组中eIF2a的表达明显高于阴性对照组和无关序列组。见图2。
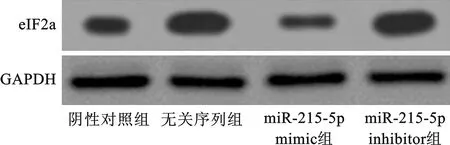
图2 eIF2a在不同组别细胞系中的表达
2.3 双荧光素酶报告基因实验结果 双荧光素酶报告基因实验显示miR-215-5p与eIF2a具有靶向关系。见图3。
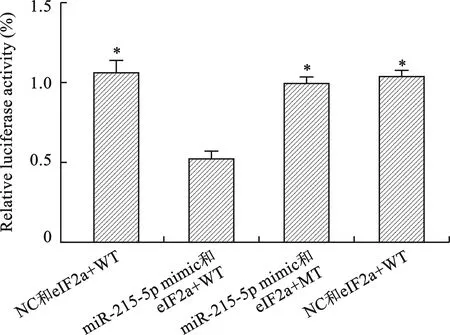
注:miR-215-5p mimic与eIF2a+WT比较,*P<0.05
2.4 骨肉瘤不同临床病理特征中miR-215-5p表达量、eIF2a阳性情况比较 骨肉瘤中miR-215-5p表达范围是1.2~3.4,平均2.3±0.3。eIF2a共20例阳性,阳性率为52.63%。由表1可见,miR-215-5p的表达量、eIF2a的阳性率在骨肉瘤不同肿瘤最大径和病变级别中的比较差异有统计学意义(均P<0.05)。而在不同性别、年龄及周围组织累犯中的差异无统计学意义(均P>0.05)。见表1(图4)。

表1 骨肉瘤不同临床病理特征中miR-215-5p表达量、eIF2a阳性情况比较

A:miR-215-5p表达的扩增曲线(PCR);B:eIF2a在骨肉瘤中阳性表达(免疫组化,×200倍)
2.5 骨肉瘤中miR-215-5p与eIF2a表达的相关性分析 应用Spearman相关分析显示骨肉瘤中miR-215-5p与eIF2a呈负相关性(r=-0.67,P=0.0146)。
3 讨 论
骨肉瘤的发生与机体的遗传物质改变有关,其中包括DNA、RNA和相关蛋白质的异常表达[8-10]。miRNAs是近年学者关注到的非编码RNA,其主要是通过调控下游因子发挥生物学作用,其异常表达与肿瘤的进展相关[11-13]。本研究基于骨肉瘤细胞系及骨肉瘤术后的病变组织进行实验研究,结果显示miR-215-5p mimic组中eIF2a的表达明显低于阴性对照组和无关序列组,miR-215-5p inhibitor组中eIF2a的表达明显高于阴性对照组和无关序列组,双荧光素酶报告基因实验显示miR-215-5p与eIF2a具有靶向关系,且经骨肉瘤组织中的相关分析得以进一步明确,提示miR-215-5p与eIF2a具有明确的靶向关系,miR-215-5p可能作为上游因子调控下游因子eIF2a的表达,参与eIF2a调控的细胞增殖、凋亡、迁移及上皮间质转化的作用。研究显示骨肉瘤中miR-215-5p的表达量、eIF2a的阳性率在不同肿瘤最大径和临床分期中差异有统计学意义,由于上述两个指标均为肿瘤进展的重要指标,提示miR-215-5p低表达、eIF2a高表达参与肿瘤的进展过程。miR-215-5p对肿瘤的调控具有直接作用。有研究显示miR-215-5p低表达时对肿瘤细胞增殖因子和凋亡相关因子有调节作用,认为miR-215-5p具有抑癌基因样的生物学作用[14-17]。miR-215-5p对细胞增殖的调控与对细胞周期的作用有关[18]。miR-215-5p可能对调控G0/G1期有一定作用。有研究显认为miR-215-5p异常表达使肿瘤细胞增殖的周期缩短,有效提高肿瘤细胞增殖的速度,其可能是通过靶因子EGFR发挥调控作用的[19]。抑制凋亡是miR-215-5p低表达时的经典作用,使细胞自身的程序性死亡细胞减少,肿瘤细胞具有“永生化”的特点。骨肉瘤病变的分级与预后直接相关,而病理学形态诊断中病变的分级常缺少客观指标,即往认为Ki67等增殖指标可能有助于分级,但是其临界值学者很难达成共识。本研究发现的miR-215-5p的表达与骨肉瘤病变的级别相关,提示miR-215-5p可能为临床病理诊断中判断病变分级提供客观的参考指标。EIF2a作为miR-215-5p调控的下游因子,可以引起Cyclin D1的增殖,并通过ATF4等途径调节MMPs的表达,从而增加了肿瘤细胞的侵袭能力。也有研究认为PERK是eIF2a的上游信号分子,共同调节VEGF发挥肿瘤的促血管生成的作用,进而促进肿瘤的进展[20]。但是关于miR-215-5p/eIF2a调控的具体通路及作用机制有待更多实验证实。
总之,骨肉瘤细胞中miR-215-5p和eIF2a具有靶向关系,miR-215-5p与eIF2a的异常表达可能参与肿瘤的进展。

