宫颈HPV持续感染湿热下注证患者阴道灌洗液的菌群分析及代谢组学研究
沈甦,赵诗贤,任青玲
(南京中医药大学附属医院,江苏 南京 210029)
宫颈癌是妇科最为常见的恶性肿瘤之一,发病率高且发病年龄趋于年轻化[1-2],是威胁女性生命健康与生活质量的重大社会问题。子宫颈鳞状上皮内病变(Cervical squamous intraepithelial lesion,SIL)为宫颈癌前病变,已在近90%的SIL和99%的宫颈癌组织中发现有高危型人乳头瘤病毒(HR-HPV)存在[3],HR-HPV是目前唯一明确的致病因素。宫颈HR-HPV感染归属于中医学“带下病”范畴,多数医家认为带下病病因以湿邪入侵,脾胃功能失调为主,病机则以湿热下注、带脉失司为主,病位位于下焦。脾虚功能失调,病久湿热内生,以致带脉失约,任脉受损,发为本病,加之湿性重浊黏滞,易损耗正气,日久正虚邪恋[4-5],正气足,则邪不胜正,临床上大部分HR-HPV感染均为一过性,可被机体免疫功能自行清除;若正气不足,邪正交争,则少部分患者持续感染,进而发展成为宫颈癌前病变甚至宫颈癌。临床上湿热下注证是带下病最常见证型之一,但中医湿热下注证不同宫颈病变类型尚缺乏明确、客观的量化指标,证候的客观化是临床亟需解决的关键问题,代谢组学为辨证客观化提供了新方法,为进一步阐释湿热下注证不同宫颈病变类型提供了物质基础。
阴道灌洗液为女性自然腔道所产生的分泌物,阴道灌洗液代谢物为阴道菌群和宿主的共同代谢产物,与生殖道感染性疾病密切相关。目前研究表明HPV感染的转归与宿主和病毒的自身因素以及阴道微环境的平衡状态有关[6]。大量研究证实,阴道菌群失衡不仅会降低机体免疫功能,亦是HR-HPV持续感染及SIL进展的始动因素[7-8],而阴道菌群及其相关代谢产物的变化可帮助揭示HR-HPV感染患者疾病进展及患宫颈癌的风险程度。
本项研究采集临床患者的阴道灌洗液,为一种非侵入性临床诊断方法,一方面为中医湿热下注证不同宫颈病变类型提供客观依据,另一方面为HR-HPV发病机制及SIL进展提供临床参考依据,将对宫颈癌的防治工作有较大的促进作用[9-11]。本研究采用气相色谱质谱(GC-MS)及16S rDNA基因测序检测HR-HPV持续感染湿热下注证患者的阴道灌洗液,进一步深入研究湿热下注证疾病进展、阴道灌洗液相关菌群及代谢产物三者之间的关联,为早期预防、诊断和临床治疗提供依据。
1 临床资料
1.1 研究对象
选取2020年5月至2020年7月于江苏省中医院妇科门诊就诊的HR-HPV持续感染患者共156例,通过宫颈液基细胞学及阴道镜下宫颈组织活检病理结果,将患者分为宫颈细胞未见病变(No intraepithelial neoplasia or malignant cells,NILM)组、低级别宫颈鳞状上皮内病变(Low cervical squamous intraepithelial lesion,LSIL)组、高级别宫颈鳞状上皮内病变(High cervical squamous intraepithelial lesion,HSIL)组,采集阴道灌洗液用于16S rDNA基因测序和代谢组学分析。该研究经过南京中医药大学附属医院伦理委员会审批,审查批件号:2020NL-KS035。
1.2 一般资料比较
3组女性在年龄、孕次及产次采用单因素方差分析,F值为1.237、0.798、1.336,P值为0.293、0.452、0.266,差异均无统计学意义(P>0.05)。宫颈活检病理结果为慢性宫颈炎伴鳞状上皮增生(NILM)组78例,LSIL组52例,HSIL组26例。如表1所示。
表1 3组患者年龄、孕次、产次比较
1.3 纳入标准
①年龄≥30岁,未绝经女性;②有性生活史且月经规律;③临床资料完整;④符合中医湿热下注证型;⑤患者知情且自愿配合检查及治疗。
1.4 排除标准
①行全子宫切除术者;②有免疫系统相关病史,正在使用免疫抑制剂者;③合并有心肺肾等其他重大疾病者;④1个月内有宫颈疾病治疗用药者;⑤妊娠期或哺乳期女性。
2 方法
2.1 阴道分泌物及阴道灌洗液的采集
采集前已征得患者知情同意,且样本采集的前3 d内患者未使用栓剂或冲洗药物,48 h内无性生活史。患者取截石位,充分暴露阴道,使用无菌棉拭子于宫颈口及阴道侧壁1/3处采集宫颈阴道分泌物,置于无菌试管中于15 min内行白带常规检测;再用5 mL 0.9%氯化钠溶液冲洗上1/3阴道壁及宫颈,回抽2 mL灌洗液,4 ℃、18 000 r/min离心10 min,将上清液与沉淀分装,-80 ℃冰箱保存。
上清液用于代谢组学分析:取500 μL标本冻干后用100 μL的纯水复溶,加入12.5 μg/mL含肉豆蔻酸的冰甲醇溶液400 μL,涡旋3 min,离心10 min(4 ℃,18 000 r/min);取上清液200 μL,置于离心浓缩仪挥干2 h;加入10 mg/mL甲氧胺的吡啶溶液30 μL,涡旋5 min,于30 ℃恒温振荡1.5 h(450 r/min);加入30 μL BSTFA,涡旋5 min,于37 ℃恒温振荡0.5 h(450 r/min);离心10 min(4 ℃,18 000 r/min),取50 μL上清液进配备AS 1310自动进样器的Trace 1310气相色谱和TSQ 8000质谱仪(美国Thermo公司)分析代谢产物组成(色谱质谱条件:分流模式,分流比20∶1,1.2 mL/min氦气,250 ℃进样口,进行升温:起始60 ℃,1 min后,20 ℃/min升至320 ℃维持5 min;进样量为1 μL。采用280 ℃离子源,250 ℃离子传输线温度,70 eV电离能,m/z采集范围为50~500,采集时间为3.5~19 min)。同时将全部标本中的上清液各取3 μL等量混合,制备QC标本来进行方法学验证,在每个含有10个样本的序列运行后,对1个QC样本进行分析,以评估系统的适用性和系统的稳定性。对得到的原始文件采用Xcalibur 2.2进行预处理,并通过内标归一化,得到代谢物名及对应的峰值。
沉淀用于16S rDNA基因测序:①进行样品总DNA抽提:将500 μL的沉淀样品,978 μL的磷酸钠缓冲液和122 μL MT分析缓冲液混合振荡40 s(6 m/s),离心10 min(4 ℃,14 000 r/min);取上清部分至1.5 mL离心管中与250 μL的PPS相混匀,再次离心5 min(室温,14 000 r/min);取上清部分2 mL离心管与已加入的900 μL Binding Matrix相混合,倒置3 min;瞬间离心5 s,小心去掉上清部分后,向其中加入500 μL的5.5 mol/L异硫氰酸胍溶液,混合均匀,将其置入旋转过滤器;加入500 μL的SEWS-M,离心1 min(室温,14 000 r/min),去掉洗涤液,再进行一次洗涤;小心去除上清部分,离心3 min(室温,14 000 r/min),再次去除上清部分,晾干3 min;加入100 μL DES洗脱液(已提前进行55 ℃预热),将样品静置5 min后离心10 min(室温,14 000 r/min),得到总DNA;②总DNA检测:使用NanoDrop2000对已抽提出的总DNA进行纯度及浓度的检测;在使用1%琼脂糖凝胶电泳来检测总DNA的完整性(其中电压使用5 V/cm,检测时间20 min);③进行PCR扩增、产物鉴定、纯化及定量:ABI GeneAmp 9700型PCR仪使用上下游引物338F(5'-ACTCCTACGGGAGGCAGCAG-3')以及806R(5'-GGACTACHVGGGTWTCTAAT-3')对16S rDNA的V3~V4可变区进行PCR扩增:预变性3 min(95 ℃),27个循环(95 ℃变性30 s,退火55 ℃,30 s,延伸72 ℃,30 s),再进行稳定延伸72 ℃,10 min,4 ℃冰箱保存;PCR反应体系为:5×TransStart FastPfu缓冲液4 μL,dNTPs(浓度2.5 mmol/L)2 μL,上下游引物(5 μmol/L)各0.8 μL,TransStart FastPfu DNA聚合酶0.4 μL,DNA模板10 ng,补充ddH2O至20 μL,每个样本有3个复制;④Illumina Miseq测序:使用NEXTFLEX Rapid DNA-Seq Kit构建Miseq文库;利用Miseq PE300/NovaSeq PE250平台(美国Illumina公司);⑤OTU聚类:样品的测序结果中对序列进行聚类操作,将序列按照相互之间所拥有的相似性将其分类为多个小组,每个小组等于1个OTU。为取得每种OTU其相对照的物种分类信息,对有97%类似水平的OTU代表序列,采用RDP classifier贝叶斯算法来进行分类学分析,并分别在各个分类学水平统计各样本的群落物种组成。
2.2 统计学方法
3 结果
3.1 标本的菌群群落及主成分分析
156例标本中共有200种共同拥有的微生物属,组内特有的微生物NILM组有149种、LSIL组有86种、HSIL组有73种。标本内微生物多样性与宫颈病变级别成正比。乳酸杆菌的丰度在每个组都占据绝对优势,丰度第2的则为加德纳菌。随着宫颈病变等级上升,奇异菌属、纤毛菌属以及其他杂菌的丰度上升,链球菌属的丰度则下降。如图1所示。
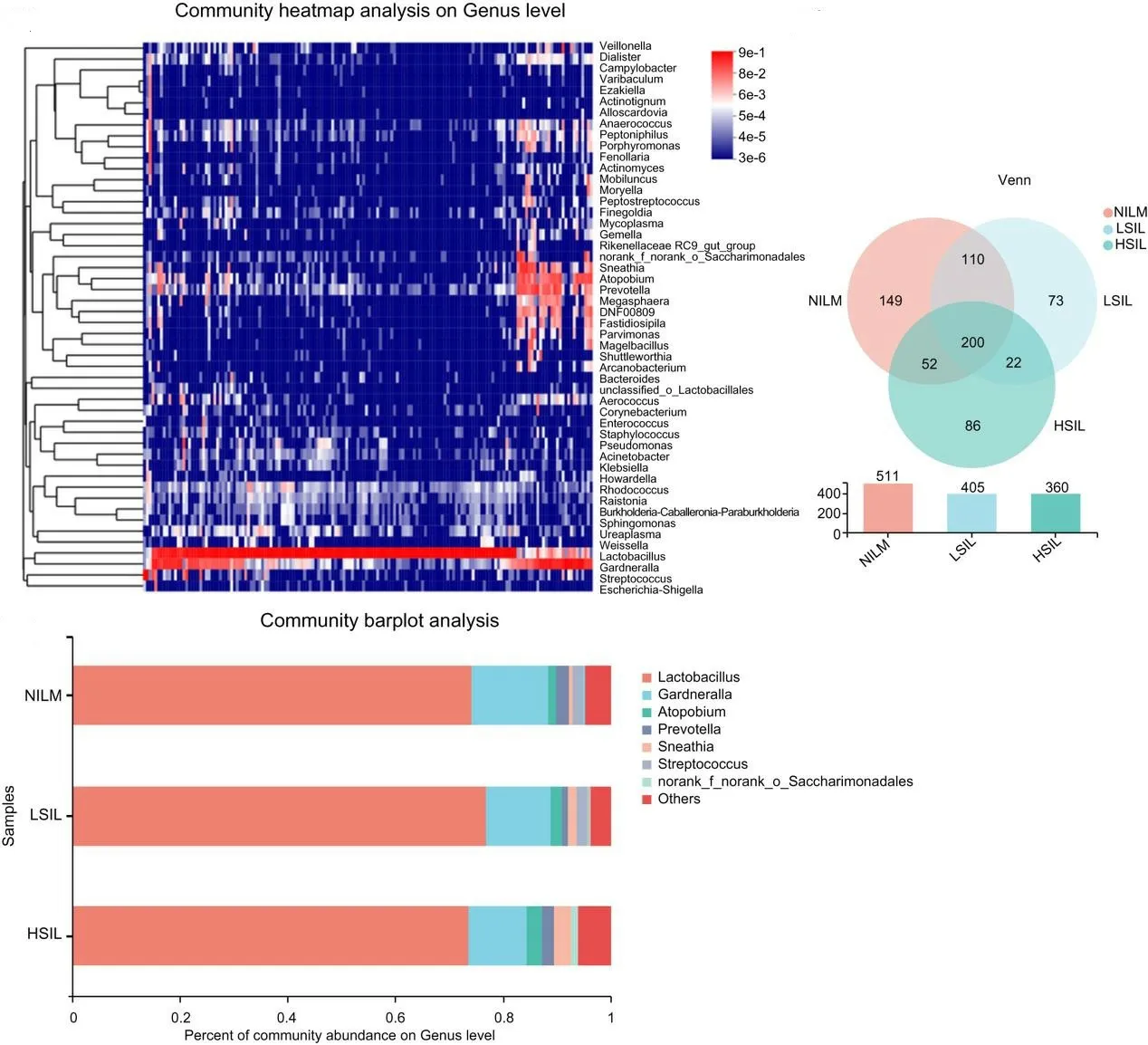
图1 3组标本之间的微生物种类数量及组成情况
3.2 标本的代谢组学分析
一共检测出了164种已知代谢产物,采用倍数变化法发现每组间均有10余种特征代谢物将各组区分开来。NILM组与LSIL组之间的差异代谢物由高到低依次为牛磺酸、鸟嘌呤、尿酸、黄嘌呤等。LSIL组与HSIL组之间的差异代谢物由高到低依次为蔗糖、肌氨酸、苯三酚、十六烷醇等。LSIL组与HSIL组之间的差异代谢物由高到低依次为苯乙醛、腺苷、α-氨基己二酸、葡萄糖醛糖醇等。采用MannWhitney检验,其中牛磺酸在NILM组和LSIL组(P<0.000 1)、LSIL组和HSIL组(P<0.000 1)之间均有显著性差异;鸟嘌呤在NILM组和LSIL组(P<0.000 1)、LSIL组和HSIL组(P=0.002 1)之间均有显著性差异;尿酸在NILM组和LSIL组(P<0.000 1)、LSIL组和HSIL组(P=0.010 2)之间均有显著性差异,如图2所示。而与NILM组相比,尿酸在HSIL组中有所下调,牛磺酸、鸟嘌呤在这2组之间无统计学差异。牛磺酸、鸟嘌呤、尿酸与NILM组相比,在LSIL组显著下调;与LSIL相比在HSIL组中显著上调,证明宫颈病变初步进展,会大量消耗宫颈阴道环境中的氨基酸、嘌呤等,而随着病变级别增高,则氨基酸、嘌呤等代谢产物可能产生代偿性上调参与宫颈阴道上皮细胞的免疫防御功能。
通过OPLS-DA来分析不同宫颈病变程度的HPV感染患者代谢模式的变化,研究发现NILM组与HSIL组、LSIL组与HSIL组的代谢模式均有显著分离趋势,这表明HSIL的患者与其他患者的分泌物代谢模式有着明显差异。如图3所示,NILM组与HSIL组的OPLS-DA评分R2Y=0.765,Q2=0.407;LSIL组与HSIL组的OPLS-DA评分R2Y=0.921,Q2=0.594。
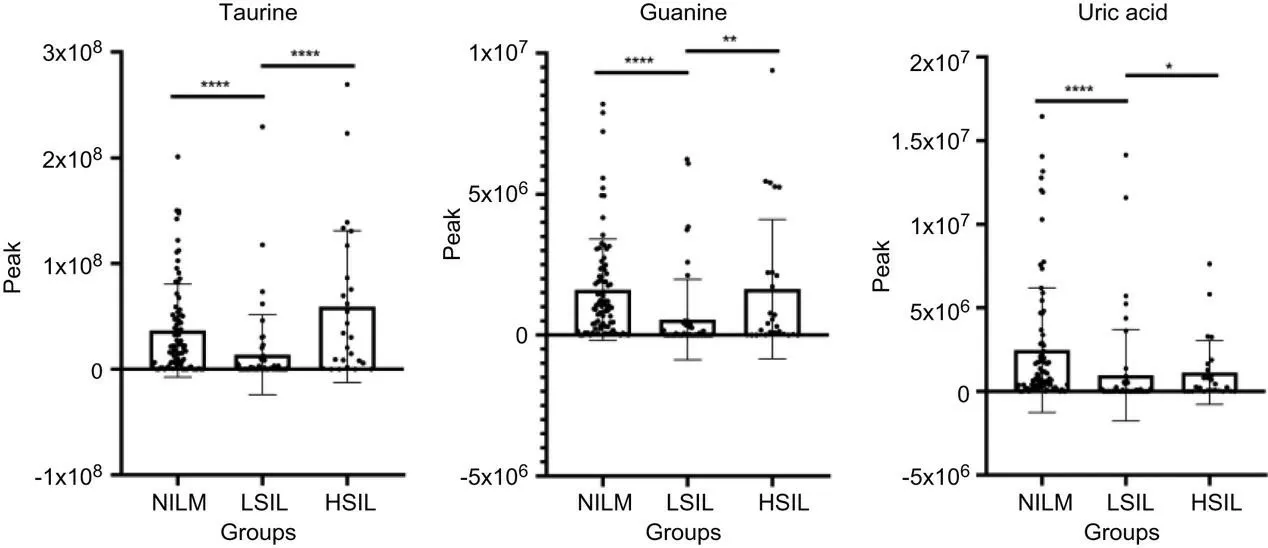
图2 牛磺酸、鸟嘌呤及尿酸在不同组别间的峰值变化
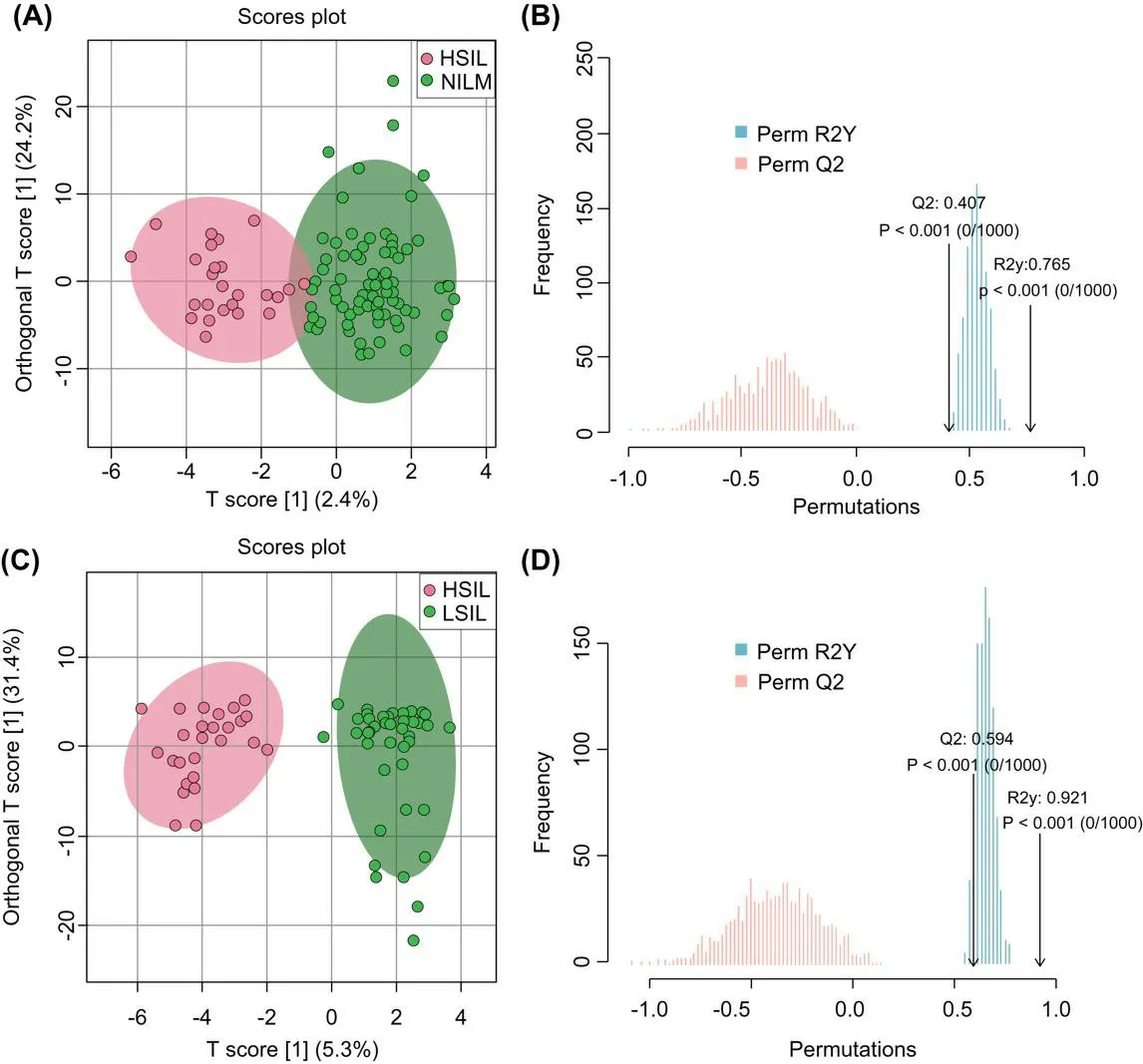
注:A~B.NILM组和HSIL组;C~D.LSIL组和HSIL组图3 各组OPLS-DA图
3.3 阴道菌群对HR-HPV感染患者的代谢通路分析
使用Metaboanalyst对上述潜在标志物进行代谢通路分析后,根据通路拓扑分析得到的影响值>0.1的相关通路,其中影响LSIL发生的代谢途径的通路主要有5个,影响HSIL发生的代谢途径的通路主要有5个。如图4所示。
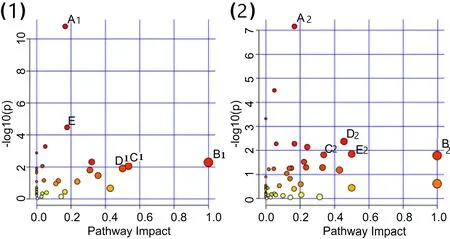
注:宫颈阴道菌群影响LSIL发生的代谢途径:A1.Aminoacyl-tRNA biosynthesis;B1.Phenylalanine, tyrosine and tryptophan biosynthesis;C1.Alanine, aspartate and glutamate metabolism;D1.D-Glutamine and D-glutamate metabolism;E1.Arginine biosynthesis。宫颈阴道菌群影响HSIL发生的代谢途径:A2.Aminoacyl-tRNA biosynthesis;B2.Phenylalanine, tyrosine and tryptophan biosynthesis;C2.Alanine, aspartate and glutamate metabolism;D2.beta-Alanine metabolism; E2.Phenylalanine metabolism
3.4 阴道菌群与代谢产物的相关性分析
用VIF方差膨胀因子分析筛选代谢产物,将多重共线性较小的相关临床因子保留,进行相关性研究。过滤掉VIF值大于10的无用因子,再通过相关性Heatmap分析计算代谢产物与丰度前50的物种之间的相关性系数。由图中可以看出多种代谢产物与阴道菌群有显著关联性。牛磺酸与魏斯氏菌、卟啉单胞菌、理研菌科RC9肠道群(Rikenellaceae_RC9_gut_group)呈正相关性,与棒杆菌属、Rhodococcus菌、青枯菌呈负相关性。羟胺、羟基脲、羟基丁酸、羟苯基丙酸等羟基类产物与多种阴道菌群呈显著正相关,但与乳酸杆菌呈负相关。甘露醇、甘油、鸟嘌呤、腺嘌呤、肌氨酸、酪氨酸、苏氨酸等则正好相反。如图5所示。
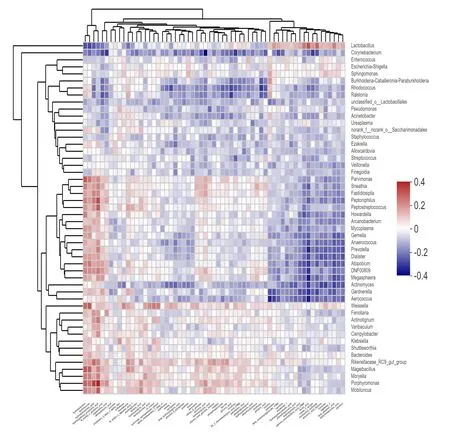
图5 标本的阴道菌群与代谢产物的相关性热图
4 讨论
本研究发现大多数HR-HPV感染女性的阴道菌群由乳酸杆菌和加德纳菌组成,但随着宫颈病变程度的加重,标本中所含的微生物的多样性也随之上升。奇异菌属、纤毛菌属以及其他杂菌的丰度上升,链球菌属的丰度下降。这种微生物多样性及丰度的变化可能对宫颈阴道局部微环境的代谢能力有所影响。本研究筛选出阴道灌洗液相关的164种代谢物,其中氨基酸、嘌呤、糖类等代谢产物在具有宫颈癌病变风险的女性中变化较大。本研究还发现宫颈癌前病变的HR-HPV感染女性相较于宫颈细胞尚未病变、仅有HR-HPV感染的女性,宫颈阴道微环境中的牛磺酸、鸟嘌呤、尿酸等都有明显改变。已知牛磺酸是一种少见的氨基酸,是心脏、视网膜、骨骼肌和白细胞中最丰富的游离氨基酸[12]。牛磺酸已被证明在许多氧化性损伤模型中具有组织保护作用。牛磺酸可生成为更稳定但毒性较小的牛磺酸氯胺。牛磺酸氯胺是免疫系统的强大调节剂,可下调小鼠和人白细胞中促炎性介质的产生。还可抑制炎症细胞因子的有效信号转导因子NF-κB的激活[13]。最新研究表明,在探索人体抗菌感染的天然防御过程中,发现低含量的牛磺酸可导致病原菌在肠道内定植,而高含量牛磺酸则可产生足够的硫化氢以阻止病菌感染[14],佐证了本研究中随宫颈病变进展,牛磺酸的含量变化可能原因为患者因感染病毒,阴道菌群失衡,免疫防御功能降低,故在LSIL组中含量降低,后代偿性上调以阻止病毒感染的发展过程。鸟嘌呤已被证实可以调节肠道神经系统[15],另外鸟嘌呤的衍生物7,8-二氢-8-氧鸟嘌呤(8-oxoG)的氧化损伤也被证实与炎症有明显的相关性[16]。尿酸是杂环嘌呤衍生物,是嘌呤代谢的最终氧化产物。研究发现尿酸可降低E-cad在大鼠肾小管上皮细胞中的表达,进而导致上皮细胞无法协调增加肾血流量所需的物质,如一氧化氮等[17]。此外,尿酸晶体可通过膜脂改变激活先天宿主防御机制,触发强大的炎症和免疫激活[18]。氨基酸、嘌呤、尿酸等代谢异常证明湿热下注证HR-HPV患者炎症反应增强,免疫防御反应则受到抑制。从中医理论分析,患者湿热蕴结下焦,脾胃虚弱运化失常,后天之精难资先天,同时热盛加重阴液耗伤,以致代谢通路异常,且热盛易使水湿酿生湿毒,以致带脉失约,任脉受损,湿热毒邪难祛。
综上,本研究通过微生物组学和代谢组学的多组学联合,研究了不同宫颈病变程度的HR-HPV持续感染湿热下注证患者的阴道灌洗液的差异代谢物,筛选后宫颈阴道菌群通过调节氨基酸、酯类、嘌呤、脂质的合成与分解,可能在激活炎症及免疫系统上起着重大作用。牛磺酸、鸟嘌呤、尿酸可能成为预测宫颈病变发生发展的潜在标志物,进一步通路分析还发现了7条可能与之相关的代谢通路,包括氨酰基-tRNA生物合成通路、苯丙氨酸和酪氨酸和色氨酸通路、丙氨酸和天冬氨酸和谷氨酸代谢通路、D-谷氨酰胺和D-谷氨酸代谢通路、精氨酸生物合成通路、β生丙氨酸代谢通路、苯丙氨酸代谢通路。中医证候诊断将带下量多色黄作为主症。带下量多色黄可能是由于其阴道菌群紊乱、体内局部炎症、氨基酸、脂类及嘌呤代谢异常所致。研究结果表明,HR-HPV持续感染湿热下注证患者主要影响氨基酸代谢、嘌呤代谢、脂质代谢等,说明本病证引起机体氨基酸、嘌呤、脂质代谢紊乱。
本研究将湿热下注型HR-HPV持续感染患者阴道灌洗液作为样本来源,仅纳入中医湿热下注证,本病其他证型尚未纳入,结果可能较为片面,期望未来可通过扩大不同证型样本来完善实验,进一步证实HR-HPV持续感染患者的特征代谢产物及相关代谢通路。另外阴道灌洗液采集简单无创,若能将此诊断手段用于HR-HPV持续感染相关证型的早期诊断,辅助临床治疗,将对清除HPV、预防宫颈癌的发生具有重大意义。

