BaFe2O4/BaSO4复合光催化剂的制备及降解罗丹明B废水的活性研究
郑 伟,侯 芳,高喜平
(1.济源职业技术学院冶金化工系,河南济源459000;2.河南科技大学化工与制药学院)
为了降低有机染料废水对河流造成的污染,半导体光催化技术迅速发展起来[1-3]。目前降解有机废水取得工业化应用的半导体光催化剂主要是TiO2[4]和SrTiO3[5],但这些光催化剂仅能响应紫外光,而太阳光中紫外光的比例较小,这极大地限制了它们在光催化降解有机废水领域的应用[6-7]。为了解决这一难题,开发新的可响应可见光的光催化剂去降解有机染料废水具有重要的研究意义。硫酸钡(BaSO4)被认为是一种潜在的半导体光催化剂[8],将其与TiO2复合具有高的光催化活性[9],因此受到了科研人员的青睐。受此启发,开发半导体复合物光催化剂可有效地增强单相半导体光催化剂的光催化活性。铁酸钡(BaFe2O4)是一种潜在的磁性光催化剂,但其电荷迁移率低、电荷载流子复合速率高,很难再在光催化领域取得实用[10]。而BaSO4作为一种电子受体材料,很容易将电荷载流子分离。将BaSO4和BaFe2O4二者复合,制备BaSO4/BaFe2O4复合物光催化剂并研究其光催化活性意义重大。
1 实验
1.1 材料合成
1.1.1 BaSO4的合成
称取适量的BaCl2·2H2O和Na2SO4加入到一定量的去离子水中,用柠檬酸作为络合剂络合Ba离子,加入NaOH调节溶液的pH,直至出现白色沉淀。随后将其静置24 h,采用无水酒精洗涤数次,在120℃干燥48 h,获得BaSO4,记为样品S1。
1.1.2 BaFe2O4的合成
按BaFe2O4的化学计量比称取nBa∶nFe=1∶2的适量硝酸钡和硝酸铁前驱体,依次缓慢溶解在50 mL去离子水中。待上述溶液澄清后,加入5 g柠檬酸络合上述金属离子。待完全络合后,加入适量的丙烯酰胺和聚丙烯酰胺,随后在100℃加热至形成凝胶。将凝胶转移至干燥箱中120℃干燥48 h获得干凝胶。将获得的黑色干凝胶进行研磨,放在氧化铝坩埚中700℃煅烧3 h获得BaFe2O4,记为样品S2。
1.1.3 BaSO4/BaFe2O4复合物光催化剂的合成
称取BaSO4与BaFe2O4质量比为5∶95和10∶90的复合物充分混合,分别记为样品S3和S4。样品S3和S4的质量均为1.00 g,样品S3和S4中BaSO4的质量分别为0.05、0.10 g。在研钵内手工研磨1 h,随后将研磨好的粉末转移到氧化铝坩埚内,放置于箱式电阻炉中400℃烧结2 h,升温速率为10℃/min。待冷却至室温后取出,获得5%BaSO4/BaFe2O4和10%BaSO4/BaFe2O4复合物光催化剂。
1.2 材料表征
采用DX2700型X射线粉末衍射仪表征BaSO4、BaFe2O4、5%BaSO4/BaFe2O4和10%BaSO4/BaFe2O4复合物光催化剂的相结构和纯度,其中辐射源为CuKα,测试角度范围为10~90°,管电流为30 mA,管电压为40 kV。采用FTIR-650型傅里叶红外光谱仪(FTIR)对BaSO4、BaFe2O4、5%BaSO4/BaFe2O4和10%BaSO4/BaFe2O4复合物光催化剂进行红外光谱分析。采用UV 1800型紫外可见分光光度计对BaSO4、BaFe2O4、5%BaSO4/BaFe2O4和10%BaSO4/BaFe2O4复合物光催化剂的紫外可见漫反射光谱进行测试分析。采用721分光光度计测量紫外光或模拟太阳光辐照降解前后罗丹明B染料的浓度,表征所合成样品的光催化活性。
2 结果与讨论
2.1 相结构与纯度分析
图1是样品S1、S2、S3和S4的XRD谱图。样品S1为采用柠檬酸络合法合成的纯的正交相BaSO4的XRD衍射谱图,由28个衍射峰组成,其晶面指数分别为(110)、(020)、(111)、(120)、(200)、(021)、(210)、(121)、(211)、(221)、(131)、(122)、(212)、(041)、(222)、(132)、(103)、(150)、(023)、(142)、(332)、(152)、(313)、(501)、(351)、(352)、(531)和(600),标准PDF卡片号为24-1035,空间群为Pbnm(62)。样品S2是采用溶胶凝胶法合成的纯六方相BaFe2O4的XRD衍射谱图,由17个衍射峰组成,其晶面指数分别为(111)、(402)、(610)、(020)、(711)、(612)、(022)、(004)、(802)、(422)、(404)、(614)、(822)、(232)、(424)、(1220)和(216),标准PDF卡片号为26-0159,空间群为P6322(182)。样品S3和S4是将BaSO4和BaFe2O4按质量比为5∶95和10∶90经研磨、低温烧结而得的5%BaSO4/BaFe2O4和10%BaSO4/BaFe2O4的XRD衍射峰。从图中可以看出,除了BaSO4和BaFe2O4的衍射峰外,不含其他杂质峰,表明通过研磨和低温烧结处理未导致样品发生结构变化。随着BaSO4含量的增加,BaFe2O4的衍射峰强度略有下降。根据谢乐公式(1)计算可得样品S1、S2、S3和S4的晶粒尺寸。

图1 样品S1、S2、S3和S4的XRD谱图Fig.1 XRD patterns of samples S1,S2,S3 and S4

式中,D是晶粒尺寸;k是谢乐常数;λ是X射线的入射波长;β是半高宽;θ是衍射角。经计算,样品S1、S2、S3和S4的晶粒尺寸分别为30.5、25.6、27.4、28.7 nm。
由傅里叶红外光谱(FTIR)可获得半导体材料的官能团,进一步分析它的相纯度。图2是样品S1、S2、S3和S4的FTIR谱图。对于全部样品,在3 425、1 631 cm-1处均出现了特征峰,主要归因于伸缩和弯曲振动的吸附水[11]。样品S1位于1 199、1 075、503 cm-1处的特征峰主要归因于SO42-[12],在618 cm-1处出现了Ba—O键的特征峰[12]。由此可知,采用柠檬酸络合法合成了纯相的BaSO4。样品S2和S3位于2 935、2 454 cm-1处的特征峰主要是由于样品吸附了CO2所致。位于1 755、1 424、1 075、850、702、618、470 cm-1处的特征峰能被归因于Ba—O键、Fe—O键等的吸收峰及少量的与碳和碳酸根有关的有机物的官能团[13]。可见,采用传统的溶胶凝胶法可合成六方相的BaFe2O4。当加入少量的BaSO4后,样品S3和S4中出现了相应的特征峰,未出现其他杂质峰。结果表明,采用研磨法结合低温烧结技术合成BaSO4/BaFe2O4复合物光催化剂不会改变主相的相结构和纯度。
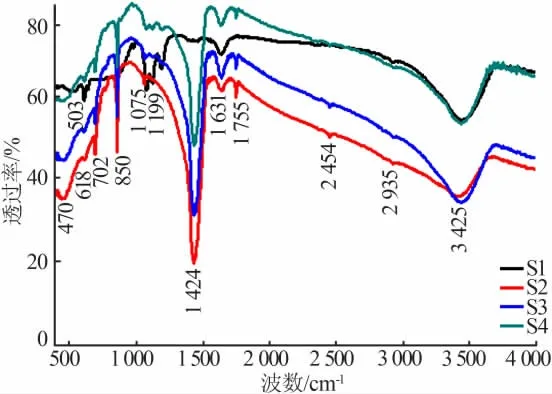
图2 样品S1、S2、S3和S4的FTIR谱图Fig.2 FTIR spectra of samples S1,S2,S3 and S4
2.2 表面形貌分析
半导体材料的表面形貌对光催化剂的光催化能力具有一定的影响。一般认为,颗粒越均匀越细小代表该光催化剂具有高的比表面积,在光催化过程中能与染料分子更充分地接触,从而增强光催化剂中的活性位与染料分子发生反应的机会。图3是样品S1、S2、S3和S4的SEM照片。从图3a可以看出,采用化学法合成的BaSO4颗粒呈球形、均匀细小、颗粒间粘连团聚少、平均颗粒尺寸约为150 nm左右。由图3b可以看出,采用溶胶凝胶法合成的BaFe2O4样品的颗粒近似呈球形,部分颗粒的形状不规则;颗粒表面光滑,很少有未长大的细颗粒附着;平均颗粒尺寸接近800 nm。当将BaSO4和BaFe2O4进行低温烧结复合时,形貌变得不均匀,但总体呈两级分化现象。从图3c可以看出,BaSO4质量分数仅为5%时,大颗粒含量占了绝大多数,细颗粒粘连在大颗粒的表面,部分细颗粒呈分散状态。BaSO4质量分数进一步增加到10%时,大颗粒的含量略有下降,如图3d所示。

图3 样品S1、S2、S3和S4的SEM照片Fig.3 SEM images of samples S1,S2,S3 and S4
2.3 光学性质分析
光学性质分析可研究半导体光催化剂的光吸收能力和能带值,进一步为光催化活性分析和光催化机理研究提供实验依据。图4a是样品S1、S2、S3和S4的紫外可见漫反射光谱。 从图4a可以看出,除了样品S2外,其余样品的反射率均随着波长的增加而增大。样品S2在400 nm波长以下反射率出现了两次大的波动,可能是由于有机物官能团对样品产生了影响所致。根据文献[14],样品的颜色参数可被计算,如表1所示。从表1可以看出,样品S1的L*值接近100,表明样品的颜色为白色。当引入少量的BaSO4后,BaSO4/BaFe2O4复合物光催化剂的L*发生了明显变化。其余参数的变化趋势与L*值类似。根据紫外可见漫反射光谱和Kubelka-Munk(K-M)公式可获得所有样品的紫外可见吸收光谱,如图4b所示。从图4b可以看出,样品S1、S3和S4在200~1 100 nm范围内均具有光吸收能力,表明它们具有紫外可见光光催化活性。样品S2在紫外光范围内具有较强的吸收系数,而在可见光范围内吸收系数最小,可见样品S2具有极强的紫外光光催化活性。这仅是一种推论,需要后续进行光催化活性研究。
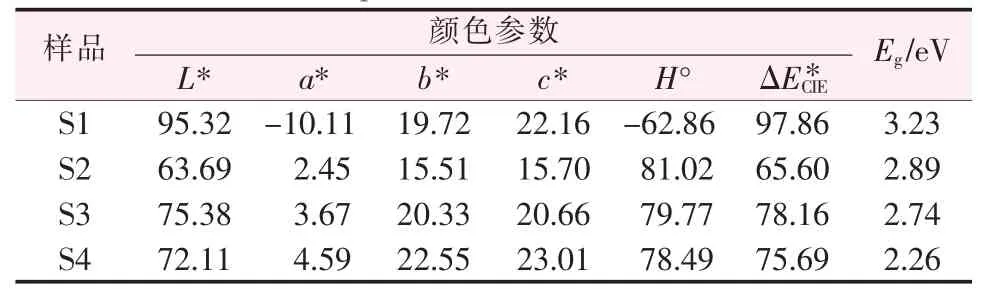
表1 样品S1、S2、S3和S4的颜色参数和E g值Table 1 Color parameters and E g values of samples S1,S2,S3 and S4
根据紫外可见吸收光谱和Tauc关系,可获得样品S1、S2、S3和S4的(αhν)2—hν曲线图,如图5所示。将曲线最陡处的斜率外延至与横坐标的交点,交点值即为样品S1、S2、S3和S4的Eg值。从图5可以看出,样品S1、S2、S3和S4的Eg值分别为3.23、2.89、2.74、2.26 eV。从图5a看出,BaSO4的带隙值接近文献[15]报道的结果。从图5b还可以看出,出现了两个最陡处斜率的交点值为2.89、3.79 eV,其中2.89 eV最接近文献[16]报道的结果。因此,本实验中认为2.89 eV为BaFe2O4的能带值。

图4样品S1、S2、S3和S4的紫外可见漫反射光谱(a)和紫外可见吸收光谱(b)Fig.4 UV-Vis diffuse reflectance spectra(a)and UV-Vis absorption spectra of samples S1,S2,S3 and S4(b)
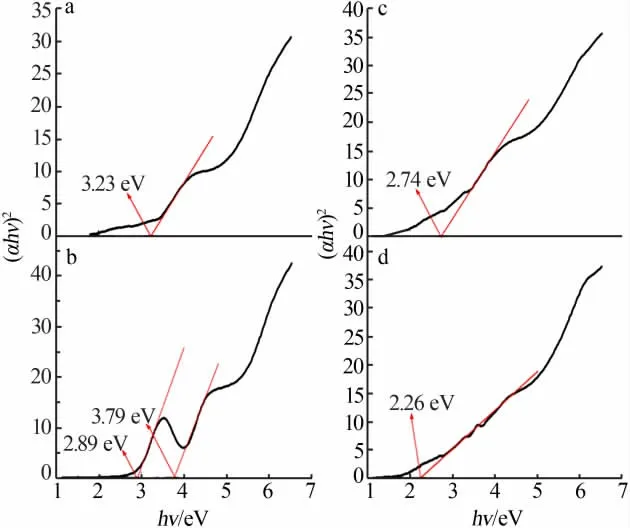
图5 样品S1(a)、S2(b)、S3(c)和S4(d)的(αhν)2-hν曲线图Fig.5 (αhν)2-hνcurves of samplesS1(a),S2(b),S3(c)andS4(d)
2.4 光催化活性分析
为了研究样品S1、S2、S3和S4的光催化活性,选用难以在自然环境条件降解的罗丹明B作为降解染料。图6a是样品S1、S2、S3和S4在紫外光照下的光催化活性图。染料初始质量浓度为5 mg/L,催化剂含量为10 mg/L,反应溶液的初始pH为7。空白实验表明,罗丹明B染料在没有光催化剂存在的情况下进行紫外光照180 min,几乎没有降解,表明它是一种稳定的、难以降解的有机分子染料。在光催化实验正式开始前,在暗室中吸附30 min,使染料与光催化剂充分吸附。由图6a可知,样品S1、S2、S3和S4的吸附速率由大到小顺序为S1、S2、S4、S3。光照后,随着光照时间的增加,光催化降解速率不断增强。样品S1、S2、S3和S4的光催化降解速率由小到大顺序为S1、S2、S4、S3。可见,在本实验中吸附速率与光催化降解速率是相反的。此外,样品S1、S2、S3和S4的光催化降解速率与它们的紫外光吸收能力相似。
一般认为,计算光催化活性曲线的一级动力学关系,可进一步直观地洞察样品S1、S2、S3和S4的光催化降解能力。一级动力学曲线反映的是ln(Ct/C0)—t之间的关系曲线,这里t是光催化降解时间,C0和Ct是光照前与光照一段时间t后的染料的浓度。样品S1、S2、S3和S4的一级动力学曲线见图6b。从图6b可以看出,样品S1、S2、S3和S4的一级动力学常数k分别为0.006 2、0.008 2、0.015 3、0.009 5 min-1。可见,将5%BaSO4与BaFe2O4复合后,5%BaSO4/BaFe2O4复合物光催化剂的降解速率是单相BaSO4降解速率的2.47倍,是单相BaFe2O4降解速率的1.87倍。
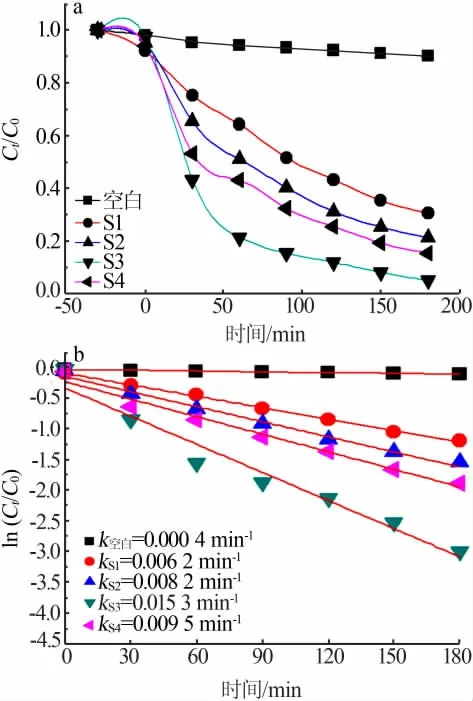
图6 样品S1、S2、S3和S4在紫外光照下的光催化活性(a)和一级动力学曲线(b)Fig.6 Photo-catalytic activity(a)and first-order kinetic curve of samples S1,S2,S3 and S4 under UV light irradiation(b)
图7a是样品S1、S2、S3和S4在模拟太阳光照下的光催化活性曲线图。同样,在仅有染料的情况下进行模拟太阳光照考察罗丹明B的降解行为发现罗丹明B很难降解,进一步说明在模拟太阳光辐照下罗丹明B也是非常稳定、难以降解的。光照后,样品S1、S2、S3和S4的光催化降解速率由小到大顺序 为S2、S1、S4、S3,与 可 见 光 光 吸 收 系 数 的 变 化趋势一致。图7b是样品S1、S2、S3和S4在模拟太阳光照下的一级动力学曲线。样品S1、S2、S3和S4的一级动力学常数分别为0.003 9、0.002 7、0.009 0、0.004 6 min-1。可见,将5%BaSO4与BaFe2O4复合后,5%BaSO4/BaFe2O4复合物光催化剂的模拟太阳光光催化降解速率是单相BaSO4降解速率的2.31倍,是单相BaFe2O4降解速率的3.33倍。
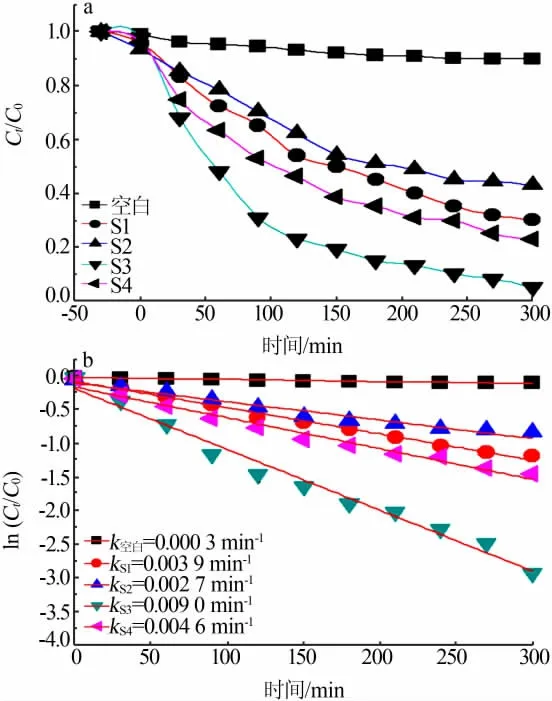
图7 样品S1、S2、S3和S4在模拟太阳光照下的光催化活性(a)和一级动力学曲线(b)Fig.7 Photo-catalytic activity(a)and first order dynamics curve(b)of samples S1,S2,S3 and S4 under simulated solar illumination
光催化剂可循环使用是评价其光催化活性好坏的重要指标,图8是样品S3在模拟太阳光光照条件下的光催化循环稳定实验。在每次循环完成之后,需将降解染料中的光催化剂进行离心、过滤、干燥等过程处理,再进行下一次循环实验。经过4次循环实验后,样品S3的降解速率仅下降了7%左右,表明该光催化剂可以重复多次使用,具有循环稳定性,是一种潜在的可见光光催化剂。
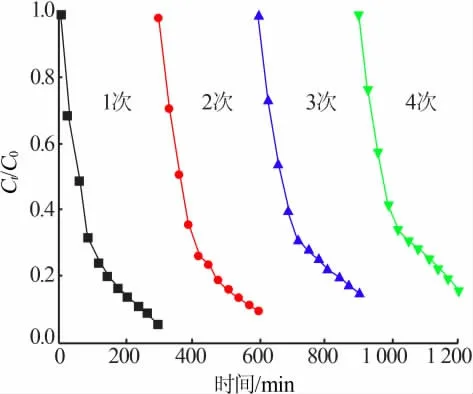
图8 样品S3的光催化循环稳定实验Fig.8 Photo-catalytic cycle stability experiment of sample S3
2.5 光催化机理
为了更好地理解BaFe2O4/BaSO4复合光催化剂的光催化机理,可通过公式(2)和(3)计算BaFe2O4和BaSO4的导带电位(ECB)和价带电位(EVB)。

式中,Ee=4.5 eV,X代表半导体氧化物的电负性。根据公式(4)和(5),可获得BaFe2O4和BaSO4的电负性分别为5.36、6.03 eV。

查阅元素的电负性表可知,X(Ba)=2.40 eV、X(Fe)=4.06 eV、X(S)=6.22 eV和X(O)=7.54 eV。经计算,BaFe2O4的ECB和EVB分别为-0.59、2.30 eV。BaSO4的ECB和EVB分别为-0.09、3.14 eV。根据计算的BaFe2O4和BaSO4的ECB和EVB,可画出它们的能级图,如图9所示。当模拟太阳光照射到BaFe2O4/BaSO4复合光催化剂表面时,BaFe2O4和BaSO4均会吸收太阳光,进而激发各自价带的电子跃迁到导带,在各自的价带留下一个空的状态,将这一空的状态叫做空穴。由于BaSO4的价带能级比BaFe2O4更正,因此BaSO4价带上的空穴将进一步进入BaFe2O4的价带。由于H2O/·OH和OH-/·OH的氧化还原电位分别为+2.72、+1.89 V[17],因此,在BaFe2O4和BaSO4的价带会发生式(6)和(7)的反应生成羟基自由基(·OH)。
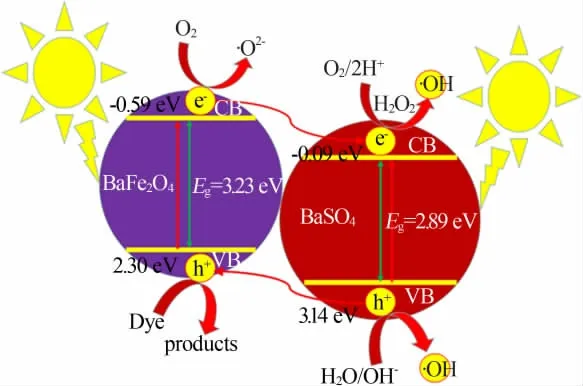
图9 BaFe2O4/BaSO4复合光催化剂的光催化机理Fig.9 Photocatalytic mechanism of BaFe2O4/BaSO4 composite photocatalyst
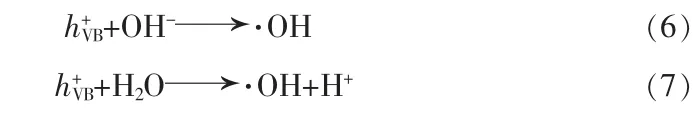
此外,部分空穴将会直接与罗丹明B染料发生反应,生成无毒无害的降解产物。
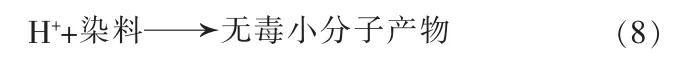
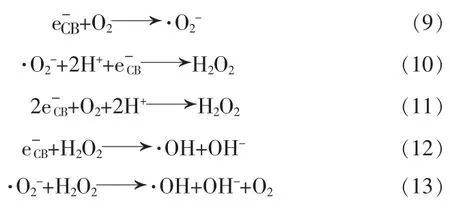
被激发到导带的电子,由于BaFe2O4的导带能级比BaSO4更负,将转移到BaSO4的导带。由于的氧化还原电位是-0.13 V[18],将会发生式(9)~(13)的反应,生成羟基自由基。
价带和导带上的空穴或电子经一系列反应后生成的羟基自由基,都将与染料发生反应,生成无毒的小分子产物。
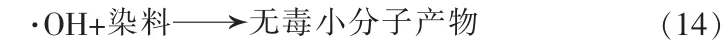
由此可见,羟基自由基、超氧自由基和空穴在整个光催化反应过程中扮演了关键的角色。
3 结论
采用化学法和传统的溶胶凝胶法以柠檬酸作为络合剂合成了BaSO4和BaFe2O4光催化剂。结合研磨和低温烧结技术合成了5%BaSO4/BaFe2O4和10%BaSO4/BaFe2O4复合物光催化剂。XRD结果表明,BaSO4/BaFe2O4复合物光催化剂除了BaSO4和BaFe2O4的XRD衍射峰外,不含其他任何杂质。结合FTIR光谱,进一步对BaSO4、BaFe2O4、5%BaSO4/BaFe2O4和10%BaSO4/BaFe2O4复合物光催化剂的官能团进行了 表 征。发 光 性 质 分 析 发 现,BaSO4、BaFe2O4、5%BaSO4/BaFe2O4和10%BaSO4/BaFe2O4复合物光催化剂的Eg值分别为3.23、2.89、2.74、2.26 eV。光催化实验表明,5%BaSO4/BaFe2O4复合物光催化剂在降解罗丹明B方面展示了最高的光催化活性和循环稳定性。光催化机理分析确认了羟基自由基、超氧自由基和空穴在光催化反应过程中扮演了关键的角色。

