碱法回收湿法磷酸萃余渣中五氧化二磷的研究
张耀滔,李 军,陈 明,郑卓超
(四川大学化学工程学院,四川成都610065)
磷酸是一种重要的化工原料,其生产方法主要分为热法和湿法。热法磷酸产品纯度高,但是生产过程中能耗高,环境污染严重;湿法磷酸的生产具有设备投资少、能耗低的特点[1]。与热法磷酸相比,湿法制得的磷酸产品纯度低,杂质含量高且复杂,因此,湿法磷酸必须经过净化处理,才能作为生产磷酸盐产品的原料。目前,湿法磷酸的净化方法主要有溶剂萃取法、化学沉淀法、离子沉淀法、溶剂沉淀法、结晶法、物理吸附法等[2-5]。其中,溶剂萃取法净化湿法磷酸具有产品纯度高、生产能力高、分离效果好、萃取剂可循环利用、生产过程易于实现自动化和连续化等特点[6],因此,溶剂萃取法已成为最有效的湿法磷酸净化方法。在溶剂萃取法净化湿法磷酸的过程中,湿法磷酸中大量的P2O5和少量的杂质金属离子会进入萃取相中,随着水相中P2O5浓度降低,杂质金属离子(如Fe3+、Mg2+、Al3+、Ca2+等)在水相中的溶解度也随之降低,大量杂质金属离子会以磷酸盐或酸式磷酸盐的形式从水相中析出,形成萃余渣。萃余渣主要成分为难溶性磷酸盐,如果不对这部分P2O5进行有效的回收利用,不仅会造成磷资源的损失,而且大量的萃余渣囤放在开放空间中,由于金属离子和其他有毒离子的浸出,还会造成环境污染。
目前,国内关于萃余渣的研究较少,在化肥工业上通常将湿法磷酸的含磷渣用于复合磷肥的生产[7-8]。胡国涛等[9]以生产湿法磷酸过程中产生的磷酸淤渣为原料,与稀磷酸进行调浆后与磷矿浮选尾矿和碳酸钙粉反应生产出高质量的特种高镁普钙,解决了磷酸淤渣的后续处理和磷资源利用问题;李英翔等[10]以湿法磷酸生产及净化过程中副产的磷渣为原料生产出水溶性好、符合市场标准的高效复合肥硝基磷酸铵镁。但是由于中国磷矿石加工主要以磷肥和初级磷酸盐产品为主,磷肥初级产品产能过剩[11],利用萃余渣生产复合磷肥已不是回收萃余渣中磷资源的最佳选择。
本文运用溶度积理论,根据铁、镁、铝、钙的氢氧化物溶度积比其磷酸盐溶度积小的特点,利用氢氧化钠与萃余渣反应进行沉淀转化,将金属离子转化为对应的氢氧化物,从而使萃余渣中大部分P2O5进入反应液中,反应液作为生产磷酸三钠的原料处理。该工艺过程简单且易于控制,磷资源的回收率可达90%以上,反应液后续可作为生产磷酸三钠的原料,实现萃余渣中五氧化二磷的回收及利用。
1 实验部分
1.1 原料来源与组成
湿法磷酸萃余渣,来自于利用溶剂萃取法对湿法磷酸萃取净化时产生的含磷固渣,萃余渣主要成分见表1。氢氧化钠、硝酸,均为AR;喹钼柠酮,自制;去离子水(二级水),自制。
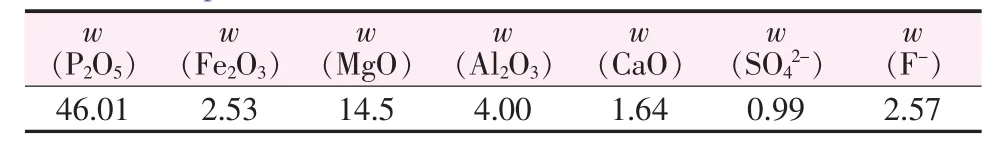
表1 萃余渣的主要成分Table 1 Compositions of the wet process phosahoric acid extraction residue %
1.2 实验设备
101A-2E电热鼓风干燥箱、DK-S24电热恒温水浴锅、BSA224S电子天平、G4玻璃砂芯坩埚、SHZ-95B循环水式真空泵、S312变频调速电动搅拌器。
1.3 实验方法
1.3.1 萃余渣的预处理
萃余渣为白色粉末状固体,使用前置于烘箱中于120℃下干燥至恒重,取出放于干燥器中备用。
1.3.2 萃余渣的碱解工艺
萃余渣经预处理后,称取10 g萃余渣,将萃余渣加入到正在搅拌的氢氧化钠溶液中,反应完成后将固渣与反应液过滤分离,回收含有大量P2O5的反应液作为后续生产磷酸三钠的原料。
1.3.3 实验操作
在500 mL塑料烧杯中按照不同的液固比与NaOH的量配制相应浓度的NaOH溶液,放置于预先设置好温度的水浴锅中并以450 r/min进行搅拌;称取10 g萃余渣样品,缓缓加入到正在搅拌的氢氧化钠溶液中,加料完毕后开始计时。达到预计时间后将反应液与固渣进行过滤分离,称取反应液的质量,测量反应液中P2O5浓度,从而计算出反应液中P2O5的总量,并进一步计算出碱解过程中P2O5回收率。
1)单因素实验。采用单因素实验的方法来考察液固比、n(Na2O)/n(P2O5)、反应温度、反应时间对萃余渣中P2O5的回收效果的影响,从而为后续选定合适的反应条件范围提供依据。
2)二次回归正交实验设计[12]。采用三因素二次回归正交实验设计方法来考察n(Na2O)/n(P2O5)、反应温度、反应时间对萃余渣中P2O5回收效果的影响,并选择出最佳工艺条件。三因素水平编码表见表2。
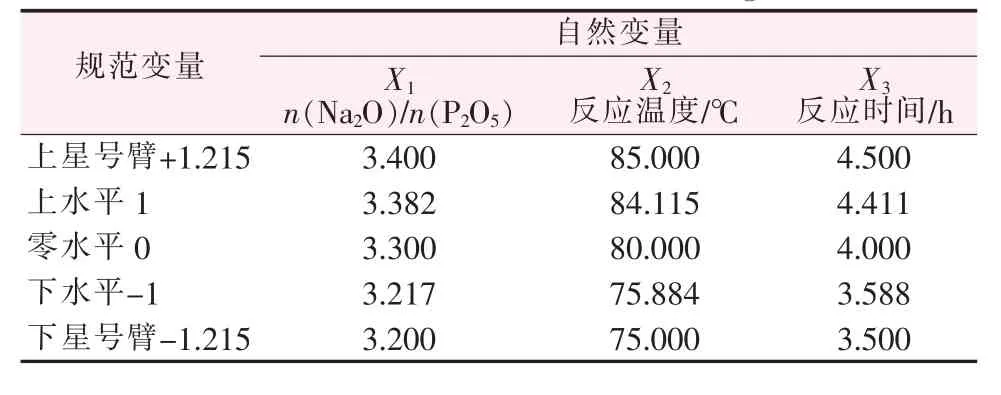
表2 三因素水平编码表Table 2 Three factors level coding
根据最小二乘法原理设计三元二次回归正交组合实验方案,3个因素X1、X2、X3与实验指标y的三元二次回归方程为:

式中:a0为常数项;aj(j=1,2,3)为一次项回归系数;aij(i=1,2,3;j=1,2,3;i≤j)为二次项回归系数;y为P2O5的回收率。
1.3.4 实验分析及计算方法
P2O5的含量采用磷钼酸喹啉重量法[11]测定,反应液中P2O5的总量按下式计算:

式中: ω(P2O5)为反应液中P2O5的质量分数;η(P2O5)为P2O5的回收率;m0为测定时所取试样的质量,g;m1为磷钼酸喹啉沉淀质量,g;m2为空白试样所得磷钼酸喹啉沉淀质量,g;m3为碱解反应结束过滤沉淀后所得反应液的质量,g;m4为进行碱解反应的萃余渣中P2O5的总量,g;0.032 07为磷钼酸喹啉质量换算为五氧化二磷质量的系数。
2 实验结果与讨论
2.1 碱解萃余渣回收P2O5的反应原理
萃余渣中主要成分是铁、镁、铝、钙的磷酸盐及可溶性磷酸盐等,总P2O5质量分数可达46%,非水溶性的P2O5通过与氢氧化钠溶液反应得到可溶性的磷酸三钠和不溶性氢氧化物,同时水溶性的P2O5也溶解在磷酸三钠溶液中,从而使P2O5得到回收。
在用氢氧化钠处理萃余渣的过程中,主要发生的化学反应式如下:

以上反应能否进行及完成是由反应条件和溶度积大小所决定的,由于铁、铝的磷酸盐溶度积远远大于它们的氢氧化物溶度积(见表3),磷酸氢镁在强碱性环境下能逐渐转化成磷酸三钠和氢氧化镁,因此,在萃余渣与氢氧化钠反应过程中渣中大部分的P2O5转入到水溶液中,形成生产磷酸三钠的原料。部分磷酸氢镁在反应过程中会因为氢氧化钠局部过浓而生成溶度积很小的磷酸镁,磷酸镁很难再与氢氧化钠反应[14],造成P2O5回收率的下降。
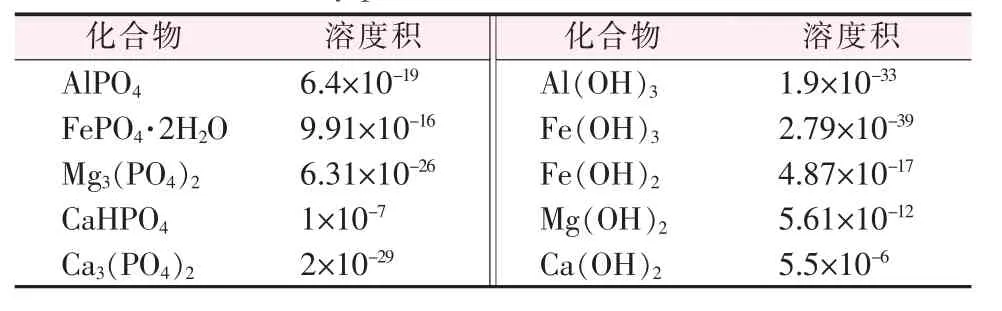
表3 有关物质的溶度积常数Table 3 Solubility product constant of related substances
2.2 单因素实验结果及分析
2.2.1 液固比对P2O5回收率的影响
10 g经预处理后的萃余渣在反应温度为90℃、反应时间为4 h、n(Na2O)/n(P2O5)为3.4条件下与氢氧化钠反应,水相中P2O5的回收率随液固比变化的关系图见图1。由图1可见,当液固比较低时,随着液固比的增大,水相中P2O5的回收率增大,并且在液固比为30 mL/g左右时达到最大值,但当液固比大于30 mL/g时,水相中P2O5的回收率随着液固比的增大而减小,这是由于液固比的增大使得反应环境中氢氧化钠浓度降低,反应过程中碱度不够,磷酸盐不能完全与氢氧化钠反应,造成水相中P2O5回收率的降低,证明反应环境中的氢氧化钠存在一个最优浓度,故选择液固比为30 mL/g左右为宜。
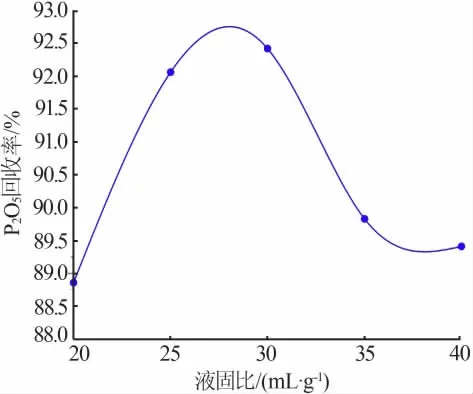
图1 液固比与P2O5回收率关系图Fig.1 Effect of liquid-solid ratio on the recovery ratio of P2O5
2.2.2 反应时间对P2O5回收率的影响
10 g经预处理后的萃余渣在反应温度为90℃、n(Na2O)/n(P2O5)为3.4、液固比为30 mL/g条件下与氢氧化钠反应,水相中P2O5的回收率随反应时间变化的关系图见图2。

图2 反应时间与P2O5回收率关系图Fig.2 Effect of reaction time on the recovery ratio of P2O5
随着反应时间的增加,萃余渣中MgHPO4(萃余渣XRD图见图3)逐渐与氢氧化钠反应生成复杂的氢氧化物沉淀(反应碱渣XRD图见图4),并在反应时间为4 h左右趋于完全,此时水相中P2O5回收率达到最大值。达到P2O5回收率最大值后,随着反应的继续进行,萃余渣中少部分MgHPO4在碱性条件下逐步转化为Mg3(PO4)2[14],此时MgHPO4的溶解平衡向左移动,同时反应时间过长,水相中部分P2O5被碱渣吸附,造成水相中P2O5回收率的下降,并在反应时间为5.5 h时趋于稳定,而Mg3(PO4)2再难以与氢氧化钠反应,只能随着碱渣一起过滤出去,造成P2O5的损失。因此,反应时间选择4 h左右为宜。

图3 湿法磷酸萃余渣XRD图Fig.3 XRD pattern of wet-process phosphoric acid extraction residue
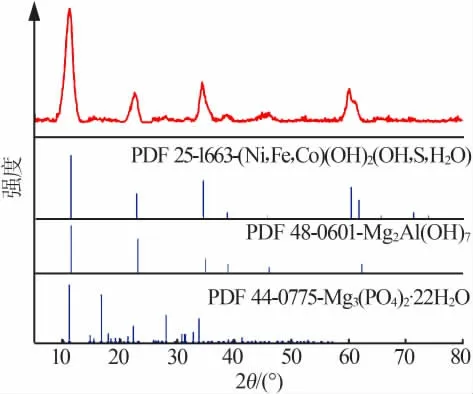
图4 反应碱渣XRD图Fig.4 XRD pattern of reaction filter residue
2.2.3 反应温度对P2O5回收率的影响
10 g经预处理后的萃余渣在反应时间为4 h、n(Na2O)/n(P2O5)为3.4、液固比为30 mL/g条件下与氢氧化钠反应,水相中P2O5的回收率随反应温度变化的关系图见图5。由图5可以看出,反应温度升高,水相中P2O5回收率先增加后趋于稳定。在OH-的作用下,PO43-与杂质金属之间的化学键不断被破坏,萃余渣中难溶性磷酸盐的磷以PO43-形式存在于水相中,随着反应温度的升高,反应物活化分子数量增加,加快了反应速率,水相中P2O5的回收率不断提高,并在反应温度为80℃后趋于稳定。因此,反应温度选择80℃左右为适。

图5 反应温度与P2O5回收率关系图Fig.5 Effect of reaction temperature on the recovery ratio of P2O5
2.2.4n(Na2O)/n(P2O5)对P2O5回收率的影响
根据反应式(7)可知氢氧化钠刚好与萃余渣中P2O5完全反应时,n(Na2O)/n(P2O5)为3,考察按恰好完全反应时n(Na2O)/n(P2O5)的比例添加氢氧化钠进行反应和添加适当过量氢氧化钠对水相中P2O5回收率的影响。
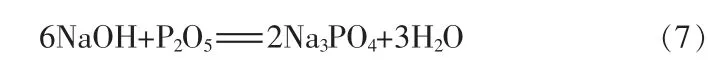
10 g经预处理后的萃余渣在反应温度为90℃、反应时间为4 h、液固比为30 mL/g条件下与氢氧化钠反应,水相中P2O5的回收率随n(Na2O)/n(P2O5)变化的关系图见图6。

图6 n(Na2O)/n(P2O5)与P2O5回收率关系图Fig.6 Effect of n(Na2O)/n(P2O5)on the recovery ratio of P2O5
在氢氧化钠用量增加的情况下,由于反应环境中氢氧化钠浓度的增加,萃余渣中磷酸盐与氢氧化钠的反应就愈加完全,更多的难溶性磷酸盐中的P2O5进入到水相中,水相中P2O5的回收率随之提高,但氢氧化钠用量过多同时会使得反应液中pH过高,对磷酸三钠的结晶产品有影响[15],因此n(Na2O)/n(P2O5)控制在3.3左右为宜。
2.3 二次回归正交实验结果与分析
2.3.1 选择适宜的因素范围
根据之前4组单因素实验结果,确定了二次回归正交实验中各因素水平的范围,并采用三因素二次回归正交实验设计方法来考察n(Na2O)/n(P2O5)、反应温度、反应时间对萃余渣中P2O5回收效果的影响,在n(Na2O)/n(P2O5)=3.2~3.4、反应温度为75~85℃、反应时间为3.5~4.5 h内进行正交实验,三因素水平的编码表见表2。
2.3.2 数学模型的建立
基于4组单因素实验,并根据最小二乘法原理设计萃余渣P2O5回收工艺参数三元二次回归正交组合实验方案及结果、回归分析表(见表4、表5)。
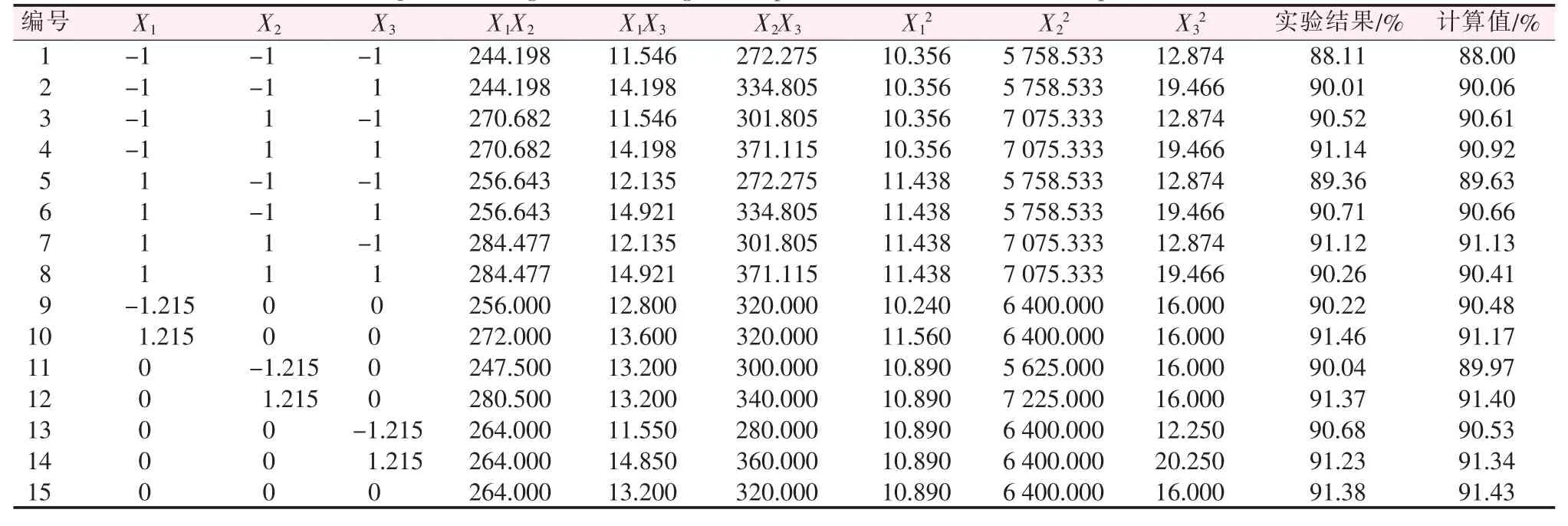
表4 二次回归正交实验组合及实验结果Table 4 Quadratic regression orthogonal experiment combination and experimental results
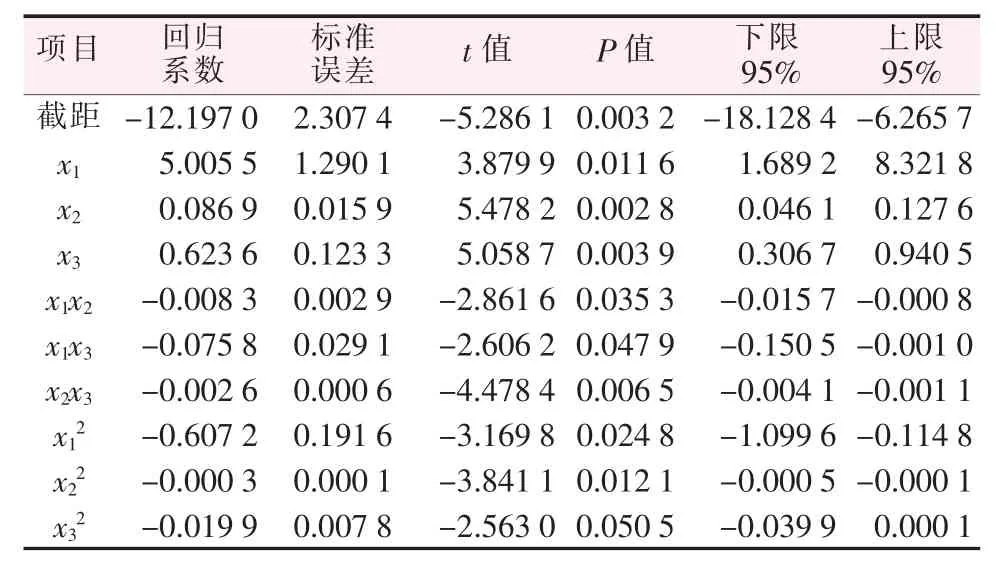
表5 回归分析表Table 5 Regression analysis
对以上15组正交实验进行回归分析(见表5),通过拟合二次回归正交实验数据得到回归方程:

方程中各项的系数与回归分析结果中的偏回归系数是对应的,并由其对应的t值可得出因素主次顺序依次为x2、x3、x2x3、x1、x1x2、x1x3,即反应温度、反应时间、因素2与因素3的交互作用、n(Na2O)/n(P2O5)、因素1与因素2的交互作用、因素1与因素3的交互作用。
2.3.3 二次回归模型的显著性检验
1)偏回归系数的显著性检验。由表5中各偏回归系数所对应的P值得知,偏回归系数x2、x3、x2x3对应的P值<0.01,偏回归系数x1、x1x2、x1x3对应P值在0.01与0.05之间,所以因素x2、因素x3和两者的交互作用对实验结果有非常显著的影响,因素x1、因素x1和因素x2的交互作用、因素x1和因素x3的交互作用也对实验结果有显著的影响。
2)F检验。对回归方程的方差分析结果见表6,由于F值=16.211 5,显著性<0.01,所以建立的回归方程模型非常显著。
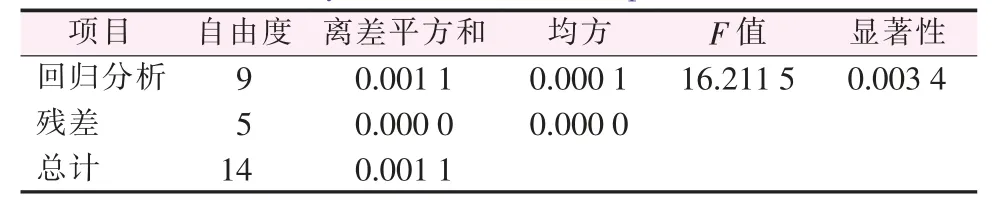
表6 实验结果方差分析表Table 6 Analysis of variance of experimental results
3)复相关系数检验。根据回归统计结果(见表7)可知复相关系数R=0.983,决定系数R2=0.967,说明实验结果与各因素之间有很好的相关性,所建立的回归方程非常显著。

表7 实验结果回归统计表Table 7 Regression statistics of experimental results
2.3.4 结果检验
根据建立的回归方程,为了求得水相中P2O5回收率的最大值,使y分别对x1、x2、x3的偏导为0,求得x1=3.31、x2=82、x3=4.05,即n(Na2O)/n(P2O5)为3.31、反应温度为82℃、反应时间为4.05 h,此时实验指标(P2O5回收率)达到最大值,取各因素极值条件进行实验,得到水相中P2O5回收率为92.48%。当其他两个因素均取极值条件时,水相中P2O5回收率随着第三个因素的变化而变化。其他两个因素均取极值条件时n(Na2O)/n(P2O5)、反应温度、反应时间对水相中P2O5回收率影响见图7、图8、图9。

图8 反应时间与P2O5回收率效应分析曲线图Fig.8 Effect analysis curve of reaction time and P2O5 recovery ratio

图9 n(Na2O)/n(P2O5)与P2O5回收率关系图Fig.9 Effect analysis curve of n(Na2O)/n(P2O5)and P2O5 recovery ratio
通过二次回归正交实验得出的回归方程计算出的最优反应条件为:n(Na2O)/n(P2O5)=3.31、反应时间为4.05 h、反应温度为82℃,与之前单因素实验得出的最优条件基本相同,并且在其余两个因素均取极值情况下,P2O5回收率随第三种因素变化的趋势也与之前单因素分析的结果相吻合,在最优反应条件下P2O5回收率为92.48%,与方程模拟计算值91.62%相接近,说明通过二次回归正交实验结果拟合出来的回归方程模型对于计算碱解萃余渣的五氧化二磷收率是适用的。
3 结论
在氢氧化钠碱解萃余渣回收其中P2O5的过程中,基于单因素实验结果选择出三元二次回归正交实验中各因素的参数范围,根据二次回归正交实验的结果和分析得出的三元二次回归方程为:y=-12.197 0+5.005x1+0.086 9x2+0.623 6x3-0.008 3x1x2-0.075 8x1x3-0.002 6x2x3-0.607 2x12-0.000 3x22-0.019 9x32,复相关系数R=0.983。分别对方程各个因素求偏导得出最优工艺条件:n(Na2O)/n(P2O5)=3.31,反应温度为82℃,反应时间为4.05 h。在最优工艺条件下水相中P2O5的回收率达到92.48%,说明本实验建立的三元二次回归正交模型对于碱法回收萃余渣中难溶性P2O5工艺是可行的。本实验成功地将萃余渣中难溶性磷酸盐转化为其氢氧化物沉淀,萃余渣中大部分的P2O5进入到碱解反应液中,反应液可作为制作磷酸三钠的原料,使萃余渣中P2O5得到回收利用,实验结果为该工艺的实际运用提供了指导,对萃余渣利用和环境保护具有重要意义。

