离子色谱法测定废旧锂电池湿法浸出液中氟和氯
谢堂锋,陈若葵,蔡罗蓉,王 明,蒋快良
(湖南邦普循环科技有限公司,湖南长沙410600)
近年来,随着新能源电动汽车产业及锂离子电池的爆发式增长,锂离子电池报废量也在逐年上升。废旧锂电池含有大量的重金属及含酸、碱等电解质溶液,同时还含有六氟磷酸锂、有机碳酸酯等有毒有害物质,必然对环境及生态系统构成潜在的污染威胁。废旧电池资源化、无害化的回收处理越来越重要。氟和氯在废旧锂电池的湿法浸出过程中不仅会对相关生产设备及管道造成腐蚀,还会对周边环境及人体造成极大的危害,因此,准确测定和控制废旧锂电池回收浸出体系中的氟、氯含量对该行业生产中的氟、氯去除工艺优化、质量控制具有重要意义。
目前,测定氟和氯的主要方法有电位滴定法[1]、离子选择电极法[2]、离子色谱法[3-4]等,离子色谱法相对前两种测定方法具有灵敏度高、选择性好、线性范围宽、操作简便等诸多优点,但对于复杂基体样品,需要进行相应的前处理以消除复杂基质干扰和富集待测组分,避免杂质干扰物对检测背景信号的影响及对离子色谱柱的污染[5]。水蒸气蒸馏法是样品前处理的有效手段,已广泛应用于地质、冶金、食品等领域中氟和氯的测定[6-8],但应用于废旧锂离子电池回收浸出体系氟化物和氯化物的测定尚未有报道。笔者采用水蒸气蒸馏法将废旧锂电池湿法浸出体系中氟和氯离子以气体形式快速蒸出,经碱液吸收后采用离子色谱法进行测定,将待测F-、Cl-与基体及其他共存元素完全分离,极大地减少了背景峰的干扰,实验结果稳定可靠,符合实际分析检测工作的要求。
1 实验部分
1.1 主要仪器与装置
Dion Aquion型离子色谱仪,包括AS-DV自动进样器、电导检测器和RFC自动淋洗液发生器;AS23型阴离子分析柱(4 mm×250 mm);AG23型阴离子保护柱(4 mm×50 mm);0.22μm微孔水系滤膜;5.0 mL一次性注射器;水蒸气蒸馏装置,如图1所示;数控电热套。
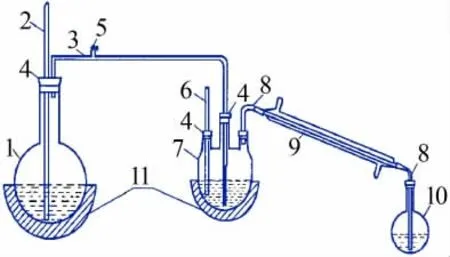
图1 水蒸气蒸馏装置示意图Fig.1 Schematic diagram of steam distillation device
1.2 主要试剂
NaOH溶液:0.01 mol/L;H2SO4(2+1):量取200 mL浓硫酸(ρ=1.84 g/mL)缓慢加入100 mL水中,混匀;淋 洗 母 液(45 mmol/L Na2CO3-10 mmol/L NaHCO3),稀释10倍后作为淋洗液使用;F-、Cl-标准储备溶液(1 000μg/mL);F-、Cl-混合标准溶液(100μg/mL):分别准确移取10.00 mL F-、Cl-标准储备溶液于100 mL容量瓶中,以水定容,混匀;所用试剂均为优级纯,水均为电阻率为18.2 MΩ·cm的超纯水。
1.3 色谱条件
淋洗液:4.5 mmol/L Na2CO3-1.0 mmol/L NaHCO3溶液;流速为1.0 mL/min;抑制器电流为25 mA;柱温为30℃;进样量为25μL。
1.4 样品主要成分
本实验针对湖南邦普循环科技有限公司某实验过程中废旧锂电池湿法浸出液进行测定,除氟和氯之外的其他主要化学成分分析结果见表1。

表1 废旧锂电池浸出液主要化学组成Table 1 Main chemical composition of waste lithium battery leaching solution g/L
1.5 实验方法
1.5.1 水蒸气蒸馏
取适量超纯水置于水蒸气蒸馏装置中的蒸馏瓶中,加热至沸腾,备用。准确量取10.00 mL待测湿法液置于250 mL三口圆底烧瓶中,加入60 mL H2SO4(2+1)溶液并放入少量沸石,移取10.00 mL 0.01 mol/L NaOH溶液至接收瓶中作为吸收液。打开数控电热套将三口圆底烧瓶溶液加热至160~180℃,连接蒸馏装置进行蒸馏,并控制水蒸气流量使馏出液的馏出速度为2~3 mL/min,蒸馏时间控制在20~25 min,当馏出液至80 mL左右时,取下接收瓶并定容至100 mL容量瓶,混匀待测。
1.5.2 样品测定
用5.0 mL注射器吸取待测液经0.22μm微孔滤膜过滤后注入色谱进样管中,在相同工作条件下,依次用离子色谱仪进行测试,得到谱图。根据氟和氯的保留时间定性,依据峰面积及标准曲线计算氟和氯的质量浓度,随同试样做空白试验。试液中氟和氯的响应值应在校准曲线线性范围内,如果超出线性范围,则应将试液进行适当稀释后再进行测定。
2 结果与讨论
2.1 蒸馏剂及其浓度的选择
水蒸气蒸馏法的原理主要是利用高沸点酸将样品中的氟和氯转换成低沸点酸蒸出。常选用硫酸和磷酸作为蒸馏剂,硫酸介质的沸点高于磷酸,不易被蒸出,更有利于氟化氢和氯化氢的形成与挥发,而磷酸在蒸馏温度过高或加热时间长的情况下会析出焦磷酸盐难溶物,或生成聚硅磷酸黏结于器皿底部,同时对玻璃造成严重腐蚀[9]。因此本实验选择硫酸作蒸馏剂。
根据实验方法对不同硫酸浓度进行试验,控制蒸馏时间为25 min,吸收液中氟和氯的浓度变化曲线如图2所示。由图2可知,当硫酸浓度较高时,高浓度的硫酸具有强吸水性,不利于氟化氢和氯化氢的释放,同时还会在高温下蒸出大量SO42-,吸收液中过高的SO42-峰会对待测F-和Cl-峰形成压制,不利于待测离子峰的积分和判别;当硫酸浓度较低时,溶液沸点降低,造成蒸馏温度不足,不利于F-和Cl-的馏出[10]。实验发现,选用硫酸(2+1)作为蒸馏剂时,能获得较好的实验效果。
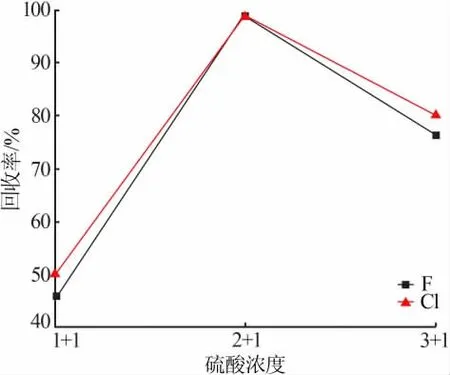
图2 硫酸浓度对氟和氯回收率的影响Fig.2 Effect of sulfuric acid concentration on the recovery rate of fluorine and chlorine
2.2 蒸馏温度的选择
根据实验方法对不同蒸馏温度进行试验,控制蒸馏时间为25 min,吸收液中氟和氯的浓度变化曲线如图3所示。

图3 蒸馏温度对氟和氯回收率的影响Fig.3 Effect of distillation temperature on the recovery rate of fluorine and chlorine
由图3可知,随着蒸馏反应温度的升高,吸收液中氟和氯的蒸出量先增高后降低,当蒸馏反应温度控制在160~180℃时,达到最大值并趋于稳定。这是由于当蒸馏温度过高时,硫酸加剧分解,大量SO42-被吸收液吸收,同时待测液本底电导增大,大幅延长硫酸根从阴离子柱洗脱的时间,不利于样品的测定及设备的保养;当蒸馏温度过低时,样品中氟和氯离子的释放被抑制[11]。
2.3 蒸馏时间的选择
根据实验方法对不同蒸馏时间进行试验,控制蒸馏温度为160~180℃,结果如图4所示。由图4可知,当蒸馏时间控制在25~30 min时,吸收液中氟和氯离子的蒸出量达到最大值并趋于稳定,此时吸收液体积约为100 mL。故选择蒸馏时间为25 min。

图4 蒸馏时间对氟和氯回收率的影响Fig.4 Effect of distillation time on the recovery rate of fluorine and chlorine
2.4 水负峰的消除
由于样品浸出液电导小于经抑制后淋洗液的本底电导,在离子色谱分析获得的色谱图中,F-和Cl-峰之间通常出现一个较大的水负峰,而F-峰与水负峰的保留时间相近,由于水负峰的干扰,不能准确测定F-含量[12]。因此,本实验通过在接收液中加入相应的淋洗液,稳定待测组分,且使待测液的本底电导值与淋洗液相一致来消除F-和Cl-峰之间可能出现的水负峰对待测氟离子定量的影响。
2.5 标准曲线及方法检出限
分别移取0.00、0.10、0.50、1.00、2.00、5.00、10.00 mL F-、Cl-混合标准溶液置于100 mL聚乙烯容量瓶中,用淋洗液稀释至刻度配成F-、Cl-混合标准溶液系列,按浓度由低到高依次用离子色谱仪测定,记录系列标准溶液的色谱图。以氟标准溶液的质量浓度(mg/L)为横坐标,离子色谱峰面积(或峰高)为纵坐标绘制标准曲线,并计算线性回归方程。结果表明,F-和Cl-质量浓度在0.1~10 mg/L范围内与其对应的峰面积呈良好的线性关系,所得线性回归方程分别为y(F-)=0.218 9x-0.013 5和y(Cl-)=0.130 3x+0.012 3,线性相关系数分别为0.999 8和0.999 6。按实验方法连续10次测定样品空白吸收液中的氟离子和氯离子,根据3倍标准偏差计算出氟离子和氯离子的检出限分别为0.010 mg/L和0.022 mg/L。
3 精密度与加标回收实验
3.1 合成样品
根据本实验废旧锂电池湿法浸出液的主要成分测定结果,采用分析纯试剂、F-和Cl-的标准工作溶液配制合成湿法浸出液样品,控制合成浸出液样品中F-和Cl-的质量浓度分别为32.00 mg/L和350.00 mg/L。按照实验方法对合成湿法浸出液进行蒸馏前处理后测定,F-和Cl-的测定平均值分别为31.46 mg/L和344.72 mg/L,与合成样品参考值吻合较好,10次平行测定结果的相对标准偏差(RSD)分别为2.9%和3.7%,如表2所示。

表2 合成样中氟和氯的测定结果Table 2 Result of test of fluorine and chlorine in synthetic samples
3.2 实际样品
按照实验方法,对实际废旧锂电池湿法浸出液样品进行蒸馏后测定,并加入氟离子和氯离子混合标准溶液进行加标回收实验,结果见表3。

表3 加标回收实验结果Table 3 Result of test for recovery
结果表明,该方法分析废旧电池湿法浸出液中氟和氯的加标回收率分别为95.47%和96.29%,能满足测定要求。
4 结语
使用水蒸气蒸馏-离子色谱法测定废旧锂电池湿法浸出液中的氟和氯含量,排除浸出液中各种金属离子和有机物对测定的干扰,加标回收率分别为95.47%和96.29%,相对标准偏差(RSD,n=10)分别为2.9%和3.7%,方法准确度和精密度较好,满足了检测分析的需要。

