屎肠球菌R2培养条件优化及酸浆发酵剂的制备
陈志娜,沈业桥,叶韬,黄琳
(1.淮南师范学院生物工程学院,安徽 淮南 232038;2.资源与环境生物技术安徽普通高校重点实验室,安徽 淮南 232038)
屎肠球菌(Enterococcus faecium)属于乳酸菌的一种,因为在代谢过程中产生乙酸和乳酸,能够降低肠道内的pH值,可以维持和调节动物肠道菌群生态平衡[1],特别是在幼龄动物肠道保健和疾病的防疫以及治疗上有突出表现。屎肠球菌广泛存在于传统乳制品[2-4]、泡菜[5]、豆酱[6]、香肠[7]等发酵食品中,可以影响食品的香气、风味、质地,还能产生多种有益成分[8]。课题组前期从泡菜中筛选出一株可用于酸浆发酵的屎肠球菌E.faecium R2[9],对其进行了安全性评价[10],证明了其实用性与安全性,可用于酸浆发酵剂的制备,具有广阔的应用前景。活菌数量是衡量发酵剂性能的主要指标,研究表明相对于厌氧发酵,乳酸菌利用有氧增殖可显著提高菌体数量,减少发酵剂生产成本。另外,进行有氧代谢的乳酸菌的长期存活能力是发酵代谢的106倍~108倍,可延长发酵剂的货架期[11]。因此,通过有氧代谢方式来提高乳酸菌细胞数量,为规模化发酵剂制备工艺提供新的思路[12]。
研究表明添加外源血红素可使肠球菌进行有氧呼吸代谢[13-14]。因此,本文以E.faecium R2为研究对象,验证该菌株是否可进行有氧呼吸代谢,进而采用单因素和正交试验设计对其有氧呼吸增殖条件进行优化,获得纯种酸浆发酵剂,并对该发酵剂的发酵性能进行评价,以期为酸浆发酵剂的推广和大豆黄浆水的开发利用提供理论依据和试验基础。
1 材料与方法
1.1 材料与试剂
屎肠球菌(E.faecium R2)CGMCC 14944:中国普通微生物菌种保藏管理中心;脱脂乳粉:内蒙古伊利实业集团股份有限公司;1-谷氨酸钠盐、氯化血红素:上海麦克林生化科技有限公司;蛋白胨、葡萄糖、牛肉膏、蔗糖:国药集团化学试剂有限公司。
0.5 mg/mL血红素溶液:称取0.05 g血红素,将其溶于0.05 mol/L的NaOH水溶液中,4℃下于棕色广口瓶中保存备用。
乳酸细菌培养基(MRS):蛋白胨 10.0 g、牛肉膏10.0 g、酵母膏5.0 g、葡萄糖 20.0 g、磷酸氢二钾 2.0 g、乙酸钠5.0 g、硫酸锰0.25 g、硫酸镁0.58 g、柠檬酸二铵2.0 g、吐温-80 1.0 mL、蒸馏水 1 L,pH 6.2,121 ℃下灭菌20 min。MRS固体培养基再添加琼脂粉18.0 g,用于培养计数。
取30 mL黄浆水加入到250 mL锥形瓶中,为黄浆水培养基,在此基础上添加60 μL 0.5 mg/mL的血红素溶液,即得黄浆水血红素培养基,121℃下灭菌20 min,备用。
1.2 设备和仪器
JA2203N电子天平:上海民桥精密科学仪器有限公司;UV2300紫外可见分光光度计:上海天美科学仪器有限公司;ZHWY-100B恒温振荡培养箱:上海智诚分析仪器制造厂;LDZF-30KB立式压力蒸汽灭菌器:上海申安医疗器械;SW-CJ-2D双人单面垂直净化工作台:苏州博莱尔净化设备有限公司;pHS-3CpH计:上海仪电科学仪器股份有限公司;LRH-250-A生化培养箱:广东泰宏君科学仪器股份有限公司;HZP-250全温培养振荡器:上海精宏实验设备有限公司;TS-200B台式空气浴恒温摇床:上海捷呈实验仪器有限公司;JYC-21ES55C电磁炉:九阳股份有限公司;桨式搅拌器:盐城市沃特机械设备有限公司;RMQYL立式油压千斤顶:荣美液压机械制造有限公司;FD-1A-50台式真空冷冻干燥机:北京博医康实验仪器有限公司。
1.3 方法
1.3.1 菌种活化
将屎肠球菌R2接种到MRS培养基中,于37℃下静置培养14 h,备用。
1.3.2 黄浆水的制备
取700 g黄豆用蒸馏水于25℃下浸泡8 h后,豆水比1∶8(g/mL)打浆,用100目尼龙筛布过滤除渣,所得生豆浆煮沸并维持5 min,当降温至85℃时,轻轻搅动下缓缓加入酸浆,直至出现均匀脑花,添加量为16%(质量分数)左右。85℃下蹲脑20 min后,将豆花倒入豆腐模具中于5.5 kPa~6.0 kPa压力下压浆30 min,得到黄浆水[9]。试验用酸浆参考叶青等[15]的方法采用三级豆腐黄腐黄浆水为发酵基质制备而成,以消除原卤盐凝固剂的影响。
1.3.3 屎肠球菌R2在传统发酵与有氧呼吸条件下的生长趋势
将活化后的屎肠球菌R2按3%的接种量分别接种到黄浆水培养基与黄浆水血红素培养基中,分别在传统发酵(无氧无血红素:静置培养,黄浆水培养基,用NoOx/NoH表示)、有氧呼吸(有氧有血红素:150r/min摇床培养,黄浆水血红素培养基,用Ox/H表示)2种条件下于37℃下培养24 h,于6、12、24 h测定菌种OD600值。
1.3.4 屎肠球菌R2有氧呼吸增殖条件单因素优化
将活化后的屎肠球菌R2按3%接种量接入黄浆水血红素培养基,通过测定OD600值来比较不同温度(32、37、42 ℃)、转速(125、150、175 r/min)、血红素浓度(1.0、2.0、3.0 μg/mL)、初始 pH(5.6、5.9、6.2)对其增殖效果的影响。
1.3.5 屎肠球菌R2有氧呼吸增殖条件正交试验优化
根据单因素试验结果,选择温度、转速、血红素浓度、初始pH值4个因素进行优化,以发酵液培养24 h的OD600值为检测指标,进行L9(34)正交试验设计,确定最佳增殖条件,因素水平见表1。

表1 正交试验因素水平Table 1 Factors and levels of orthogonal experiment
1.3.6 发酵剂菌粉的制备
分别以传统发酵(No Ox/No H)和最适有氧呼吸(Ox/H)条件对屎肠球菌R2进行培养,24 h后取菌液置于离心管中,以转速5 000 r/min离心10 min后,弃去上清液,加适量生理盐水溶解菌泥,添加冷冻保护剂(谷氨酸钠5%、脱脂乳10%、蔗糖10%)[16],于-80℃下过夜冷冻;取冻结菌泥放于真空冷冻干燥机中进行干燥,24 h后完全干燥成菌粉状态,获得纯种酸浆发酵剂。
1.3.7 酸浆发酵剂品质评价
活菌数的测定:参考GB4789.35—2016《食品安全国家标准食品微生物检验乳酸菌检验》[17],测定两种方式制备的发酵剂中的活菌数。
发酵性能的测定:准确称取两种发酵剂菌粉各0.1g分别接种到黄浆水培养基中,37℃静置培养36 h,每隔8 h测量其pH值。
1.4 数据处理与统计分析
数据表示为平均值±标准偏差,使用SPSS16.0软件对数据进行统计处理和方差显著性分析,图形数据采用Origin2018软件制作。
2 结果与分析
2.1 屎肠球菌R2在传统发酵与有氧呼吸条件下的生长曲线
屎肠球菌R2在传统发酵与有氧呼吸条件下的生长趋势如图1所示。
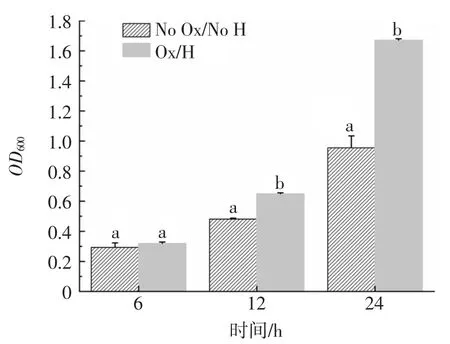
图1 屎肠球菌R2在传统发酵与有氧呼吸条件下的生长趋势Fig.1 Growth trends of E.faecium R2 under traditional fermentation and aerobic respiration conditions
结果表明,培养前6 h时,No Ox/No H与Ox/H两种培养条件下菌种生长量无显著差异;培养12 h后,两者出现显著差异,Ox/H培养条件下的生物量显著高于No Ox/No H条件下的生物量,说明Ox/H培养条件对屎肠球菌R2的生长没有产生迫害作用,反而有促进作用。PATRICK等[18]研究表明,当血红素和氧气存在时,乳球菌最初的生长是通过发酵代谢方式实现的,在培养8 h之后才将代谢方式转换为有氧呼吸代谢,生物量继续增加,可能细胞对血红素的摄取等因素限制了对数前期细胞血红色素的活性。
想要做好高校的内部控制工作,从而做好高校的财务风险管控,就必须要对内部控制做好有效的监督。对高校内部控制进行监督可以保证高校内部控制工作的合理性以及科学性,然而在我国的高校中,内部控制的监督工作基本上都是由财务内部人员来进行的,没有做到让专业的人员来进行,从而会使得监督流于形式,而且这种监督方式是非常不科学的,监督的结果也是难以令人满意的。还有很多高校在内部控制工作当中没有内部控制的监督机制,造成对内部控制工作的管理极为不严谨,由于缺少有效的监督,内部控制工作一旦出现问题可能不能及时发现和上报,最终造成高校的财务风险,从而影响到高校的财务风险管控工作正常运作。
2.2 屎肠球菌R2有氧呼吸培养条件单因素优化
2.2.1 温度对屎肠球菌R2增殖的影响
在培养过程中,菌株生长代谢的培养温度,一方面直接影响到菌株细胞内的各种酶活性[19],控制菌株对营养物质的吸收与利用,从而影响菌种生物量。另一方面菌种生长会产生各种热量,若发酵环境温度过高,产生热量不能及时消散,则会对菌种产生影响,抑制其的生长。因此控制环境温度可以改变菌种培养周期的时长。温度对屎肠球菌R2生长的影响见图2。
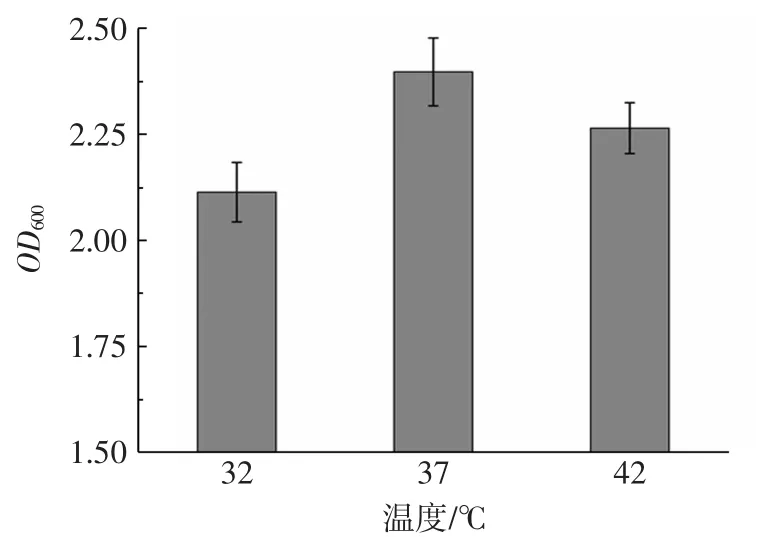
图2 温度对屎肠球菌R2生长的影响Fig.2 Effects of temperature on growth of E.faecium R2
从图2可以看出,温度过高或过低均会影响屎肠球菌的生长,当培养温度为37℃时,培养24 h后菌液的OD600值最高,生物量最大。
2.2.2 初始pH值对屎肠球菌R2增殖的影响
初始pH值可能影响乳酸菌膜转运蛋白和胞内酶的活性,当发酵液初始pH值下降到5.3左右时,菌株可从发酵代谢转变为更有利于菌株生长的有氧呼吸,生物量进一步增加[18]。初始pH值对屎肠球菌R2生长的影响见图3。
如图3所示,培养环境的初始pH值为5.9时,菌株有氧呼吸培养24 h后OD600值最高,生物量最大。施为家[19]研究表明,发酵液pH值会影响菌株胞内积累血红素的能力,进而影响有氧呼吸的效率。
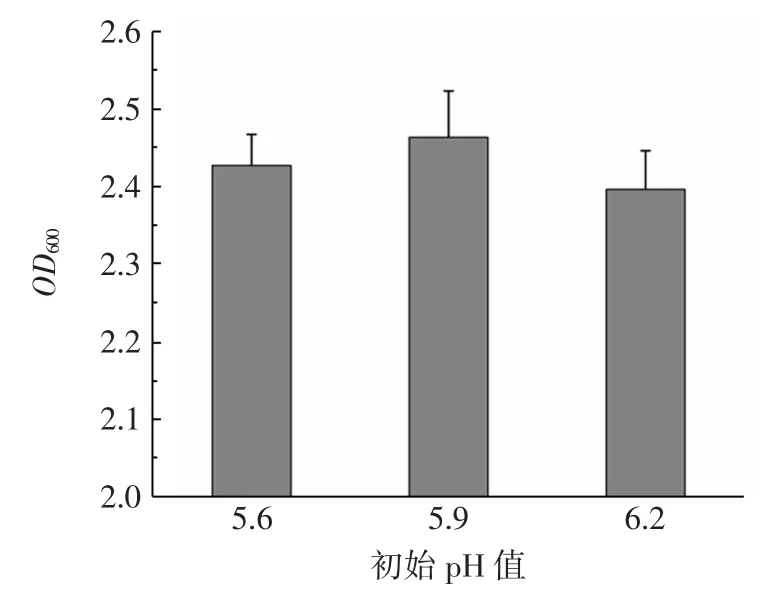
图3 初始pH值对屎肠球菌R2生长的影响Fig.3 Effect of initial pH on growth of E.faecium R2
2.2.3 血红素对屎肠球菌R2增殖的影响

图4 血红素浓度对屎肠球菌R2生长的影响Fig.4 Effect of heme concentration on growth of E.faecium R2
如图4所示,在血红素终浓度为2.0 μg/mL的有氧呼吸条件下培养24 h能获得最大生物量,而高浓度的血红素对菌株的生长存在一定的抑制。
2.2.4 转速对屎肠球菌R2增殖的影响
改变摇床的转速可以改变菌株培养环境的含氧量。转速对屎肠球菌R2生长的影响见图5。

图5 转速对屎肠球菌R2生长的影响Fig.5 Effect of rotate speed on growth of E.faecium R2
如图5所示,恒温摇床转速为150 r/min时,OD600值最高,高于转速125 r/min和175 r/min条件下的OD600值。研究表明,肠球菌在进行有氧呼吸代谢时,如果通气过多,未被利用的氧气会对菌体细胞造成损伤[13]。
2.3 屎肠球菌R2有氧呼吸增殖条件正交试验优化
屎肠球菌R2有氧呼吸增殖条件正交试验优化结果及极差分析结果如表2所示。

表2 正交试验结果Table 2 The results of orthogonal experiment
从表2可以看出,以OD600为检测指标,按照极差大小各因素对屎肠球菌R2增殖效果影响的主次顺序为:A>D>C>B。按 A1B3C3D2条件进行验证试验,结果显示屎肠球菌R2培养24 h的OD600值为2.675,高于A2B3C1D2(正交试验中OD600值最高)。因此,屎肠球菌R2的最适增殖条件为温度32℃、转速175 r/min、血红素添加量 3.0 μg/mL、初始 pH5.9。
2.4 发酵剂品质评价
2.4.1 活菌数的测定
采用平板计数法分别测定Ox/H和No Ox/No H两种方式获得的发酵剂菌粉中的活菌数,结果见图6。
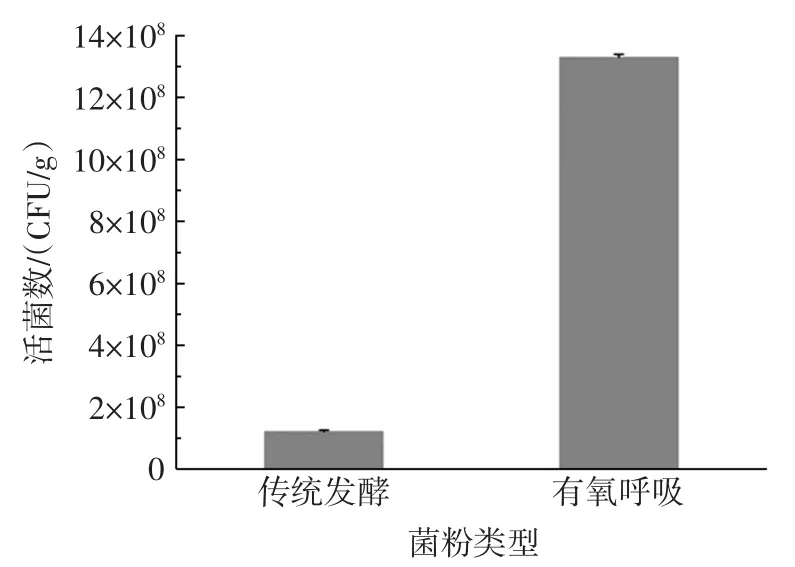
图6 两种培养条件下制备的菌粉的活菌数Fig.6 Viable counts of bacterial powers cultivated under condition different condition
结果表明采用No Ox/No H和Ox/H两种方式获得的发酵剂菌粉中的活菌数分别为1.22×108CFU/g和1.33×109CFU/g,后者明显高于前者,说明进行有氧呼吸代谢的屎肠球菌R2具有更强的生存能力,与PATRICK等[18]的研究结论一致。
2.4.2 产酸性能的测定
研究表明,在通气和添加外源血红素的条件下,通过有氧呼吸代谢下生产出来的乳酸菌发酵剂对标准乳制品生产条件下生产的干酪或发酵乳的品质的影响不大[19]。两种培养方式制备的发酵剂菌粉的产酸性能如图7所示。

图7 两种培养条件下制备的菌粉的产酸性能Fig.7 Acid-producing ability of bacterial powers cultivated under condition different condition
结果表明,采用No Ox/No H方式获得发酵剂菌粉对黄浆水的发酵过程与采用No Ox/No H方式获得发酵剂菌粉基本一致,在发酵36 h后pH值均下降到3.6左右。说明采用No Ox/No H方式获得的发酵剂菌粉仍具有较好的发酵特性。
3 结论
本文以OD600为检测指标,采用单因素和正交试验优化了屎肠球菌R2有氧呼吸增殖条件,并对屎肠球菌R2酸浆发酵剂品质进行评价。屎肠球菌R2有氧呼吸最适增殖条件为温度32℃、转速175 r/min、血红素添加量3.0 μg/mL、初始pH 5.9。在这种条件下培养的屎肠球菌R2经冷冻干燥制得酸浆发酵剂,该发酵剂的活菌数达到1.33×109CFU/g,产酸性能良好,可用于酸浆生产。

