不同品种大米理化性质的探究
王德生,王睿,商文婷,周中凯*
(1.天津科技大学食品工程与生物技术学院,天津 300457;2.海南大学食品科学与工程学院,海南 海口 570228)
大米作为我国重要的主食之一,具有丰富的营养价值,其中亚油酸含量是菜籽油的2倍~5倍,同时大米中蛋白质和氨基酸的构成比例也远高于小麦、大麦和玉米等农作物。国内主要将大米分为3类:粳米、籼米和糯米[1]。粳米是用粳型非糯性稻谷碾制成的米,形状为椭圆形,米粒颜色为蜡白,呈透明或者半透明,质地较为坚硬;用籼型非糯性稻谷制成的米称为籼米,籼米形状呈现细长型,长度在7 mm以上,质地脆弱易碎,米粒颜色偏白色半透明居多;糯米又称为江米,米粒颜色为白色不透明,质地较为脆弱,易碎,糯米也有粳籼之分,籼糯米的米粒一般呈长椭圆形或细长形,粳糯米一般为椭圆形,颜色大多为白色不透明,也有半透明状。大米的生长受到很多外界因素的影响,如气候、水分、土壤和环境等,其中环境气候的变化对大米的生长起着非常重要的作用。在海南省黎族地区,就生长着一种独特的稻谷,人们称其为“山兰米”,由于海南独特的地理位置和气候,使得山兰米成为黎族地区独有的品种。山兰米是旱生山兰糯稻谷,生长能力顽强,在生长收割过程中,不施加任何肥料,因此产量很少,但营养价值极高,相比于普通稻谷来讲,具有较高含量的铁、硒、锌等微量元素。山兰米从颜色上划分,又分为白米、红米和黑米,其中红米最为独特,只生长在北纬18度的绿色无污染的五指山地区[2-3]。目前,关于报道山兰米相关性质的文献还很少,也并未有相关文献系统地报道过山兰米的理化性质。因此,通过研究山兰米的相关性质,对后续山兰米的开发利用起着重要的指导意义。本文通过快速黏度分析(rapid viscosity analysis,RVA)、X-射线衍射(X-ray diffraction,XRD)、差式扫描量热(differential scanning calorimetry,DSC)分析、体外消化、流变学对4种大米的理化性质进行探究,为山兰米的进一步研究提供相关理论依据。
1 材料与方法
1.1 材料与试剂
盐丰4期粳米、鉴真2号籼米、山兰米(白)和山兰米(红):市售。
唾液淀粉酶(500 U/g)、胃蛋白酶(15000 U/g)、中温 α-淀粉酶(2 000 U/mL)、糖化酶(100 000 U/mL)、淀粉酶(1 500 U/mL):阿拉丁试剂(上海)有限公司;冰乙酸、无水乙醇(分析纯):上海国药集团化学试剂有限公司;盐酸、氢氧化钠、无水乙酸钠(分析纯):天津江天化工技术有限公司;葡萄糖试剂盒:长春汇力生物技术有限公司。
1.2 仪器与设备
FW-100高速多功能磨粉碎机:天津市泰斯特仪器有限公司;DSC3差示扫描量热仪:梅特勒托利多公司;TechMaster2快速黏度分析仪:Newport Scientific公司;Mars60哈克红外流变联用仪:赛默飞世尔科技(中国)有限公司;D8Advance X射线衍射仪:德国布鲁克公司;TU-1810紫外可见分光光度计:北京普析通用仪器有限责任公司;TS-110XS水浴恒温振荡器:上海科辰实验设备有限公司;7890A-5975气相色谱-质谱联用仪:美国Agilent公司;DVB/CAR/PDMS固相微萃取头:美国Supelco公司。
1.3 方法
1.3.1 样品制备
将4种不同品种的稻谷进行清理、砻谷、碾米、过筛等制备成米粉后放入密封袋中进行下一步理化性质的测定。
1.3.2 大米的糊化特性分析
根据美国谷物化学协会的标准方法[4]进行测定,准确称取3 g样品放置于铝制瓶内,用量筒量取25 mL蒸馏水加入其中,并混合均匀,放置于快速黏度分析仪中进行测量,并记录样品曲线所对应的峰值黏度、谷值黏度、最终黏度、崩解值、回生值和成糊温度。
1.3.3 大米的晶型结构分析
将过筛后的样品采用X射线衍射仪对样品的晶型结构进行测定,扫描速度为2°/min,扫描角度2θ=5°~40°,电压 40 kV,管流 30 mA。将得到的 X-射线衍射图谱采用Jade 6.5软件对样品的弥散区和结晶区进行拟合,计算样品的结晶度,计算公式如下。
RC/%=Ac/(Ac+Aa)×100
式中:RC为样品的相对结晶度,%;Ac为结晶区部分面积;Aa为非结晶区部分面积。
1.3.4 大米的热特性分析
准确称取4 mg样品置于DSC仪铝制空坩埚内,向坩埚内加入10 μL蒸馏水并混合均匀,加盖然后使用压片机压片,将制备的样品放置于室温(25℃)静置平衡12 h,然后将其放置于DSC仪器内盘中,并采用相同质量的空坩埚作为空白对照,然后以10℃/min升温速率进行升温,升温范围为25℃~120℃,进行扫描[5],将扫描后的曲线采用DSC仪自带的分析软件对曲线进行拟合积分,计算出样品两次扫描的起始温度(To)、峰值温度(Tp)、终止温度(Tc)和热焓值(△H)的变化。
1.3.5 大米的流变学特性分析
1.3.5.1 动态流变特性测定(黏弹性)
选用直径为35mm的平板模具,间隙设置为0.1mm。设定流变仪温度为25℃,角频率为10 rad/s,进行振幅扫描,确定样品的线性黏弹区振荡频率。频率范围:0.1 rad/s~100 rad/s,应变 0.5%。
1.3.5.2 静态流变特性测定(触变性)
流动扫描,测试温度25℃,剪切速率从0~300 s-1递增,再从300s-1~0递减,设置程序连续,中间不间断。
1.3.6 大米的体外消化分析
准确称取200 mg样品于250 mL锥形瓶中,向其中加入300 μL的唾液淀粉酶溶液(取300 μL唾液淀粉酶原液溶解于25 mL醋酸-醋酸钠缓冲液中),在水浴振荡摇床(37℃,120 r/min)中振荡 5 min,向其中加入15mL胃蛋白酶(将250mg胃蛋白酶溶解于0.02mol/L的盐酸中),并振荡反应30min,再向反应物中加入15mL 0.02 mol/L NaOH溶液和25 mL无酶醋酸钠缓冲液和10 mL复合酶溶液(取中温α-淀粉酶600 μL和糖化酶100 μL溶解于50 mL的pH5.0的醋酸-醋酸钠缓冲液中),在 37 ℃下继续反应 12 h,在 0、0.5、1.0、1.5、2.0、2.5、3.0、6.0、9.0、12.0 h 分别取 1 mL 反应液,然后于1 000 r/min离心10 min,取上清液于沸水浴下灭酶10 min,冷却后用葡萄糖试剂盒法测定反应液中的葡萄糖含量,每次取样测量3次,取平均值。
水解淀粉含量/mg=样品中葡萄糖含量(mg)×0.9
1.3.7 顶空固相微萃取
1.3.7.1 生样品处理
准确称量5 g生样品于30 mL顶空瓶中,并加入20 μL 20 mg/L 2,4,6-三甲基吡啶后旋紧瓶盖。 在 60℃的水浴中平衡15 min后将萃取头缓缓插入顶空瓶中30 min,使萃取头纤维暴露在空气中。然后在进样口于250℃下解吸附7 min,用于气相色谱-质谱联用(gas chromatography-mass spectrometry,GC-MS)分析。
1.3.7.2 蒸煮样品处理
准确称量5 g样品和7 mL蒸馏水于30 mL顶空瓶中,用保鲜膜封口。在电蒸锅中蒸煮60 min后,放于60℃的水浴锅中静置60 min。之后的平衡和萃取条件同1.3.7.1。
1.4 数据统计及处理
将所得的数据采用Statistix 9进行数据分析,分析各指标差异显著性,邓肯氏多重比较法(Duncan's multiple range test)进行多重比较。通过origin 8.5软件进行绘图。
2 结果与分析
2.1 黏度性质分析
不同品种大米的黏度变化见图1。

图1 不同品种大米的黏度曲线Fig.1 Pasting profiles of different varieties of rices
从图1中可以看出,粳米和籼米的RVA谱图较为接近,说明二者的糊化过程相似,其中粳米和籼米的峰值黏度、谷值黏度和崩解值均高于山兰米,这说明了粳米和籼米的热糊稳定性较差,而山兰米则具有较强的耐高温和抗剪切能力,从而赋予了样品糊较高的稳定性,其中山兰米(红)尤为显著。山兰米的回生值高于粳米和籼米,这归因于样品糊在冷却的过程中,淀粉分子之间在氢键的作用下发生分子之间的重排,促进了老化回生行为的发生。4种样品的成糊温度均在80℃~90℃之间,其中山兰系列米的成糊温度高于粳米和籼米,山兰米(红)在4种样品中呈现最高的成糊温度,88.85℃,这说明山兰米(红)中较高的直链淀粉含量和较为致密的晶体结构在一定程度上减缓了淀粉颗粒吸水膨胀的速度。舒庆尧等[6]发现了类似的结果,一般淀粉的直链淀粉含量越高,其峰值黏度、崩解值越小,而最终黏度和回生值则越高。
2.2 结晶结构
不同品种大米的X-射线衍射图见图2。

图2 不同品种大米的X-射线衍射图Fig.2 X-ray diffraction patterns of different varieties of rices
大部分米粉中都含有约75%的淀粉,而淀粉又是一种多晶体聚合物,其颗粒结构由结晶区、亚微晶区和非晶区构成,结晶区是分子之间较为致密的结构所致,因而在X-射线衍射图谱中会呈现尖峰衍射特征,而亚微晶和非晶区则是由于样品内部晶粒结构小和结晶的不完全所致,在衍射图谱中会呈现弥散衍射特征。结晶区的大小一般与支链淀粉双螺旋结构的相互作用程度、双螺旋的取向和晶体的大小等因素有关[6-7],而非晶区大部分是由于直链淀粉和支链淀粉分叉导致的不规则排列,因而非晶区之间的分子排列无序,较为松散,稳定性较差。从图2中可以看出,4种样品均在 15°、17°、18°和 23°附近出现特征衍射峰,是属于典型的A型结晶结构[7-8],其中籼米的结晶度最高,为39.49%,这可能归因于籼米中较高含量的支链淀粉,通过氢键作用形成双螺旋结构,排列成较为有序的结晶结构,而山兰米的相对结晶度低于粳米和籼米,这主要是归因于无定形区的直链淀粉大部分以游离的或者松散的结构聚集在一起,因此造成颗粒内部结构较为松散,结晶度相对较低。
2.3 不同品种米粉的热特性
不同品种大米的热力学值变化见表1。
米粉中的淀粉颗粒在加热的过程中吸水膨胀,分子间的氢键断裂,达到糊化温度之后,淀粉颗粒发生非晶化转变,颗粒中有序的晶体结构变成无序的非晶体结构,并伴随着能量的变化,从而在差式扫描量热仪的图谱中出现吸热峰,因此可以根据所出现的起始温度To、峰值温度Tp、终止温度Tc和热焓值ΔH的变化来反映颗粒内部结构的变化[9]。从表1中可以看出,山兰米(红)呈现较高的峰值温度Tp和热焓值ΔH,热焓值的变化则反映了淀粉颗粒在相变过程中双螺旋结构的解聚所需要的能量,是表示颗粒中有序结构的变化,而不是结晶度的破坏,这主要是由于淀粉颗粒之间的紧密连接是由于支链淀粉双螺旋结构之间的相互束缚,而不是结晶体之间的密集性聚集[10]。因此,ΔH的降低是由于颗粒内部的双螺旋结构被破坏,淀粉颗粒发生相变时所需要的解旋能量降低,ΔH的增加是由于无定形区先被破坏,后续双螺旋的解旋则需要更多的能量[11],这同时也说明了山兰米(红)具有较高的热稳定性,说明其颗粒内部结构较为紧密,在淀粉颗粒吸水膨胀的过程中水分子的扩散速度较慢,可以在一定程度上提高米粉的成糊温度,赋予其较高的热稳定性[12],这与RVA结果相一致。

表1 不同品种大米的热力学值变化Table 1 Viscosity changes of different varieties of rices
2.4 流变学特性
2.4.1 动态流变学特性分析(黏弹性)
不同品种大米的动态流变学特性趋势图见图3。
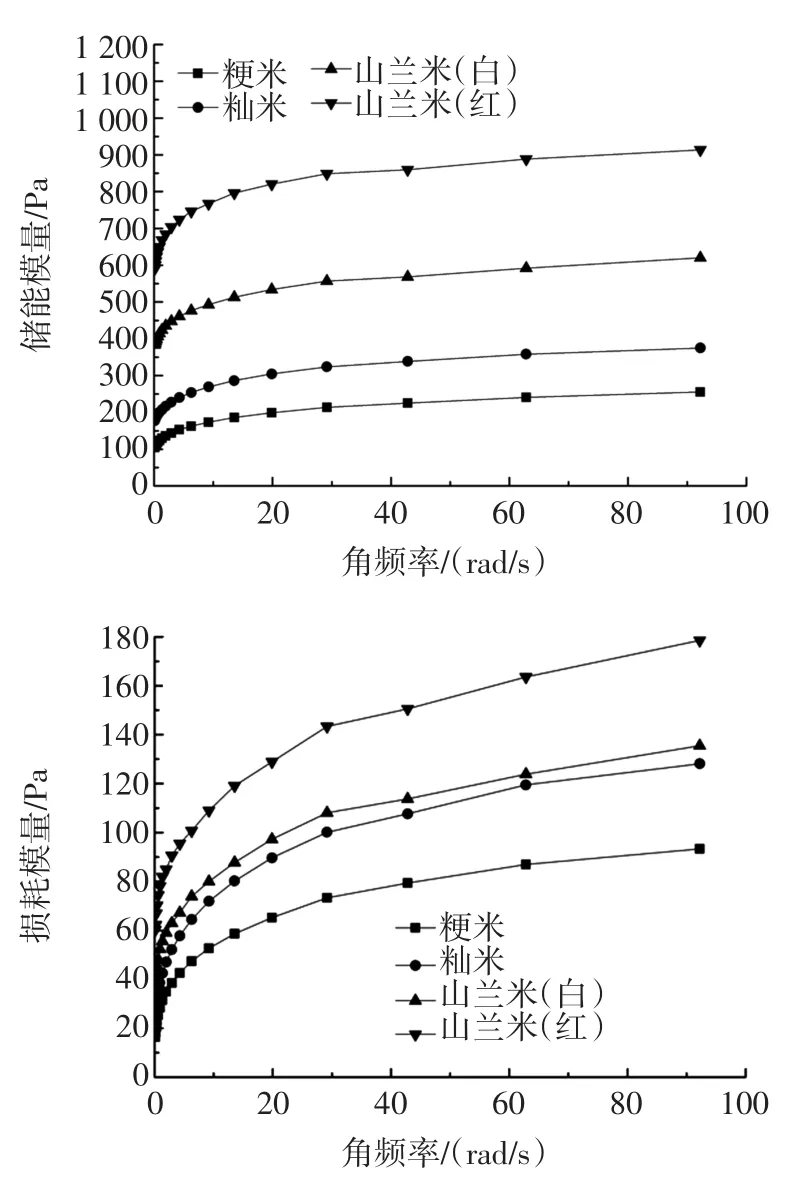
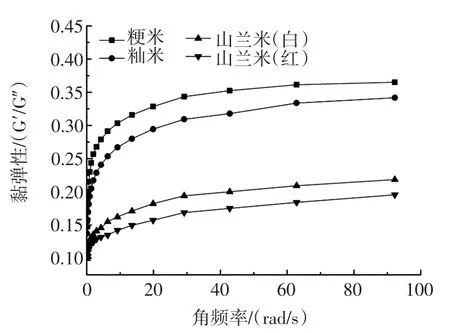
图3 不同品种大米的动态流变变化趋势图Fig.3 The dynamic rheological changes of different varieties of rices
储能模量(G′)用来表征样品糊在发生形变过程中由于弹性形变而储存的能量,它反映了样品糊恢复到原来形状的能力。损耗模量(G″)则可以用来表征样品糊在发生形变过程中,由于黏性形变而损耗的能量,反映了样品糊抵抗流动的能力[13]。从图3中可以看出,4种样品随着角频率的增加,损耗模量和储能模量也呈现缓慢增加的趋势,且储能模量远远大于损耗模量,表现为典型的弱凝胶流变学动态体系,山兰系列米的储能模量以及损耗模量明显高于籼米和粳米,这说明山兰系列的米内部结构较为致密有序,可以形成更强的三维凝胶网络结构。损耗模量与储能模量之比,即tanδ=G″/G′,可以在一定程度上反映流体的黏弹性[14],从图3可以看出,山兰米的tanδ明显低于籼米和粳米,这说明山兰系列米形成的体系更加具有黏弹性,其中,山兰米(红)更为突出,这可能是由于山兰系列的米在受到外界压力时颗粒内部的双螺旋结构受到破坏,因而显现出略具黏性的流体性质[2]。另一方面,山兰米(红)表现为更具弹性的流体性质,也能进一步说明,其内部结构较为致密,从而可以形成更加有序、硬性、牢固的构象[15]。
2.4.2 静态流变学特性分析(触变性)
不同品种大米的静态流变学特性分析(触变性)见图4。
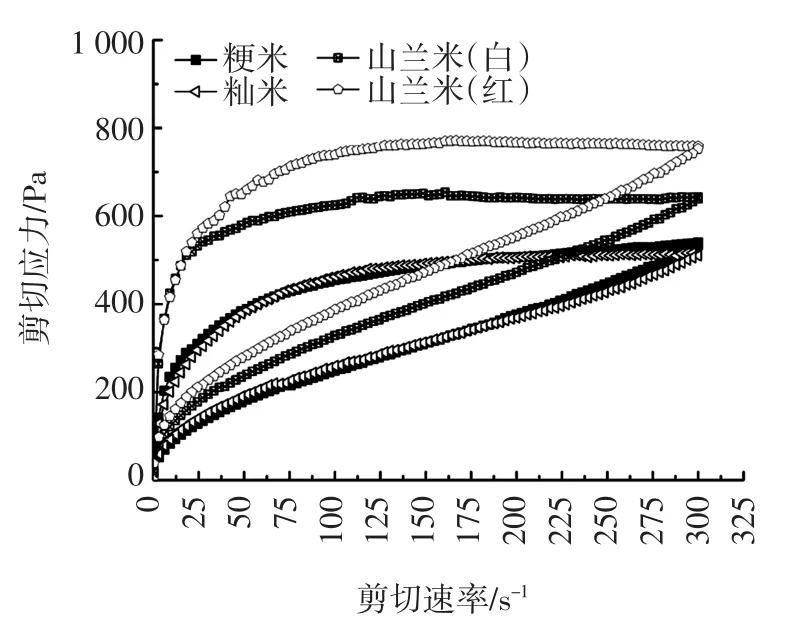
图4 不同品种大米的触变性变化Fig.4 Thixotropy changes of different varieties of rices
不同品种大米的静态流变学特性分析(滞后环面积)见表2。
静态流变学在一定程度上可以反映样品糊由于外部剪切的作用对颗粒内部的有序凝胶网络结构的破坏程度[16]。随着剪切作用的增加,颗粒内部的结构受到破坏,而当剪切速率降低时,颗粒内部结构的恢复速度又远远低于受到破坏的速率,因此就形成滞后环,出现触变性。触变性是指样品在振动、搅拌等过程中黏度减小、流动性增加的过程。剪切速率在0~300 s-1范围内增加,剪切应力增大,黏度变小,此时该流变曲线为上行线;当剪切速率从300 s-1减小到0时,剪切应力减小,黏度逐渐恢复,此时该流变曲线为下行线。上行线与下行线之间包围的面积即为滞后环。从表2可以看出,4种样品受破坏的程度从高到低依次是:山兰米(红)、山兰米(白)、粳米和籼米,山兰米(红)明显高于山兰米(白),说明山兰米(红)受破坏程度最大,其凝胶网络结构也最不容易恢复到剪切前的状态,山兰米(白)的触变性相对较小,恢复能力强。
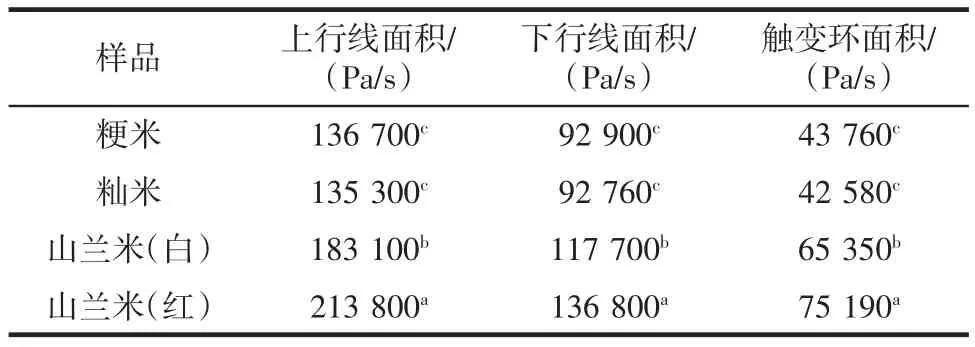
表2 不同品种大米的滞后环面积Table 2 Lag ring area of different rice varieties
2.5 不同大米的消化性分析
不同品种大米的酶解速率的变化见图5。
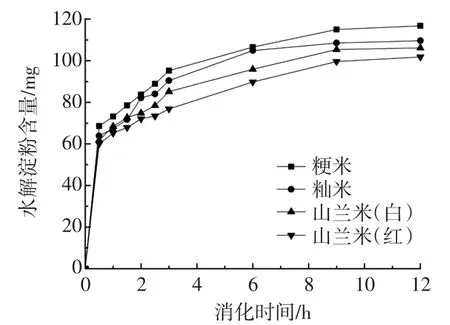
图5 不同品种大米的酶解速率的变化Fig.5 Change of enzymatic hydrolysis rate of different varieties of rices
从图5可以看出,4种样品均随着消化时间的增加,水解淀粉的含量也逐渐增加,当消化时间达到8 h后,水解淀粉的含量趋于平衡,其中山兰米的酶解速率低于粳米和籼米,其中山兰米(红)在4种样品中消化酶解的速率最低。影响淀粉颗粒的酶解速率有很多因素:淀粉的来源、颗粒大小、直链/支链淀粉比例、脂质、直链淀粉含量等[17-18]。通常降低淀粉颗粒的酶解速率,一方面,是通过抑制淀粉颗粒的吸水膨胀,提高其热稳定性,使得酶分子难以进入到颗粒内部;另一方面,可以通过减少淀粉颗粒与酶分子之间的结合位点,来降低其酶解速率。结合RVA、DSC等数据,可以推测出,山兰米(红)呈现出较低的酶解速率主要是归因于颗粒内部较为紧密的结构,抑制了淀粉的吸水膨胀速率,使得酶分子较难进入到颗粒内部发生酶解反应,同时RVA的曲线中山兰米较高的回生值也说明山兰米中富含较高含量的直链淀粉,这一现象在其他文献中也有报道[19],另外,在一定程度上,直链淀粉含量与样品的酶解速率之间呈现负相关性,这主要归因于直链淀粉的线性结构相比于支链淀粉具有较多的氢键,赋予颗粒更高的稳定性,缪铭等[11]曾通过扫描电镜观察到在酶解时间2 h之后,酶解残余的样品多为无定形和结晶片层构成的层状结构。
2.6 GC-MS在大米香气成分分析中的应用
不同品种大米生米和熟米的香气成分变化见表3和表4。
采用顶空固相微萃取(soild phase micro-extraction,HS-SPME)技术对4种样品中的主要挥发性风味物质进行富集,然后通过GC-MS进行分析。如表3所示,在生米中共检测到43种挥发性风味化合物,包括5种醛、12种醇、4种酮、7种酯和2种酸及烷烃化合物等。这些化合物是构成生米香气的主要物质。山兰米(白)、籼米和粳米在化合物的数量和浓度上无显著性差异,含量均较小。在山兰米(红)中检测到的化合物数量虽少但浓度较前3种米高。经过蒸煮之后,通过GC-MS分析共检测到34种挥发性风味物质(如表4所示),并且整体上化合物含量较蒸煮前升高。包括7种醛、7种醇、5种酮和3种酯以及6种烷烃化合物等。己醛和2-庚酮的含量大幅度增加,且这些物质在山兰米(红)中的含量最高,己醛和壬醛均属于脂肪醛,表现为青草香,对蒸煮后的大米风味起到重要的作用。

表3 不同品种的生米中香气成分分析Table 3 Fragrance compounds of different varieties of raw rices

续表3 不同品种的生米中香气成分分析Continue table 3 Fragrance compounds of different varieties of raw rices
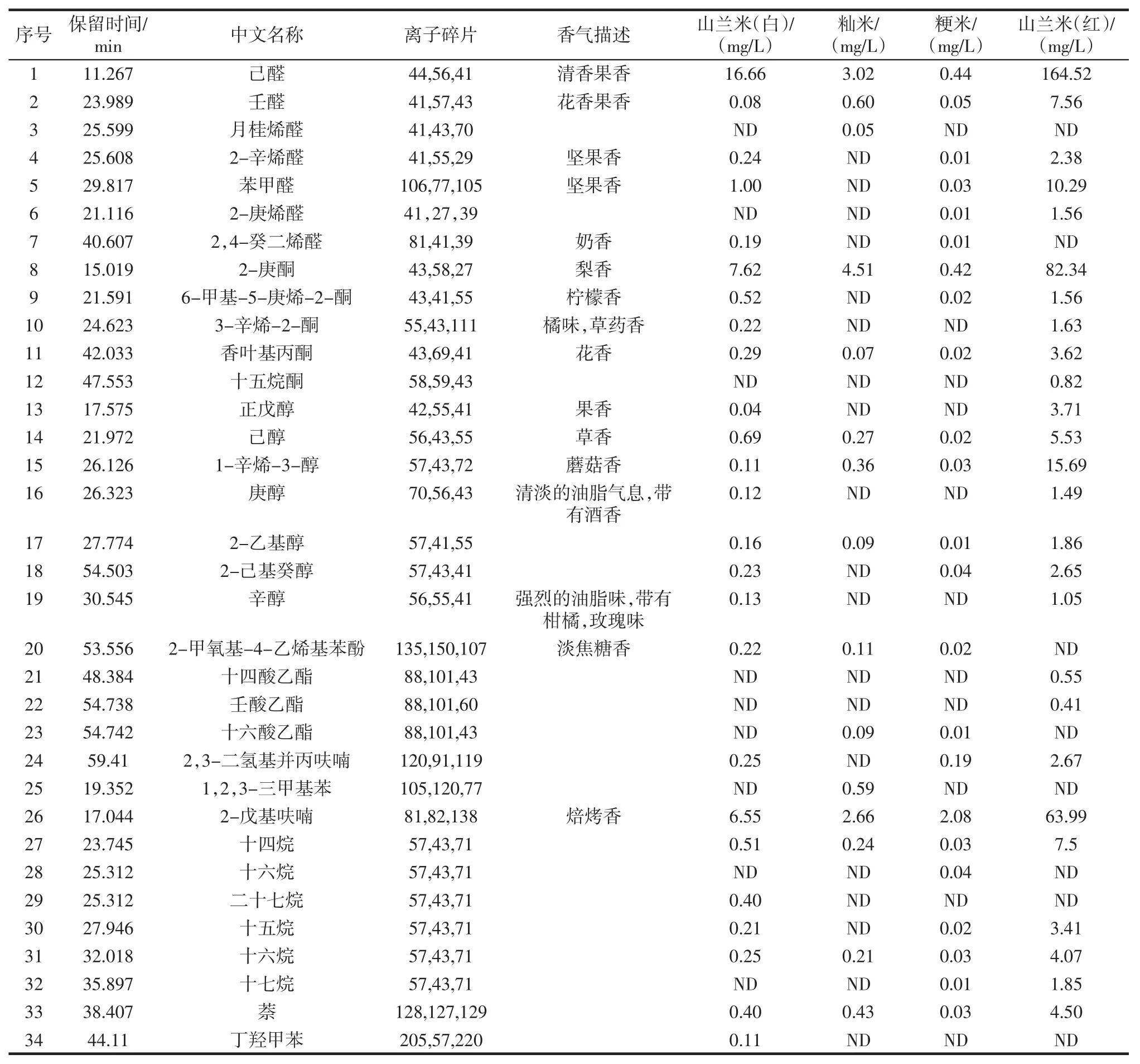
表4 不同品种的熟米中香气成分分析Table 4 Fragrance compounds of different varieties of cooked rices
3 结论
通过本研究发现,山兰米具有较高的回生值,直链淀粉含量是影响淀粉老化回生的一个重要的因素,这说明了山兰系列的米具有较高含量的直链淀粉,同时山兰米较高的成糊温度说明其具有较强的耐高温和抗剪切能力。山兰米(红)具有较高的热焓值,这说明了山兰米颗粒内部的结构较为紧密,在一定程度上抑制了颗粒的吸水膨胀。动态流变学表明,随着角频率的增加,山兰米的储能模量(G′)和损耗模量(G″)相比于粳米和籼米缓慢增加,tanδ值明显低于粳米和籼米,这说明山兰系列米形成的凝胶体系更加具有黏弹性,凝胶网络更强,颗粒内部结构排列更加致密有序,静态流变学表明山兰米(红)在受到外部的剪切应力下出现较大面积的滞后环,这说明山兰米(红)受破坏程度最大,其凝胶网络结构也最不容易恢复到剪切前的状态。X-射线衍射图谱表明4种大米均属于典型的A型结晶结构,其中籼米在4种样品中呈现出较高的相对结晶度,为39.49%,这可能归因于籼米中较高含量的支链淀粉通过氢键形成双螺旋结构,进一步堆叠成有序的结晶结构。体外消化试验中得到山兰米(红)具有较强的耐酶解能力,这主要归因于红米内部排列有序的结构通过减缓颗粒吸水膨胀的速度,来降低淀粉颗粒与酶分子之间的结合位点,从而降低淀粉的酶解速率,另外,在生米中检测到43种挥发性风味化合物,在熟米中检测到34种挥发性风味化合物。这为后续山兰米的开发利用提供了一定的理论依据。

