黑莓中总花色苷的提取工艺优化及其抗氧化性和抑菌性的研究
吴映梅,徐龙泉,浦绍敏,周艳*,周绍琴
(1.贵州医科大学环境污染与疾病监控教育部重点实验室,贵州 贵阳 550025;2.贵州医科大学食品科学学院,贵州 贵阳 550025;3.贵州中烟工业有限责任公司技术中心,贵州 贵阳 550000)
黑莓(blackberry),发现于北美洲,属于一种藤本植物,隶属于蔷薇科,是已发现的第三代水果的代表种类之一[1],果实丰富,色泽宜人,含有丰富的高效抗氧化物质,比如超氧化物歧化酶(superoxide dismutase,SOD)、花青素、鞣花酸和类黄酮等[2]。被一些欧洲国家称之为“黑色钻石”、“生命之果”。花色苷(anthocyanins)是一类天然色素,水溶性,极性大,属于类黄酮的一种,在多种植物性食品中都有存在,存在部位多为植物的果实、茎叶和细胞液中[3-4],花色苷种类很多,目前已从黑莓果实中分离出矢车菊-3-葡萄糖苷和矢车菊-3-芸香糖苷[5]等不同种类的花色苷。由于花色苷颜色鲜艳、色质好,常被用作着色剂,主要应用于果汁饮料、罐头和糖果等食品,如今被多个国家和地区允许按照需要量应用[6]。
目前,花色苷的提取主要有有机溶剂萃取法[7]、酶提取法[8]、超声、微波辅助提取法[9]及超临界CO2提取法[10]。其中,有机溶剂萃取法因为其操作简单,成本低,是最常用的提取方法。酸化醇溶液因为具有高效提取的特点,成为最常用的提取溶剂[3]。一般采用单因素和响应面法对花色苷的最佳提取工艺进行优化,谭永兰等[11]采用响应面法优化黑果腺肋花楸残渣花色苷提取工艺,得到最佳工艺,并且提取率较高。郭才南等[12]应用响应面法优化提取白檀果实花色苷工艺,考察了不同因素对于花色苷提取率的影响。
黑莓具有调节机体机能、增强机体免疫力、延缓衰老等生理功能[13],研究发现,黑莓花色苷针对H2O2诱导的血管内皮细胞损伤有一定的积极保护作用[14]。除此之外,16世纪时,黑莓就被应用于医学,在欧洲被用来医治细菌感染,有一定的抑菌作用[15]。越来越多的研究表明,黑莓花色苷对人体提高抗氧化应激能力有积极作用,因此可以实现对人体的抗氧化保护作用[16-17],但是目前黑莓药用价值和食用价值方面的开发还很少,仍有待更进一步的深入探究。
本研究以黑莓作为原料,采用溶剂萃取法进行提取,运用单因素和响应面法进行优化,旨在得到黑莓中花色苷提取的最佳工艺,并且测定花色苷的抗氧化活性和抑菌性,为黑莓中花色苷的研究奠定一定的基础。
1 材料与方法
1.1 材料与仪器
冷冻黑莓:莱阳瑞光食品有限公司,-18℃冷冻保存,备用。金黄色葡萄球菌(Staphylococcus aureus)、大肠杆菌(Escherichia coli):贵州医科大学食品科学学院微生物实验室;甲醇、乙醇、盐酸、磷酸、硫酸铁、水杨酸、过氧化氢、DPPH:均为分析纯,天津市科密欧化学试剂有限公司。
TG16-WS台式高速离心机:常州朗越仪器制造有限公司;721型紫外分光光度计:上海菁华科技仪器有限公司;DVP-9082型恒温培养箱:上海润度生物科技有限公司;PHS-3C型PH计:上海雷磁仪器有限公司;THZ-24-S型恒温摇床:上海博讯医疗生物仪器有限公司;DXM-30R型高压蒸汽灭菌锅:上海高致精密仪器有限公司。
1.2 试验方法
1.2.1 冷冻黑莓的预处理
将新鲜冷冻黑莓在常温下(20℃)解冻后,加入适量蒸馏水,用榨汁机打碎成浆,将果浆放入-18℃冰箱保存,备用。
1.2.2 单因素试验
1.2.2.1 黑莓中总花色苷提取的溶剂选择
将10 g黑莓果浆分别加入到5个100 mL的三角锥形瓶中,分别用1%盐酸-H2O、1%盐酸-乙醇、1%盐酸-甲醇、1%磷酸-甲醇、1%磷酸-乙醇,料液比为1∶4(g/mL),在温度为 35℃的恒温水浴锅中提取60 min。然后在转速为5 000 r/min的条件下离心5 min后,得到上清液,用紫外分光光度计在其最大吸收波长下测定总花色苷吸光度并计算总花色苷。
1.2.2.2 提取黑莓中总花色苷的温度选择
将10 g黑莓果浆分别加入到5个100 mL的三角锥形瓶中,提取溶剂选择1%HCl-甲醇,料液比为1∶4(g/mL),分别在 15、25、 35、45、55 ℃ 5 个不同温度的恒温水浴锅中提取60 min,然后在转速为5 000 r/min的条件下离心5min后,得到上清液,用紫外分光光度计在其最大吸收波长下测定总花色苷吸光度并计算总花色苷。
1.2.2.3 提取黑莓中总花色苷的料液比选择
将10 g黑莓果浆分别加入到5个100 mL的三角锥形瓶中,按照料液比 1∶1、 1∶2、 1∶4、 1∶6、 1∶8(g/mL),1%HCl-甲醇为提取溶剂,在温度为35℃的恒温水浴锅中提取60 min。然后在转速为5 000 r/min的条件下离心5 min后,得到上清液,用紫外分光光度计在其最大吸收波长下测定吸光度并计算总花色苷。
1.2.2.4 提取黑莓中总花色苷的时间选择
选取5个100 mL的三角锥形瓶,加入10 g黑莓果浆,分别在 40、50、 60、70、80 min,选 1%HCl-甲醇为提取溶剂,料液比为 1∶4(g/mL),在温度为 35℃水浴锅中提取60 min,然后在转速为5 000 r/min的条件下离心5 min,取上清液,用紫外分光光度计在其最大吸收波长下测定总花色苷吸光度并计算总花色苷。
1.2.3 黑莓中总花色苷含量的测定
用Okamura N等[18]、钱镭等[19]的研究方法(稍作改动)进行测定,用移液管吸取2 mL制备好的样品,分别用pH 1.0和pH 4.5的磷酸缓冲液将其稀释10倍,振荡摇匀,采用2 mL提取溶剂加18 mL的磷酸盐缓冲液作为空白对照,分别在510 nm和720 nm处测定其吸光度。总花色苷含量计算公式如下。

式中:ACY为总花色苷含量,mg/g;DV为定容体积,mL;W为样品质量,g;ε为矢车菊色素-3-葡萄糖苷的摩尔消光系数,2.96×104L/(mol·cm);M为矢车菊色素-3-葡萄糖苷的摩尔分子质量,449.2 g/mol;VF为稀释倍数;L为比色皿光程,1 cm。
1.2.4 黑莓中花色苷的提取条件响应面优化
根据单因素试验结果,运用Box-Behnken组合试验方法设计四因素三水平的试验,以总花色苷含量为响应值(R1),将响应面试验得到的数据利用Design-Expert软件进行二次多元回归拟合。试验因子及水平如表1。

表1 试验因子及水平Table 1 Experimental factors and levels
1.2.5 黑莓中总花色苷的抗氧化能力测定
1.2.5.1 DPPH自由基清除能力测定
按照参考文献[20]方法并稍作改动,采用无水乙醇溶解DPPH配制成一定浓度的混合溶液,置于棕色瓶,避光保存,备用。取5支10 mL具塞试管,将稀释为5个不同浓度的总花色苷溶液各取1 mL,再加入4 mL的DPPH混合溶液,分别测定其吸光度A。

式中:A1为样品组(样品与DPPH溶液)吸光度;A2为样品对照组(样品与无水乙醇)吸光度;A0为对照组(70%乙醇与DPPH溶液)吸光度。
1.2.5.2 羟基自由基清除能力测定
取5支10 mL具塞试管,将稀释成5个不同浓度的总花色苷粗提取液分别取1 mL加入试管,再在试管中添加9 mmol/L FeSO41 mL、9 mmol/L水杨酸-乙醇溶液2 mL,最后加入8.8 mol/L H2O22 mL,室温(20℃)下反应30 min,以蒸馏水调零,在510 nm处测定样品的吸光度A[21]。考虑到不同浓度的总花色苷溶液本身的吸光度值不同,故以不加显色剂的一组的吸光度作为本底值。
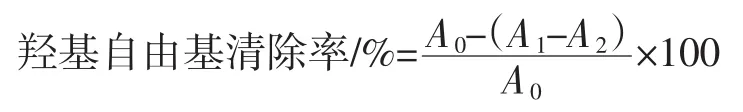
式中:A0为1 mL蒸馏水+1 mL 9 mmol/L FeSO4+1 mL 9 mmol/L水杨酸-乙醇+2 mL H2O2所测得的吸光度;A1为1 mL总花色苷溶液+1 mL 9 mmol/L FeSO4+1 mL 9 mmol/L水杨酸-乙醇+2 mL H2O2所测得的吸光度;A2为1 mL总花色苷溶液+1 mL 9 mmol/L FeSO4+1 mL 9 mmol/L水杨酸-乙醇+2 mL蒸馏水所测得的吸光度。
1.2.6 黑莓中总花色苷抑菌能力测定
1.2.6.1 供试菌种的活化
将大肠杆菌、金黄色葡萄球菌作为供试菌种,接入相应的斜面培养基上,置于37℃摇床培养箱内培养24 h,培养完之后将培养基置于0℃~4℃冷藏备用[22]。
1.2.6.2 敏感性试验
取10 mL供试菌种接种于灭菌培养基中,于37℃摇床中培养24 h,菌悬液浓度约为106CFU/mL~107CFU/mL[23]。在培养皿中倾倒25 mL已经融化的琼脂营养培养基,等冷却后将1 mL的大肠杆菌和金黄色葡萄球菌菌液涂布于培养基上,涂布均匀后,将已经灭菌的牛津杯放置于培养基上,并各取0.1 mL的样品加入牛津杯中,并置于37℃恒温培养箱中培养,24 h后,取出观察抑菌圈,以灭菌的提取溶剂为空白对照。
1.2.6.3 最小抑菌浓度试验
将已制备好的黑莓中总花色苷提取液用二倍稀释法稀释成7个不同浓度梯度的溶液,分别取1 mL于7支灭菌的试管中,加入4 mL培养基,振荡,摇匀,然后将稀释后的大肠杆菌、金黄色葡萄球菌(105CFU/mL)接种于各试管中,将试管放入37℃恒温培养24 h后,观察其生长情况,以恰好不长菌的稀释液的浓度为最小抑菌浓度(minimum inhibitory concentration,MIC)[23]。
2 结果与分析
2.1 单因素试验
2.1.1 黑莓中总花色苷的提取溶剂选择
提取溶剂对总花色苷含量的影响见图1。

图1 提取溶剂对总花色苷含量的影响Fig.1 Effect of extraction solvent on anthocyanin content
由图1可知,提取溶剂为1%的盐酸-甲醇时,总花色苷含量最高,故选择其为黑莓总花色苷提取的适宜提取溶剂。
2.1.2 黑莓中总花色苷的提取温度选择
提取温度对总花色苷含量的影响见图2。

图2 提取温度对总花色苷含量的影响Fig.2 Effect of extraction temperature on anthocyanin content
由图2结果可知,在相同条件下,随着温度的升高,总花色苷的含量相应增加。当温度达到55℃时,总花色苷含量达到最大值,这是因为升温能提高总花色苷的溶解度和扩散速度,同时有助于细胞的破坏,从而使总花色苷类物质易于从细胞内释出[24]。但是温度过高会容易导致总花色苷被氧化,故选择55℃为黑莓总花色苷提取的适宜温度。
2.1.3 黑莓中总花色苷的提取料液比选择
料液比对总花色苷含量的影响见图3。

图3 料液比对总花色苷含量的影响Fig.3 Effect of material to liquid ratio on anthocyanin content
由图3结果可知,随着提取溶剂的增多,总花色苷含量逐渐升高,当料液比达到1∶2(g/mL)时,总花色苷的含量最高。但是,当提取溶剂继续增多时,总花色苷含量开始下降,故选择料液比1∶2(g/mL)为黑莓花色苷的适宜料液比。
2.1.4 黑莓中总花色苷的提取时间选择
提取时间对总花色苷含量的影响见图4。
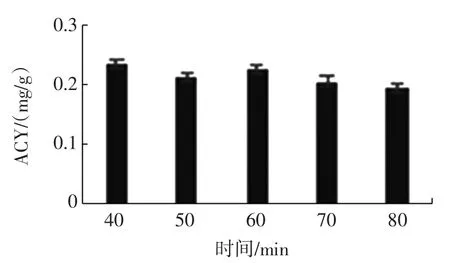
图4 提取时间对总花色苷含量的影响Fig.4 Effect of extraction time on anthocyanin content
由图4可知,在提取时间为40 min时,总花色苷含量最高,60 min次之,超过60 min时,总花色苷含量下降,故取提取时间40 min作为黑莓总花色苷的适宜提取时间。
2.2 响应面法优化试验
2.2.1 响应面法试验设计及结果
根据单因素试验结果,将黑莓中总花色苷的含量作为响应值,运用Box-Behnken中心组合试验的原理,对黑莓中总花色苷的提取工艺方法进行处理优化,试验结果见表2及表3。
将表2验数据用Design export 8.0.6软件进行二元多次回归拟合,得出二次多项回归方程如下。

表2 响应面试验方案及结果Table 2 Box-Behnken experimental design and results




表3 方差分析Table 3 Variance analysis
2.2.2 响应面试验各因素交互结果
各因素交互作用的响应面曲线见图5。


图5 各因素交互作用的响应面曲线Fig.5 Response surface curves of interaction factors
响应面图是响应值的三维曲线图,构成的响应面图坡面越陡峭,说明交互作用越明显,越平缓,则交互作用越弱[25]。综合以上,提取溶剂与提取温度、提取溶剂与提取时间、提取溶剂和料液比、提取温度和料液比交互作用显著,提取温度和提取时间、料液比和提取时间交互作用不明显。
2.2.3 验证试验
经Design Export 8.0.6软件分析得到的黑莓中总花色苷的最佳提取工艺为提取溶剂1%盐酸-甲醇、提取温度 55 ℃、料液比 1∶4(g/mL)、提取时间 60 min,模型预测总花色苷含量值为0.246 8 mg/g,按照此条件,做验证试验3次,得到总花色苷平均值为0.233 5 mg/g,与模型预测值相差2.33%,综上,应用此模型优化黑莓中总花色苷的提取工艺是可行的。
2.3 黑莓中总花色苷的抗氧化能力测定结果
2.3.1 DPPH自由基清除测定结果
本试验利用黑莓中的总花色苷粗提取液对DPPH自由基清除能力进行测定,结果如图6所示。
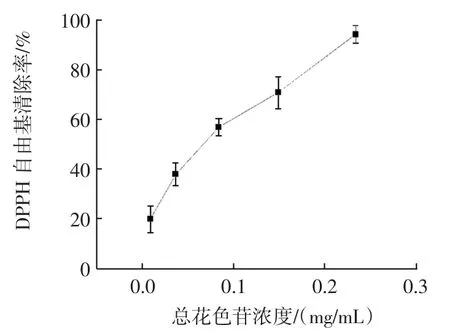
图6 黑莓总花色苷粗提取液的DPPH自由基清除率Fig.6 DPPH free radical scavenging rate of blackberry anthocyanin crude extract
由图6可知,5种不同浓度的黑莓总花色苷粗提取液都对DPPH自由基有一定的清除作用,且随着总花色苷浓度的提高,其清除率也相应增加,在总花色苷浓度为0.234 mg/mL时,其清除率达94.78%。
2.3.2 羟基自由基清除测定结果
羟基自由基是一种重要的活性氧,研究表明,人体多种疾病的发生与体内自由基的氧化密切相关,本试验利用黑莓总花色苷粗提取液对芬顿反应产生的羟基自由基进行清除力测定,结果如图7所示。

图7 黑莓总花色苷粗提取液对羟基自由基的清除率Fig.7 Scavenging rate of hydroxyl radical from anthocyanin crude extract in blackberry
如图7所示,随着总花色苷浓度的提高,羟基自由基清除率也相应提高,在总花色苷浓度为0.234 mg/mL时,清除率为93.78%。
2.4 黑莓中总花色苷的抑菌能力测定
2.4.1 敏感性试验
通过1.2.6.2的方法,获得黑莓总花色苷粗提取液对大肠杆菌和金黄色葡萄球菌生长的抑制作用结果,如图8所示。

图8 黑莓花色苷对大肠杆菌和金黄色葡萄球菌的抑制作用Fig.8 Inhibitory effects of anthocyanins on E.coli and Staphylococcus aureus
抑菌圈的有无及大小可以反映是否有抑菌作用及大小,一般抑菌作用越强,抑菌圈的直径越大。如图8所示,与对照组对比,图8a与图8b中均产生了抑菌圈,表明黑莓总花色苷对大肠杆菌和金黄色葡萄球菌的生长都有一定的抑制作用,并且对金黄色葡萄球菌的抑菌圈直径小于对大肠杆菌的抑菌圈直径,说明在同种条件下,黑莓总花色苷对大肠杆菌的抑制作用能力强于对金黄色葡萄球菌。
2.4.2 最小抑菌浓度试验
通过1.2.6.3的方法,得到黑莓总花色苷粗提取液对大肠杆菌和金黄色葡萄球菌的最小抑菌浓度如表4所示。

表4 黑莓花色苷最小抑菌浓度测定结果Table 4 Determination of minimum inhibitory concentration of anthocyanins in blackberries
由表4所示,金黄色葡萄球菌的最小抑菌浓度为0.445 mol/L,大肠杆菌的最小抑菌浓度为0.222 mol/L。
3 结论
采用响应面法优化提取黑莓总花色苷的最优条件为:提取溶剂1%HCl-甲醇、提取温度55℃、提取时间 40 min、料液比 1∶4(g/mL),提取量为 0.233 5 mg/g。黑莓中总花色苷的DPPH自由基清除率为94.78%,羟基自由基清除率为93.78%,黑莓中总花色苷对大肠杆菌和金黄色葡萄球菌都有不同程度的抑制作用,且对大肠杆菌的抑制能力强于对金黄色葡萄球菌。该方法可以为总花色苷的抗氧化活性和抑菌性提供一定的理论依据。

