沙利度胺联合美沙拉嗪和强的松治疗难治性溃疡性结肠炎疗效观察
郭晓鹤,蒯 君,朱艳丽,杨 芳,秦 蕾,杨 艳,徐泽静,秦咏梅
(新乡医学院第一附属医院消化内科,河南 卫辉 453100)
溃疡性结肠炎(ulcerative colitis,UC)是一种炎症性肠病(inflammatory bowel disease,IBD)。IBD是一种非特异性慢性肠道炎症性疾病,易反复发作。难治性溃疡性结肠炎(refractory ulcerative colitis,RUC) 即UC患者对激素类药物治疗无效或者依赖。轻中度UC患者应用氨基水杨酸制剂如美沙拉嗪就可以控制病情,但RUC患者应用美沙拉嗪和激素类药物强的松进行治疗依然不能控制病情,尚需要寻求新的治疗药物。有研究显示,沙利度胺因其抗血管生成及免疫调节作用被广泛用于肿瘤和免疫相关疾病的治疗[1]。也有一些临床实践研究发现,沙利度胺能有效缓解UC患者的消化道症状[2-4]。临床工作中发现,目前很多RUC患者应用美沙拉嗪和激素进行治疗效果仍不理想。本研究旨在探讨沙利度胺联合美沙拉嗪和强的松对RUC的治疗效果,以期为临床应用提供依据。
1 资料与方法
1.1 一般资料选择2013年9月至2018年12月新乡医学院第一附属医院收治的68例RUC患者为研究对象。纳入标准:(1)符合《炎症性肠病诊断与治疗的共识意见 2018版》中关于RUC的诊断标准[5-6];(2)经临床、结肠镜、X线钡餐及组织学检查诊断为RUC;(3)年龄25~75岁。排除标准:(1)伴有其他严重疾病;(2)有肠道手术史;(3)需要使用全肠外营养的患者;(4)有恶性肿瘤病史;(5)有接受抗肿瘤坏死因子(tumor necrosis factor,TNF)药物治疗史者;(6)妊娠或哺乳期妇女;(7)近半年内接受过免疫抑制剂治疗;(8)对沙利度胺过敏者;(9)临床资料不全者。根据治疗方法不同将患者分为对照组(n=48)和观察组(n=20)。对照组:男29例,女19例;年龄22~45(33.90±1.75)岁;病程3~84(28.14±3.93)个月。观察组:男12例,女8例;年龄17~56(33.55±7.34)岁;病程7~120(27.36±3.55)个月。2组患者的性别、年龄、病程比较差异无统计学意义(P>0.05),具有可比性。本研究经新乡医学院第一附属医院伦理委员会批准,所有患者知情同意并签署知情同意书。
1.2 治疗方法2组患者均给予口服美沙拉嗪肠溶片(葵花药业集团佳木斯鹿灵制药有限公司,国药准字H19980148)联合强的松片(天津市津津药业有限公司,国药准字 H12020036)。美沙拉嗪肠溶片每次1 g,每日3次;强的松片第1周按照0.75 mg·kg-1·d-1给予,随后每周逐渐减量(每周减5 mg)。在此基础上,观察组患者给予沙利度胺片(江苏常州制药厂有限公司,国药准字 H32026129),每次100 mg,每日1次,睡前口服。2组患者均治疗12周。
1.3 观察指标
1.3.1 临床疗效2组患者治疗12周后进行疗效判定。显效:患者腹泻、腹痛等症状完全消失,结肠镜检查见黏膜恢复正常;有效:患者临床症状明显改善,经结肠镜检查见肠道黏膜存在假息肉和轻度炎症;无效:患者临床症状无明显改善,结肠镜检查见肠道黏膜溃疡性炎症无明显改善。总有效率=(显效例数+有效例数)/总例数×100%。
1.3.2 结肠内镜下表现通过改良Mayo评分系统中的内镜评分标准评估2组患者治疗前及治疗12周的结肠内镜下表现。依据结肠内镜下表现进行评分,0分:结肠黏膜正常或无活动性病变;1分:轻度病变(红斑、血管纹理减少、轻度易脆);2分:中度病变(明显红斑、血管纹理缺乏、易脆、糜烂);3分:重度病变(自发性出血,溃疡形成)[7]。
1.3.3 血清血管内皮生长因子(vascular endothelial growth factor,VEGF)、TNF-α水平检测分别于治疗前及治疗12周后采集2组患者晨起空腹静脉血3 mL,1 000 r·min-1离心5 min,取上层血清待用。采用酶联免疫吸附试验检测血清VEGF、TNF-α水平,试剂盒购自广州聚研生物科技有限公司,严格按照试剂盒说明书进行操作。
1.3.4 不良反应观察2组患者治疗期间血常规、尿常规、肝功能、肾功能、神经系统等不良反应发生情况,并计算不良反应发生率。不良反应发生率=不良反应例数/总例数×100%。
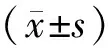
2 结果
2.1 2组患者临床疗效对照组患者显效10例,有效7例,无效31例,总有效率为35.42%(17/48);观察组患者显效4例,有效8例,无效8例,总有效率为60.00%(12/20)。观察组患者的总有效率显著高于对照组,差异有统计学意义(χ2=19.854,P<0.05)。
2.2 2组患者结肠内镜评分比较对照组和观察组患者治疗前结肠内镜Mayo评分分别为9.47±1.38 和9.84±1.12。对照组和观察组患者治疗后结肠内镜Mayo评分分别为6.89±1.27和 5.28±1.33。治疗前2组患者的Mayo评分比较差异无统计学意义(P>0.05)。2组患者治疗后的Mayo评分均显著低于治疗前,差异有统计学意义(P<0.05)。治疗后观察组患者的Mayo评分显著低于对照组,差异有统计学意义(P<0.05)。
2.3 2组患者血清VEGF、TNF-α水平比较结果见表1。治疗前2组患者血清中VEGF、TNF-α水平比较差异均无统计学意义(P>0.05)。2组患者治疗后血清中VEGF、TNF-α水平均显著低于治疗前,差异有统计学意义(P<0.05)。治疗后观察组患者血清中TNF-α、VEGF水平均显著低于对照组,差异有统计学意义(P<0.05)。

表1 2组患者治疗前后血清VEGF和TNF-α水平比较
2.4 2组患者不良反应比较2组患者治疗期间血常规、尿常规、肝功能、肾功能、神经系统均未见异常。对照组患者在治疗期间有12例出现轻度嗜睡、3例便秘、1例便血,不良反应发生率为33.33%(16/48);观察组患者在治疗期间有3例出现轻度嗜睡、2例便秘、1例便血,不良反应发生率为30.00%(6/20)。2组患者均未给予特殊处理,不良反应自行缓解。2组患者不良反应发生率比较差异无统计学意义(χ2=2.335,P>0.05)。
3 讨论
IBD包括UC和克罗恩病(Crohn′s disease,CD),其发病机制复杂,病因尚不明确,可能受遗传、环境、免疫调节功能失常、肠道感染等多种因素影响[8]。沙利度胺曾因可致胎儿畸形,被迫退出市场[9],直到1997年1例激素治疗无效的CD患者经沙利度胺治疗后症状获得改善,该药再次被医生接受[10]。有研究报道,沙利度胺具有免疫调节、抗炎、抗血管生成、抗肿瘤作用[11]。沙利度胺属于免疫调节剂,在抑制体内碱性成纤维细胞生长因子、VEGF水平等方面效果显著[12]。近年来,沙利度胺主要应用于免疫相关性肠病的治疗[13-15]。有研究发现,将沙利度胺用于治疗CD可取得较好效果,且安全性高,毒副作用小[16-17]。但目前少有沙利度胺治疗RUC的研究报道。
本研究发现,治疗后观察组患者结肠内镜Mayo评分显著低于对照组,说明沙利度胺可能在肠道黏膜愈合方面有一定的疗效。近年已有研究证实,活动期IBD患者血清TNF-α、VEGF水平显著高于缓解期IBD患者[18],说明TNF-α和VEGF在IBD的发病机制中发挥重要的作用。本研究结果显示,观察组患者总有效率显著高于对照组;2组患者治疗后血清中VEGF、TNF-α水平均显著低于治疗前;治疗后观察组患者的血清TNF-α、VEGF水平均显著低于对照组;提示沙利度胺联合美沙拉嗪和强的松治疗RUC有明显的临床效果。
沙利度胺的不良反应一般在患者服用疗程大于半年时发生,轻度不良反应例如嗜睡、便秘等可通过减量或停药缓解症状[19];少数患者不良反应表现为致畸性和周围神经病变,主要与服用疗程有关,部分在停药后可恢复正常,有些不良反应为不可逆性,可给予对症治疗缓解症状。PENG等[20]报道,沙利度胺可能导致育龄女性IBD患者卵巢储备能力下降,该作用可能会随着药物的停用消失。本研究中,2组患者治疗期间的不良反应均表现为轻度嗜睡、便秘、便血,均未给予特殊处理,自行缓解,2组患者不良反发生率比较差异无统计学意义;提示多数患者可以在严密监测下安全使用沙利度胺。
综上所述,沙利度胺可能通过降低血清中TNF-α和VEGF水平在RUC治疗中发挥作用,其价格低廉,相对安全,更具临床优势,有望成为继氨基水杨酸制剂后的一种新的治疗RUC的药物。但本研究样本量较小,随访时间短,且未对育龄女性卵巢储备功能进行监测,有待进一步大样本的研究。沙利度胺在肿瘤治疗方面有一定的疗效,但其是否能延缓RUC发展为结肠癌有待进一步研究。对于RUC以及类固醇依赖性的患者,低剂量(1.3 mg·kg-1·d-1)硫唑嘌呤可有效维持疾病缓解[21]。本研究未与免疫抑制剂,如硫唑嘌呤、甲氨蝶呤等药物进行对比研究,有待进一步研究来进行对比,为临床提供更好的治疗办法。

