高危型人乳头瘤病毒阴性宫颈癌的临床病理特征及预后分析
闫现月,韩丽萍, 孙晴晴,袁一丹
(郑州大学第一附属医院妇科,河南 郑州 450052)
宫颈癌作为最常见的妇科恶性肿瘤之一,其发病率及死亡率仅次于乳腺癌、结直肠癌和肺癌,位居全球女性恶性肿瘤第4位[1],且近年来有不断年轻化的趋势[2]。高危型人乳头瘤病毒(high risk human papillomavirus , HR-HPV)是导致宫颈癌的主要因素,在宫颈癌组织标本中HR-HPV的感染率高达99%[3],然而,HPV并不是引起宫颈病变的唯一因素,多种非HPV感染因素也在宫颈病变的发生、发展起到重要的作用[4]。已有研究[5-6]报道约4%~52%宫颈癌患者HR-HPV检测结果呈阴性,数据也表明HR-HPV感染与否影响患者的治疗效果及预后,但这类患者的病因、发病机制及临床特点尚不明确。随着HR-HPV阴性宫颈癌越发受到人们的重视,有关其临床特点及预后情况的研究也在不断开展。本次研究选取2012年7月至2015年10月在郑州大学第一附属医院治疗的宫颈癌患者,通过比较HR-HPV阴性组与HR-HPV阳性组宫颈癌患者的临床病理特征及预后特点,旨在进一步明确HR-HPV阴性宫颈癌在临床病理特征及预后方面的特异性,提高对该病的认识,以期降低宫颈癌的总体发病率和死亡率。
1 资料与方法
1.1 一般资料选取2012年7月至2015年10月经郑州大学第一附属医院初诊的HR-HPV阴性宫颈癌患者23例为观察组,同时按照13选取同时期HR-HPV阳性宫颈癌患者69例为对照组。纳入标准:首次诊断,未接受治疗;均经病理学确诊;依从性高,能接受随访者;患者及家属知情同意。排除标准:合并其他原发性恶性肿瘤、较严重内科疾病患者。
1.2 治疗方法Ⅰa~Ⅱa期宫颈癌患者采用腹腔镜下宫颈癌根治术±化和(或)放疗;Ⅱb~Ⅲ期宫颈癌患者采用化疗+放疗。
1.3 研究方法分别统计HR-HPV阴性与HR-HPV阳性宫颈癌患者的确诊年龄、初潮年龄、结婚年龄、末次产年龄、孕产次、是否绝经、临床分期、癌灶直径、病理类型、组织分化、有无淋巴结转移、淋巴脉管浸润(lymph-vascular space invasion,LVSI)情况、肌层浸润深度及5 a生存率,回顾性分析所统计的临床数据,通过对两组数据的分析比较,进一步探讨HR-HPV阴性宫颈癌独特的临床特点及预后情况。
2 结果
2.1 2组一般资料比较HR-HPV阴性组和HR-HPV阳性组患者的孕次(t=2.390,P=0.019)、流产次数(t=2.980,P=0.004)比较差异均有统计学意义。见表1。
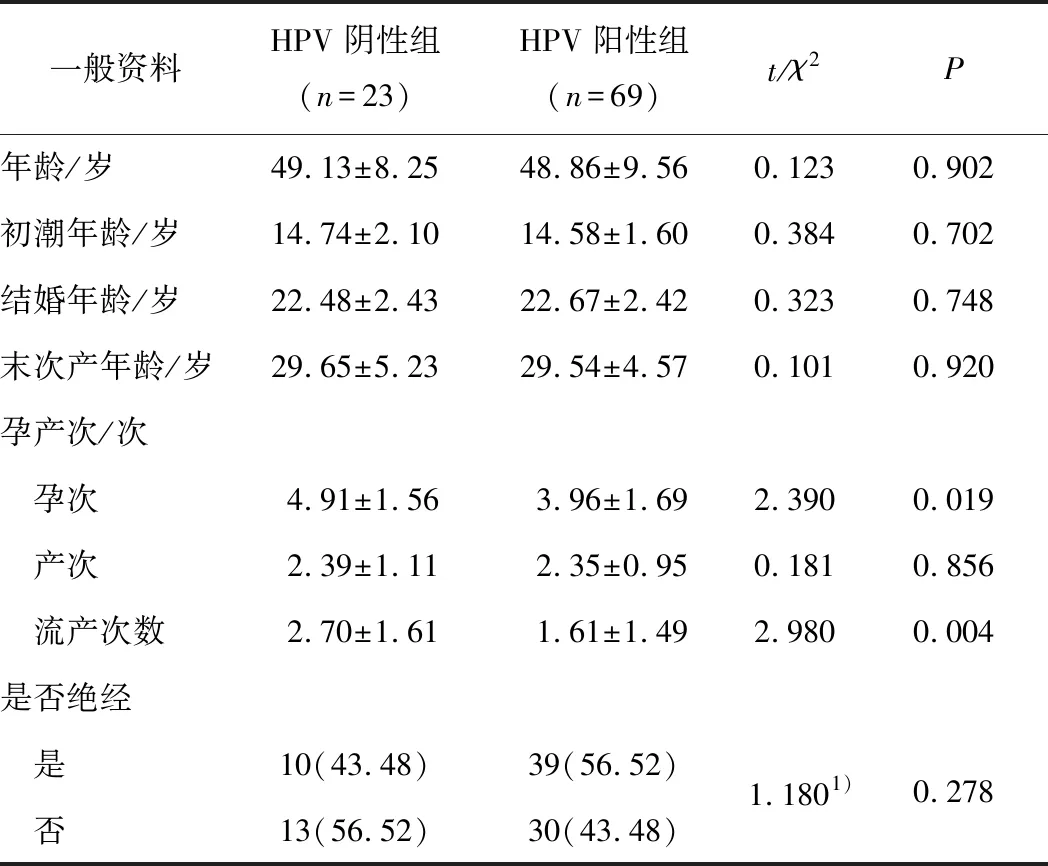
表1 2组宫颈癌患者的一般资料比较 n(%)
2.2 2组临床病理特征比较HR-HPV阴性组和HR-HPV阳性组患者的病理类型(χ2=10.320,P=0.016)、组织分化程度(Z=2.646,P=0.008)及有无淋巴结转移(χ2=6.390,P=0.011)比较差异均有统计学意义。见表2。
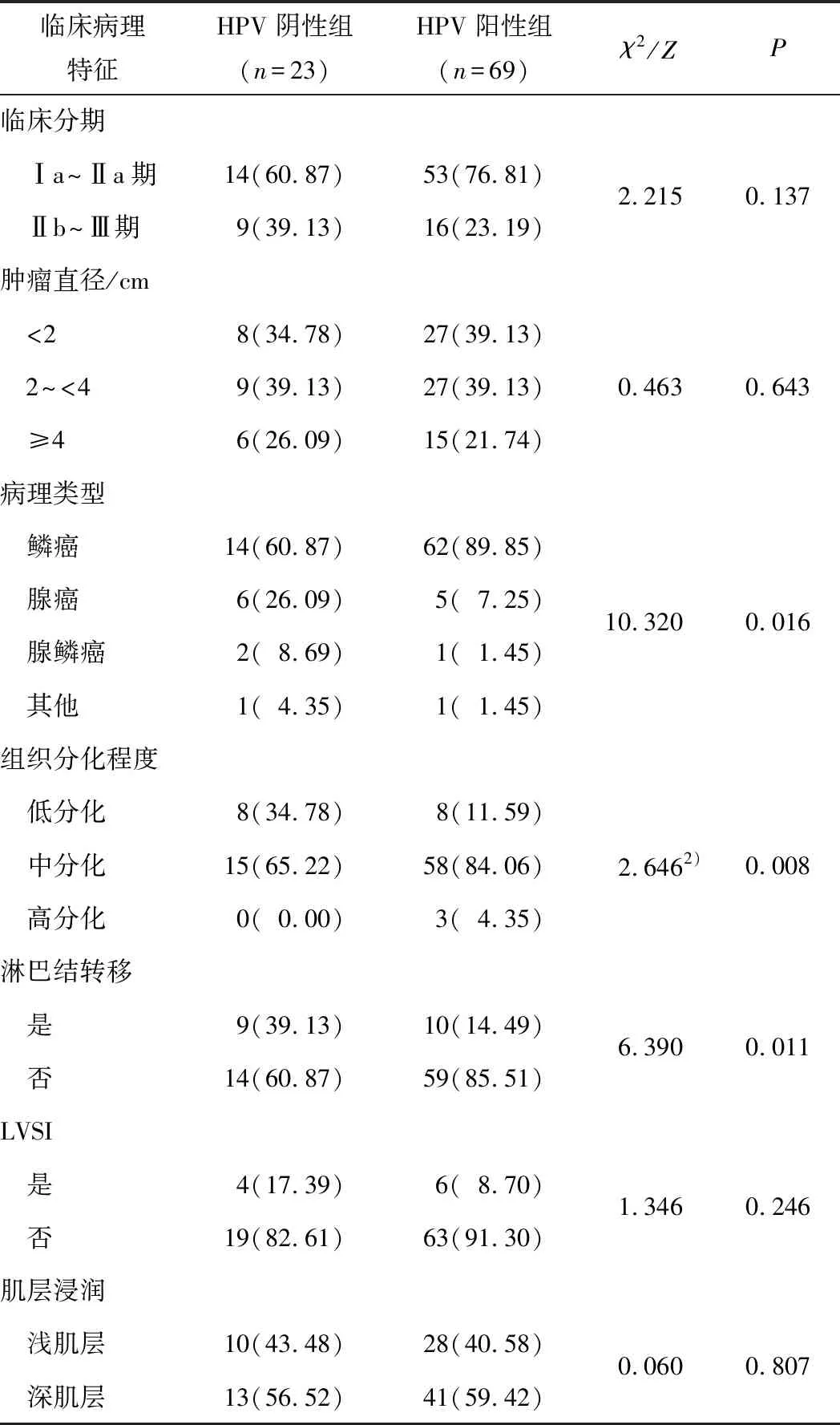
表2 2组宫颈癌患者临床病理特征比较 n(%)
2.3 2组宫颈癌患者预后比较HR-HPV阴性组和HR-HPV阳性组5 a生存率分别为52.17%和76.81%,差异有统计学意义(χ2=5.050,P=0.025)。
3 讨论
HR-HPV感染与否影响患者的治疗效果及预后,但HR-HPV阴性宫颈癌在常规筛查中易被遗漏,因此临床上早期发现存在一定的困难。HR-HPV阴性宫颈癌的发病原因及发病机制也尚不明确,针对HR-HPV阴性宫颈癌尚无明显特异性治疗方案[3]。根据目前所知文献,对HR-HPV宫颈癌检测结果为阴性的原因总结如下:1)高危型HR-HPV检测方法导致的假阴性结果[4]:标本取材不满意、检测误差等;2)目前已检测出的HR-HPV型别约有110余种,其中与肿瘤相关约20种,我们目前常用的检测方法只能检测13种高危型,不除外是这13种以外的其他型别感染导致宫颈癌变[7];3)高危型HR-HPV病毒已被机体免疫系统清除,但被清除前已经诱发了宫颈病变[7];4)宫颈病变是由除HR-HPV以外的病因导致的:目前研究认为吸烟、分娩年龄、多产次、免疫机制缺陷、单纯疱疹病毒、EB病毒以及支原体等均可能与宫颈病变的发生、发展有关[4]。此外,有研究表明宫颈细胞的基因甲基化、p53基因突变、染色体畸形等遗传方面变异均可能与宫颈病变有关[5]。
本研究数据表明:HR-HPV阴性组和HR-HPV阳性组宫颈癌患者在年龄、初潮年龄、结婚年龄、末次产年龄、产次、是否绝经、临床分期、肿瘤直径、淋巴脉管浸润及肌层浸润等方面比较差异均无统计学意义,而HR-HPV阴性组和HR-HPV阳性组患者的孕次流产次数比较差异均有统计学意义。这提示妊娠次数、流产次数增加可能是诱导HR-HPV阴性宫颈癌发生的危险因素,有相关文献提出流产次数≥1是宫颈癌发生的危险因素[8],但其具体发病机制尚不明确,可因妊娠、流产次数增加导致机体免疫功能下降,为宫颈癌变提供免疫微环境[9];也可因流产次数增加造成不同程度宫颈损伤,为宫颈癌变提供基础,目前这类病因具体发病机制尚需进一步深入研究证实。
HR-HPV阴性组和阳性组患者的临床分期、肿瘤直径、LVSI、肌层浸润等无明显差异。邹莲英等[10]的研究结果证实HPV阳性与否对肿瘤直径无影响,然而其研究中也提出HPV阴性宫颈癌宫颈旁组织更易发生深度浸润,这与本次研究结果不符。可能是随着人们的健康意识提高与宫颈排癌筛查的日益普及,宫颈癌患者能更早被发现、诊治,更早阻断宫颈癌病程进展,导致2组宫颈癌患者肌层浸润情况无明显差异。HR-HPV阴性宫颈癌患者易早期出现淋巴结转移,且组织分化较差,低分化比例较阳性组高,与相关研究结果相符[3]。2组分化差异可能与下列2个方面的因素有关:1)HR-HPV阴性宫颈癌的癌细胞分化诱导凋亡因子a的表达浓度下降,使得癌细胞的凋亡率较低,增殖速度增加;2)HR-HPV阴性宫颈癌患者的癌细胞中DNA未与HR-HPV病毒基因相整合,从而使肿瘤细胞逃脱T淋巴细胞的免疫监察[10]。HR-HPV阴性患者中腺癌所占比例明显高于高危型HR-HPV阳性患者[11],阴性组中鳞癌所占比为60.9%,腺癌26.1%,腺鳞癌8.7%;其他类型癌(神经内分泌癌+内膜样腺癌)4.3%;而阳性组中鳞癌占89.9%,腺癌7.3%,腺鳞癌1.4%,其他类型癌(大细胞癌)1.4%;(P<0.05)。An等[12]的研究证实,在一些罕见的宫颈癌病理类型(如透明细胞腺癌、中肾腺癌、子宫内膜样腺癌和宫颈微偏腺癌等)中HR-HPV检测为阴性。此外,Pirog等[13]的研究表明,91%的粘液型腺癌(颈管型、肠型和子宫内膜型)和全部腺鳞癌病例检测为HR-HPV阳性,而几例非黏液腺癌(含4例透明细胞癌、2例微小偏离型腺癌、1例浆液性癌和1例中肾管癌)检测为HR-HPV阴性。总之,HR-HPV阴性可见于部分常见宫颈腺癌及罕见病理类型的宫颈腺癌中。
根据相关研究统计,HR-HPV阴性宫颈癌患者对放、化疗敏感性差[3],术后复发、转移风险均增加,临床预后较差[14-15]。本研究结果也表明,HR-HPV阴性组宫颈癌患者的5 a生存率较HR-HPV阳性组宫颈癌患者低,考虑与其组织分化差、淋巴结高转移率、放疗和化疗不敏感等因素相关,具体原因及相关机制尚有待进一步研究证实。
综上所述,女性孕次、流产次数增加可能会提高HR-HPV阴性宫颈癌发病风险,相较于HR-HPV阳性组,HR-HPV阴性组宫颈癌中腺癌的比例更高、组织分化较差、淋巴结更易发生转移,临床预后较差。本研究局限性在于未能深入统计分析2组宫颈癌放、化疗敏感性差异。迄今为止,已有大量针对HR-HPV阳性宫颈病变的研究及讨论,而对HR-HPV阴性的宫颈病变的致病机制、基因表达特点以及个体化治疗等方面的研究尚少。希望随着HR-HPV阴性的宫颈癌相关研究的开展,能得到更多循证医学证据进一步完善其临床特点、发病机制及个体化治疗方案,为这类患者的诊治提供新思路,改善预后。

