格隆溴铵对慢性阻塞性肺疾病大鼠气道炎症和肺损伤的影响
侯云鹤 杨少朋 于超 张学艳
慢性阻塞性肺疾病(简称慢阻肺)属于慢性进行性肺部疾病,具有气流受限不完全可逆的特点,其发病因素与感染、吸烟以及氧化应激等有关,颗粒吸入以及气道炎性反应在慢阻肺疾病进展中具有重要意义。香烟燃烧产生的氧化物质可以诱发脂类以及细胞膜成分发生过氧化激活氧化应激反应,破坏细胞内DNA,引起组织细胞损伤。慢阻肺产生炎症反应特点表现为中性粒细胞、巨噬细胞水平升高,中性粒细胞介导的炎性因子水平增加会加重肺部细胞的炎症反应与组织损伤。乙酰胆碱可以缓解气道上皮细胞、巨噬细胞释放炎性因子,可能与毒蕈碱受体有关,例如噻托溴铵为毒蕈碱乙酰胆碱型受体,不仅可以舒张气道平滑肌,还可以减轻气道炎症及肺功能[1]。格隆溴铵是新式长效毒蕈碱受体拮抗剂,对慢阻肺患者的治疗效果明显[2-3],但有关格隆溴铵的作用机制研究较少。因此,本文通过制备慢阻肺大鼠模型,探索格隆溴铵对慢阻肺大鼠气道炎症与肺组织的影响以及可能存在的作用机制,为慢阻肺临床用药提供参考依据。
1 材料和方法
1.1 试剂及仪器 格隆溴铵(赫澎上海生物科技有限公司),肿瘤坏死因子-α(tumor necrosis factor-alpha,TNF-α)ELISA KIT(上海信帆生物科技有限公司),角质形成细胞衍生趋化因子(keratinocyte-derived chemokine,KC)ELISA KIT(上海奥陆生物科技有限公司)、还原型谷胱甘肽(reduced glutathione,GSH)ELISA KIT(上海晶抗生物工程有限公司)、兔抗鼠基质金属蛋白酶9(matrix metalloproteinases-9,MMP-9)、基质金属蛋白酶抑制物-1(matrix metalloproteinase inhibitor-1,TIMP-1)抗体(武汉菲恩生物科技有限公司),显微镜(Ti2-U,NIKON),切片机(HM 340E,赛默飞),超声雾化器(S-888E,南京道芬电子有限公司)。
1.2 动物及分组 SPF级SD雄性健康大鼠30只,4~5周龄,体质量190~210 g,购于南方医科大学,生产许可证号SCXK(粤)2016-0041,适应性饲养1周,温度20~25℃,湿度40%~50%,人工光照昼夜时间各12 h,饮水自由。采用随机数字表将SD大鼠均分为对照组、模型组、干预组,每组各10只。研究时间为2019年3月至6月。
1.3 实验方法 模型制备[4]以及给药方法[5-6]:将模型组、干预组大鼠于造模第1天、第14天时麻醉,插入气管,向气管内注入LPS 200μg/200μL,将大鼠左右旋转,使LPS进入大鼠肺组织,对照组注入等体积的生理盐水;于2~12 d、15~28 d时,模型组、干预组大鼠置于密闭箱中进行烟熏,每日熏15支烟,每天烟熏5次,每次持续30 min,对照组除不作烟熏处理外,其余操作相同;干预组大鼠在2~12 d、15~28 d阶段进行烟熏前30 min,根据格隆溴铵成年人使用的最大剂量以及大鼠、成人药物折算系数(W)6.25进行换算,将格隆溴铵8μg溶于10 mL生理盐水,采用大鼠雾化给药仪进行雾化吸入治疗10 min,模型组吸入等体积的生理盐水。
1.4 指标检测 各组大鼠于实验第29天时开始进行各项指标检测,1%戊巴比妥钠45 mg/kg腹腔注射麻醉处死各组大鼠,开胸,右下叶肺进行结扎,注入无菌预冷PBS进行支气管肺泡灌洗,灌洗3次,灌洗液于4℃2 500 r/min离心10 min,收集上清用于ELISA法检测TNF-α、KC、GSH含量,操作流程按照试剂盒说明书进行,沉淀进行刘氏染色液,用于白细胞计数分类。大鼠开胸后,取一部分左肺迅速置于液氮中,于-80℃超低温冰箱保存,用于肺组织中蛋白、基因表达量检测;另一部分左肺置于4%甲醛中性溶液中固定,用于肺组织病理结构观察。
1.4.1 HE染色 取已固定大鼠肺组织用于常规石蜡切片,苏木精、伊红染色、脱水、透明、固定封片,显微镜下观察各组大鼠肺组织结构变化以及组织炎症浸润情况,参照文献等[7]对气管、血管、肺间质周围炎性组织浸润程度进行评分,每个视野中炎症细胞数目为0视为无炎症(0分)、每个视野中炎症细胞数目<10个视为轻度炎症(1分)、每个视野中炎症细胞数目为10~25个视为中度炎症(2分)、每个视野中炎症细胞数目>25个视为重度炎症(3分)。
1.4.2 Western blot 提取肺组织总蛋白,调整蛋白质浓度,经SDS-PAGE电泳、膜转移至PVDF膜,加入MMP-9、TIMP-1、Western blot检测蛋白水平的内参(GAPDH)一抗,于4℃条件下孵育过夜,TBST漂洗40 min,加入经HRP标记的二抗继续孵育1 h,根据ECL试剂盒说明书对蛋白条带进行显影、定影,观察各组蛋白条带成像情况,并进行蛋白条带分析。
1.4.3 RT-PCR 采用trizol法提取肺组织的总RNA,根据逆转录cDNA试剂盒说明书逆转录生成cDNA,参考RT-PCR试剂盒说明书进行PCR反应体系配比、扩增体系设置,所用内参基因及MMP-9、TIMP-1引物均有上海生工提供,以2-△△Ct计算目标基因的相对表达量。
1.5 统计学分析 采用SPSS 22.0软件,计量资料以(±s)形式表示,若各组数据均满足正态分布且方差齐,采用单因素分析,两两比较采用LSD-t检验;若为非正态分布数据则采用非参数Mann-Whitney U检验,检验水准ɑ=0.05。
2 结果
2.1 格隆溴铵对大鼠肺组织的影响 取各组大鼠肺组织进行病理组织学观察,结果显示,与对照组相比,模型组、干预组大鼠气管周围、血管周围、肺间质周围炎症情况评分均明显升高(P<0.05);与模型组相比,干预组大鼠气管周围、血管周围、肺间质周围炎症情况评分均明显降低(P<0.05);对照组大鼠肺组织结构正常,肺泡结构整齐且无融合现象,无炎性细胞浸润,模型组大鼠的肺组织细胞有炎症浸润,出现肺泡融合现象,干预组大鼠肺组病理情况较模型组有缓解,见表1,见图1。

图1 格隆溴铵对大鼠肺组织的影响(×200)
表1 各组大鼠肺组织病理学情况比较(±s) 单位:分

表1 各组大鼠肺组织病理学情况比较(±s) 单位:分
注:与对照组比较,a P<0.05;与模型组比较,b P<0.05。
?组别 例数 气管周围 血管周围 肺间质周围对照组 10 0.20±0.02 0.21±0.04 0.24±0.05模型组 10 2.36±0.24a 1.97±0.13a 1.92±0.17a干预组 10 1.52±0.22ab 1.20±0.19ab 1.10±0.16ab F值 334.286 427.710 371.439 P值 <0.001 <0.001 <0.001
2.2 格隆溴铵对大鼠BALF中TNF-α、KC、GSH水平的影响 各组大鼠BALF中的TNF-α、KC、GSH检测结果显示,与对照组相比,模型组、干预组大鼠BALF中的TNF-α、KC含量均明显升高(P<0.05),而GSH水平明显降低(P<0.05);与模型组相比,干预组大鼠BALF中的TNF-α、KC含量均明显降低(P<0.05),而GSH水平明显升高(P<0.05),见表2。
表2 格隆溴铵对大鼠BALF中TNF-α、KC、GSH水平的影响(±s)
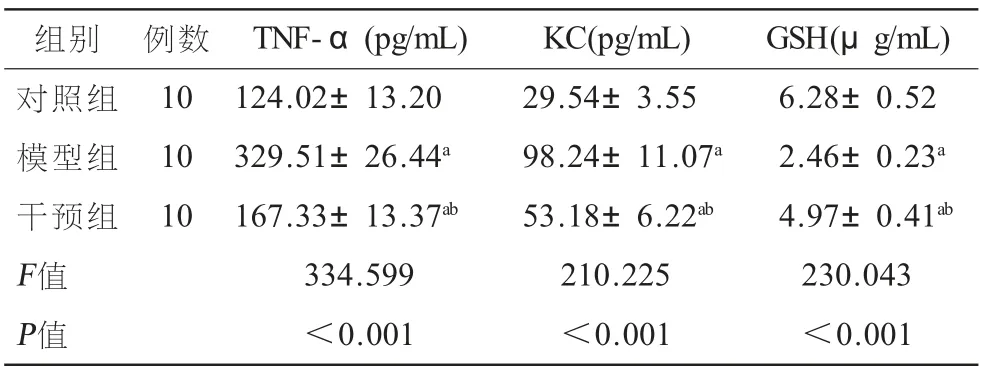
表2 格隆溴铵对大鼠BALF中TNF-α、KC、GSH水平的影响(±s)
注:TNF-α=肿瘤坏死因子-α,KC=角质形成细胞衍生趋化因子,GSH=还原型谷胱甘肽;与对照组比较,a P<0.05;与模型组比较,b P<0.05。
?组别 例数 TNF-α(pg/mL) KC(pg/mL) GSH(μg/mL)对照组 10 124.02±13.20 29.54±3.55 6.28±0.52模型组 10 329.51±26.44a 98.24±11.07a 2.46±0.23a干预组 10 167.33±13.37ab 53.18±6.22ab 4.97±0.41ab F值 334.599 210.225 230.043 P值 <0.001 <0.001 <0.001
2.3 格隆溴铵对大鼠BALF细胞计数的影响 对各组大鼠BALF液中细胞分类进行检测,结果显示,与对照相比,模型组与干预组BALF液中的细胞总数、中性粒细胞百分比均明显升高(P<0.05),而淋巴细胞百分比、单核细胞百分比均明显降低(P<0.05);与模型组相比,干预组BALF液中的细胞总数、中性粒细胞百分比均明显降低(P<0.05),而淋巴细胞百分比、单核细胞百分比均明显升高(P<0.05),见表3。
表3 格隆溴铵对大鼠BALF有核细胞计数的影响(±s)
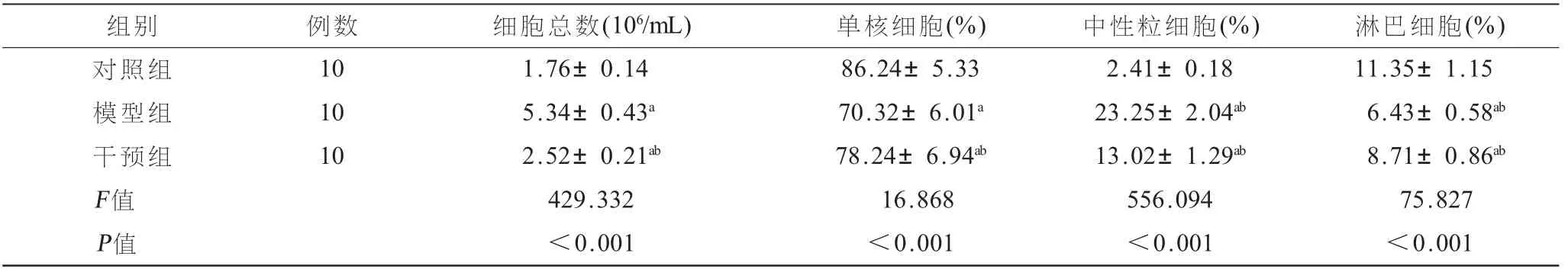
表3 格隆溴铵对大鼠BALF有核细胞计数的影响(±s)
注:与对照组比较,a P<0.05;与模型组比较,b P<0.05。
组别 例数 细胞总数(106/mL) 单核细胞(%) 中性粒细胞(%) 淋巴细胞(%)对照组 10 1.76±0.14 86.24±5.33 2.41±0.18 11.35±1.15模型组 10 5.34±0.43a 70.32±6.01a 23.25±2.04ab 6.43±0.58ab干预组 10 2.52±0.21ab 78.24±6.94ab 13.02±1.29ab 8.71±0.86ab F值 429.332 16.868 556.094 75.827 P值 <0.001 <0.001 <0.001 <0.001?
2.4 格隆溴铵对大鼠肺组织MMP-9、TIMP-1表达水平的影响 取各组大鼠肺组织用于MMP-9、TIMP-1表达水平检测,Western blot检测结果显示模型组、干预组大鼠肺组织中MMP-9、TIMP-1蛋白水平均明显高于对照组(P<0.05),干预组大鼠肺组织中MMP-9、TIMP-1蛋白水平均明显低于模型组(P<0.05);RT-PCR检测结果显示模型组、干预组大鼠肺组织中MMP-9 mRNA、TIMP-1 mRNA水平均明显高于对照组(P<0.05),而干预组大鼠肺组织中MMP-9 mRNA、TIMP-1 mRNA水平均明显低于模型组(P<0.05),见表4,见图2。

图2 各组大鼠肺组织MMP-9、TIMP-1蛋白水平凝胶成像结果
表4 格隆溴铵对大鼠肺组织MMP-9、TIMP-1表达水平的影响(±s)

表4 格隆溴铵对大鼠肺组织MMP-9、TIMP-1表达水平的影响(±s)
注:MMP-9=基质金属蛋白酶9,TIMP-1=基质金属蛋白酶抑制物-1;与对照组比较,a P<0.05;与模型组比较,b P<0.05。
组别 例数 MMP-9 TIMP-1 MMP-9 mRNA TIMP-1 mRNA对照组 10 0.34±0.06 0.26±0.05 1.02±0.05 1.06±0.04模型组 10 0.87±0.06a 0.96±0.06a 2.01±0.08a 1.89±0.05a干预组 10 0.52±0.05ab 0.49±0.06ab 1.42±0.06ab 1.29±0.06ab F值 224.639 393.711 595.280 715.455 P值 <0.001 <0.001 <0.001 <0.001?
3 讨论
慢阻肺气流受限并以进行性的方式发展,吸入有害颗粒、吸烟是慢阻肺发病的重要因素。本研究通过LPS经气管注入以及烟熏暴露用于慢阻肺大鼠模型制备,其肺组织病理结果显示慢阻肺大鼠存在气道炎症反应,并且肺组织有损伤情况。慢阻肺主要治疗药物为支气管扩张剂,抗胆碱能药物也具有扩张支气管作用。格隆溴铵为新研发长效抗胆碱能药物,属于长效季铵类毒蕈碱受体拮抗剂,其对人M3受体选择性高于对人M2受体的选择性。目前已有研究显示格隆溴铵经人口吸入后5 min能够达到血浆浓度峰值,90%被肺组织吸收,剩余被胃肠吸收,慢阻肺患者使用1周后,其药代动力学保持稳定[8]。慢阻肺确切病理机制尚未阐明,但炎症反应、氧化应激在慢阻肺进展中具有重要作用[9]。慢阻肺气道炎症会刺激气道上皮细胞分泌炎性因子,促进中性粒细胞、巨噬细胞聚集,加重气道组织细胞损伤[10]。TNF-α能够促进气道黏液细胞黏液基因表达、呼吸爆发,加重气道损伤程度,还可以通过刺激机体支气管上皮细胞分泌IL-8[11]。IL-8可以通过促进T淋巴细胞、中性粒细胞聚集活化参与炎症反应[12]。KC功能与人IL-8相似,能够向呼吸道转移、活化,加重气道炎症[13]。机体自由基的产生、消除在正常生理活动下处于动态平衡,GSH水平降低可使组织细胞易受氧化剂攻击,其含量变化也显示机体抗自由基能力[14]。本研究显示格隆溴铵干预可以降低慢阻肺大鼠BALF中细胞总数、中性粒细胞所占百分比,升高淋巴细胞与单核细胞所占百分比。单淑香等[15]研究显示噻托溴铵可以降低慢阻肺大鼠的中性粒细胞水平,本研究结果与前人研究结果相似,推测格隆溴铵对慢阻肺大鼠肺组织炎症的改善作用,可能是通过调整慢阻肺大鼠肺组织中白细胞分类比例,影响炎性因子释放,从而调节机体炎症反应。
MMPs含量升高可以引起气道外细胞外基质破坏,引起气道重塑。慢阻肺促进巨噬细胞聚集、炎性因子分泌,刺激机体产生过多MMP-9,基质发生降解,影响气道重塑。TIMP-1具有促进平滑肌细胞、成纤维细胞等细胞增生,促进平滑肌细胞间质、肌层增厚。正常生理状态下MMP-9在肺组织呈微量表达,当受到刺激因素作用时,支气管上皮细胞、纤维原细胞、平滑肌细胞及内皮细胞等细胞均能产生MMP-9,促进气道重塑[16-17]。本研究结果显示格隆溴铵可以降低慢阻肺大鼠肺组织MMP-9、TIMP-1蛋白及基因表达量。张鹏飞等[18]研究显示银杏叶提取物可以通过降低MMP-9、TIMP-1蛋白水平,从而预防、减少慢阻肺大鼠肺组织重塑与纤维化。本研究结果与前人研究结果相似,推测格隆溴铵对慢阻肺大鼠肺组织的重塑有抑制作用,可能通过降低慢阻肺大鼠肺组织MMP-9、TIMP-1表达水平实现。
综上所述,格隆溴铵对慢阻肺大鼠的气道炎症有一定的改善作用,可能与调节炎性因子水平有关;还可以通过调节大鼠肺组织中的MMP-9、TIMP-1表达水平影响肺组织的重塑,实现对慢阻肺大鼠的肺组织保护作用。

