生蒲黄标准汤剂质量评价
谢冉,郝单丽,易红,臧琛,陈燕军,赵庆贺 中国中医科学院中药研究所,北京 100700
蒲黄为香蒲科植物水烛香蒲Typha angustifoliaL.、东方香蒲Typha orientalisPresl或同属植物的干燥花粉[1]。蒲黄的炮制方法有蒸、焙、纸包炒、炒黄、炒炭等,2015年版《中华人民共和国药典》(一部)收载蒲黄饮片为生蒲黄和蒲黄炭,用于各类瘀血证和出 血证。研究表明,蒲黄具有降血脂、调节糖代谢、改善心脑血管功能、抗炎等作用[2-3],有效成分主要有黄酮类化合物、鞣质、有机酸、多糖类、烷烃类等[4]。其中,黄酮苷类成分香蒲新苷和异鼠李素-3-O-新橙皮苷含量最高[5-6],为蒲黄质量控制的指标成分。
国家药典委员会《中药配方颗粒质量控制与标准制定技术要求(征求意见稿)》(以下简称《技术要求》)明确提出了“标准汤剂”概念。中药饮片标准汤剂是以中医理论为指导、临床应用为基础,参考现代提取方法,经标准化工艺制备而成的单味中药饮片水煎剂,用于标准化临床用药,保障用药的准确性和剂量的一致性。中药饮片标准汤剂是在传统中药的大生产过程中,为保证临床疗效不降低、毒性不增加而设计的一个中间过渡对照物[7-9]。
本研究收集12批蒲黄样品,按照《技术要求》和《中药饮片标准汤剂研究策略》[7]推荐方法制备标准汤剂,测定饮片和标准汤剂中香蒲新苷和异鼠李素- 3-O-新橙皮苷的含量,标定主要工艺参数,建立标准汤剂指纹图谱,并进行聚类分析和主成分分析,建立生蒲黄标准汤剂的质量评价方法,为蒲黄相关中药制剂的质量控制提供参考。
1 仪器与试药
Agilent 1200高效液相色谱仪(HP真空脱气泵,HP四元泵,HP自动进样,HP柱温箱,HPLC-DAD检测器),安捷伦科技有限公司;Mettler Toledo-XS105型电子分析天平,瑞士梅特勒-托利多仪器(中国)有限公司;KQ5200DE型超声波清洗器(功率200 W,频率40 kHz),昆山市超声仪器有限公司;JA2003型电子天平,上海舜宇恒平科学仪器有限公司;TG16- WS型台式高速离心机,湖南湘仪;FE20型实验室pH计,Mettler-Toledo公司。
香蒲新苷(含量以97.0%计,批号111573-201405)、异鼠李素-3-O-新橙皮苷(含量以93.2%计,批号112571-201205),中国食品药品检定研究院;甲醇、乙腈为色谱纯(Fisher),其他试剂为分析纯。12批蒲黄样品,采自河北、江苏、内蒙古、山东,经中国中医科学院中药研究所何希荣鉴定,为香蒲科植物水烛香蒲Typha angustifoliaL.、东方香蒲Typha orientalisPresl或同属植物的干燥花粉,样品来源信息见表1。
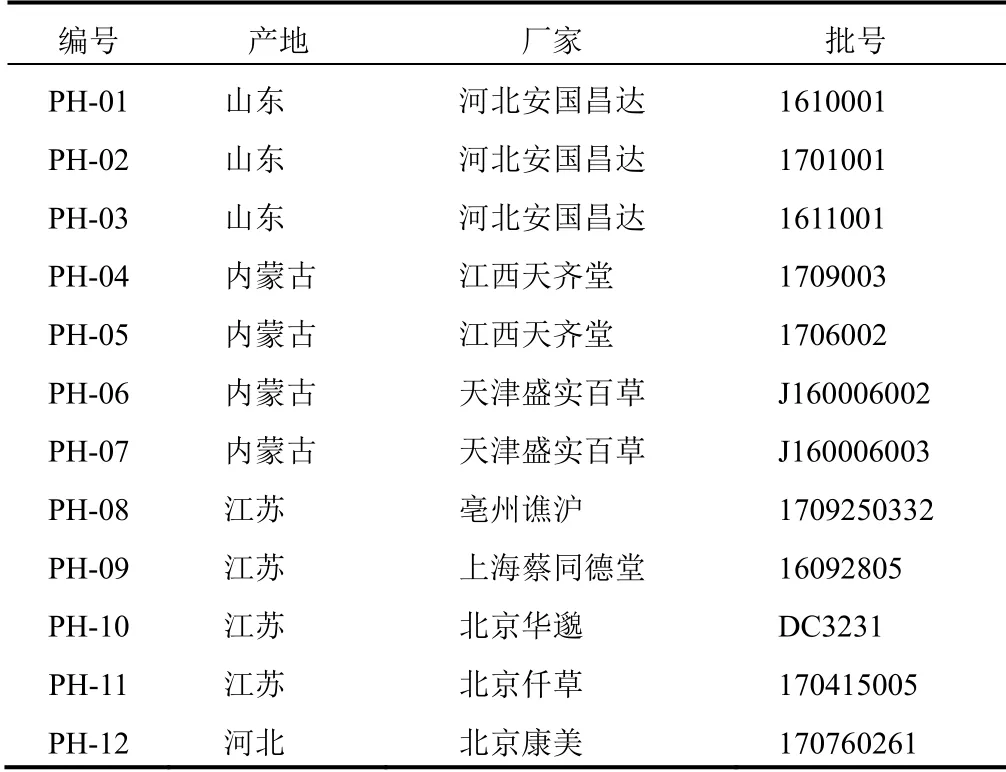
表1 蒲黄样品来源信息
2 方法与结果
2.1 指标成分含量测定
2.1.1 色谱条件
采用Welch XB-C18色谱柱(4.6 mm×250 mm,5 μm),流动相为乙腈-0.05%磷酸溶液(15∶85),柱温30 ℃,流速1.0 mL/min,检测波长254 nm。色谱图见图1。理论塔板数按香蒲新苷和异鼠李素-3-O-新橙皮苷峰计算应不低于5 000。
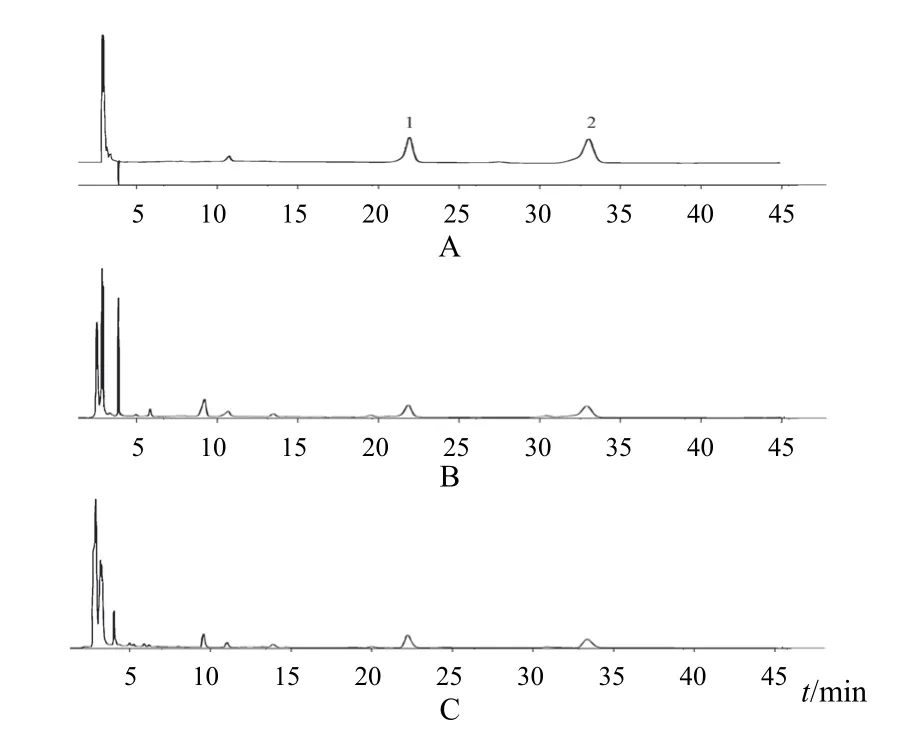
图1 生蒲黄饮片和标准汤剂2种指标成分HPLC图
2.1.2 溶液制备
2.1.2.1 饮片供试品溶液
取生蒲黄饮片粉末(过4号筛)约0.5g,精密称定,置具塞锥形瓶中,精密加入甲醇50 mL,称定质量,加热回流1 h,放冷,再称定质量,用甲醇补足减失的质量,摇匀,0.45 µm滤膜过滤,取续滤液,即得。
2.1.2.2 标准汤剂供试品溶液
称取生蒲黄饮片100g,置于2 000 mL圆底烧瓶中,加1 200 mL水,充分润湿,放置浸泡30 min,加热煮沸后回流提取30 min,趁热过滤,滤渣加1 000 mL水,回流提取20 min,趁热过滤,合并2次滤液,60 ℃水浴浓缩至500 mL,即得0.2 g/mL生蒲黄标准汤剂。精密吸取生蒲黄标准汤剂1 mL,超声处理5 min,12 000 r/min离心5 min,0.45 μm滤膜过滤,取续滤液,即得。
2.1.2.3 对照品溶液制备
分别取经五氧化二磷减压干燥36 h的香蒲新苷和异鼠李素-3-O-新橙皮苷对照品适量,精密称定,加甲醇分别制成香蒲新苷0.94 mg/mL、异鼠李素-3-O-新橙皮苷1.0 mg/mL的溶液。取以上2种对照品溶液,混合,即得混合对照品溶液。
2.1.3 方法学考察
2.1.3.1 线性关系考察
分别精密吸取香蒲新苷、异鼠李素-3-O-新橙皮苷对照品溶液1.0 mL,置100、50、25、10、5、2 mL容量瓶中,加甲醇定容至刻度。按“2.1.1”项下色谱条件进样测定,分别以香蒲新苷、异鼠李素-3-O-新橙皮苷峰面积积分值为纵坐标,对照品进样量(μg)为横坐标,制作标准曲线,计算回归方程。香蒲新苷回归方程Y=444.42X-102.56,R2=0.998 1,线性范围为0.377 2~18.86 μg;异鼠李素-3-O-新橙皮苷回归方程Y=618.02X-182.41,R2=0.998 7,线性范围为0.403 6~20.18 μg。
2.1.3.2 精密度试验
取同一批生蒲黄标准汤剂供试品溶液,按“2.1.1”项下色谱条件进样,连续6次,测定并计算香蒲新苷和异鼠李素-3-O-新橙皮苷峰面积RSD分别为0.22%和0.29%,表明仪器精密度良好。
2.1.3.3 稳定性试验
精密量取生蒲黄标准汤剂供试品溶液适量,按“2.1.1”项下色谱条件,分别于制备后0、2、4、8、12、24 h进样,测定并计算香蒲新苷和异鼠李素-3-O-新橙皮苷峰面积RSD分别为0.46%和0.94%,表明供试品溶液在24 h内稳定。
2.1.3.4 重复性试验
精密量取生蒲黄标准汤剂适量,平行制备6份供试品溶液,按“2.1.1”项下色谱条件进样,测定并计算香蒲新苷和异鼠李素-3-O-新橙皮苷峰面积RSD分别为0.25%和1.27%,表明本方法重复性良好。
2.1.3.5 加样回收率试验
精密称取同一批已知含量的供试品,分别精密加入等量香蒲新苷对照品,制备供试品溶液,按“2.1.1”项下色谱条件测定,结果香蒲新苷平均回收率为100.04%,RSD=3.05%。同法向供试品中加入异鼠李素-3-O-新橙皮苷对照品,测定并计算异鼠李素-3-O-新橙皮苷平均回收率为102.8%,RSD=2.12%。表明本法准确度良好。
2.1.4 样品测定
2.1.4.1 指标成分含量及转移率测定
分别精密吸取对照品溶液20 µL、饮片供试品溶液20 µL、标准汤剂供试品溶液10 µL,注入高效液相色谱仪,按“2.1.1”项下色谱条件测定香蒲新苷和异鼠李素-3-O-新橙皮苷含量,计算指标成分转移率。转移率(%)=W/M×100%。式中,W为标准汤剂中的含量(mg),M为饮片中的含量(mg)。
2.1.4.2 pH值及出膏率测定
取标准汤剂,用pH计测定pH值。
精密吸取混合均匀的标准汤剂10 mL于已恒重的蒸发皿中,水浴蒸干,105 ℃烘干3 h,取出,置干燥器中冷却30 min,称定质量,计算出膏率。出膏率(%)=(w×V)/(v×M)×100%。式中,M为样品量(g),V为标准汤剂体积(mL),v为取样体积(mL),w为取样所得干膏量(g)。
2.1.4.3 样品测定结果
12批生蒲黄标准汤剂的平均出膏率为11.79%±1.29%,香蒲新苷的平均转移率为79.41%±13.9%,异鼠李素-3-O-新橙皮苷的平均转移率为58.66%±18.8%,pH值为5.4~6.4,见表2。结果表明生蒲黄标准汤剂质量均一。所有批次样品中香蒲新苷和异鼠李素-3-O-新橙皮苷质量分数之和均大于0.5%,符合2015年版《中华人民共和国药典》规定。
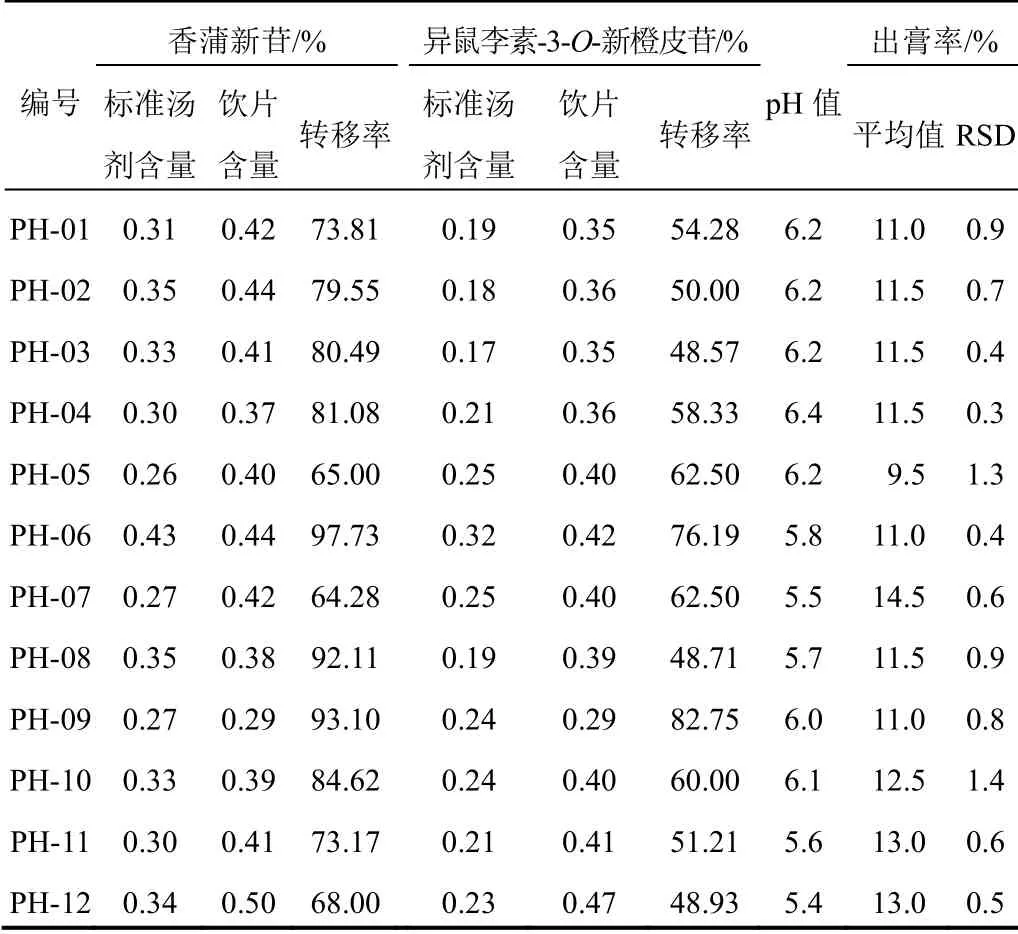
表2 生蒲黄标准汤剂主要指标测定结果
2.2 标准汤剂指纹图谱
2.2.1 色谱条件
以十八烷基硅烷键合硅胶为填充剂,以乙腈为流动相A、0.05%磷酸溶液为流动相B,梯度洗脱(0~10 min,5%~10%A;10~15 min,10%~15%A;15~35 min,15%A;35~45 min,15%~31.5%A),柱温30 ℃,流速1.0 mL/min,检测波长254 nm。理论塔板数按香蒲新苷和异鼠李素-3-O-新橙皮苷计算应不低于5 000。
2.2.2 对照品溶液制备
取香蒲新苷、异鼠李素-3-O-新橙皮苷对照品适量,精密称定,加甲醇制成每1 mL含香蒲新苷、异鼠李素-3-O-新橙皮苷50μg的混合溶液,即得。
2.2.3 供试品溶液制备
同“2.1.2.2”项下。
2.2.4 方法学考察
2.2.4.1 精密度考察
取同一批供试品溶液,按“2.2.1”项下色谱条件进样,连续6次,测定并计算4号峰峰面积,结果RSD=0.15%,表明仪器精密度良好。
2.2.4.2 稳定性试验
精密量取标准汤剂适量,制备供试品溶液,按“2.2.1”项下色谱条件,分别于制备后0、2、4、8、12、24 h进样测定,计算4号峰峰面积,结果RSD=0.42%,表明24 h内供试品溶液稳定性良好。
2.2.4.3 重复性试验
精密量取生蒲黄标准汤剂适量,平行制备6份供试品溶液,按“2.2.1”项下色谱条件进样,测定并计算4号峰峰面积,结果RSD=0.45%,表明本方法重复性良好。
2.2.5 指纹图谱建立
按“2.2.1”项下色谱条件,分别精密吸取12批生蒲黄标准汤剂供试品溶液10 μL,注入高效液相色谱仪,记录色谱峰信息。使用国家药典委员会《中药色谱指纹图谱相似度评价系统》(2004A版)对色谱图进行分析,以PH-01为参照图谱,采用平均数法生成对照图谱,时间宽度为0.10 min。标准汤剂及对照图谱见图2、图3。共有峰共7个,通过对照品比对指认2个峰,分别为4号峰香蒲新苷和5号峰异鼠李素-3-O-新橙皮苷。
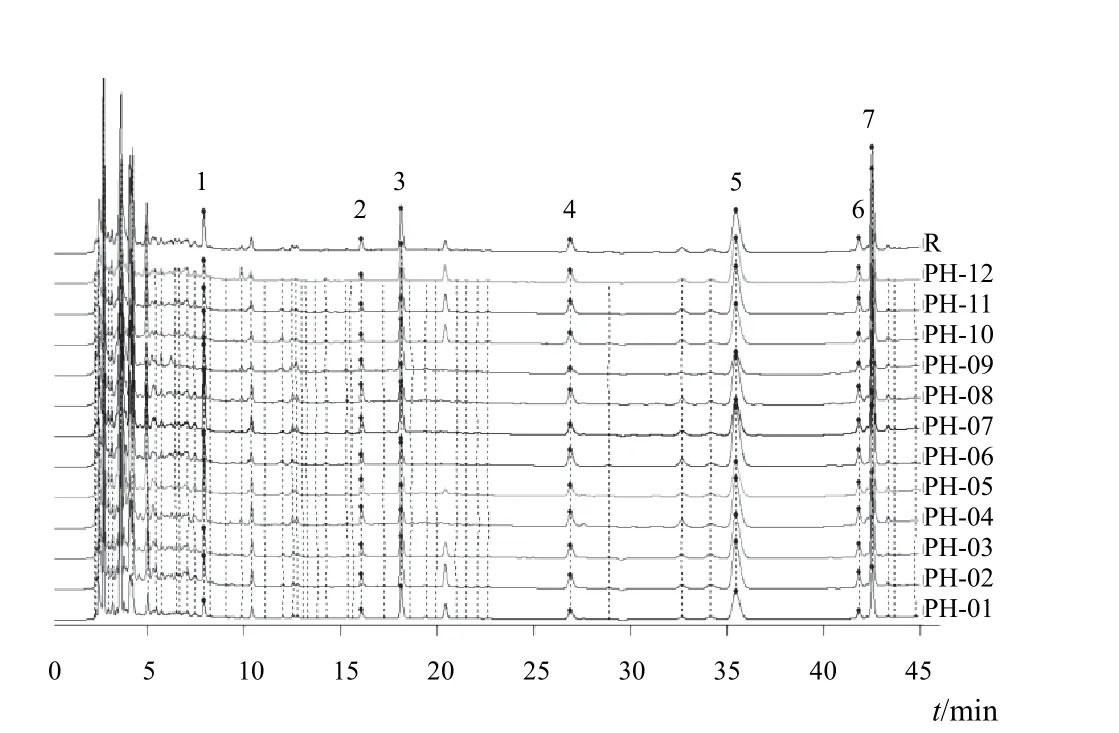
图2 12批生蒲黄标准汤剂指纹图谱
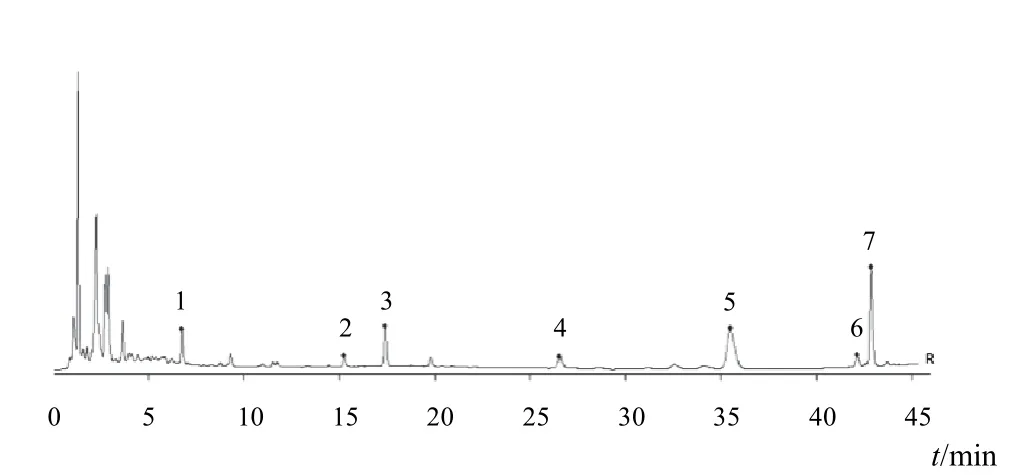
图3 生蒲黄标准汤剂指纹图谱共有峰
2.2.6 相对保留时间及相对峰面积测定
对照图谱中,7号峰面积最大,且保留时间稳定,故选择7号峰为参照峰,保留时间及峰面积设为1.00,计算各峰的相对保留时间和相对峰面积,结果见表3。
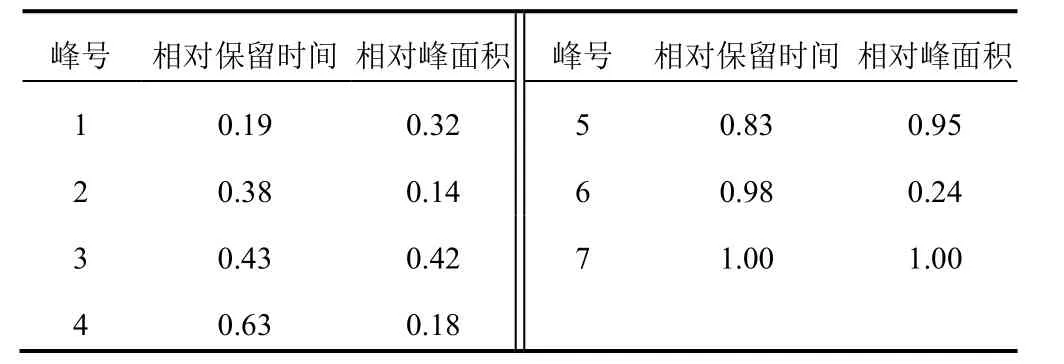
表3 生蒲黄标准汤剂指纹图谱各共有峰相对保留时间和相对峰面积
2.2.7 相似度评价
采用国家药典委员会《中药色谱指纹图谱相似度评价系统》(2004A版)进行相似度分析,12批标准汤剂指纹图谱相似度见表4。结果表明,除PH-09外,其他11批标准汤剂具有较好的一致性。
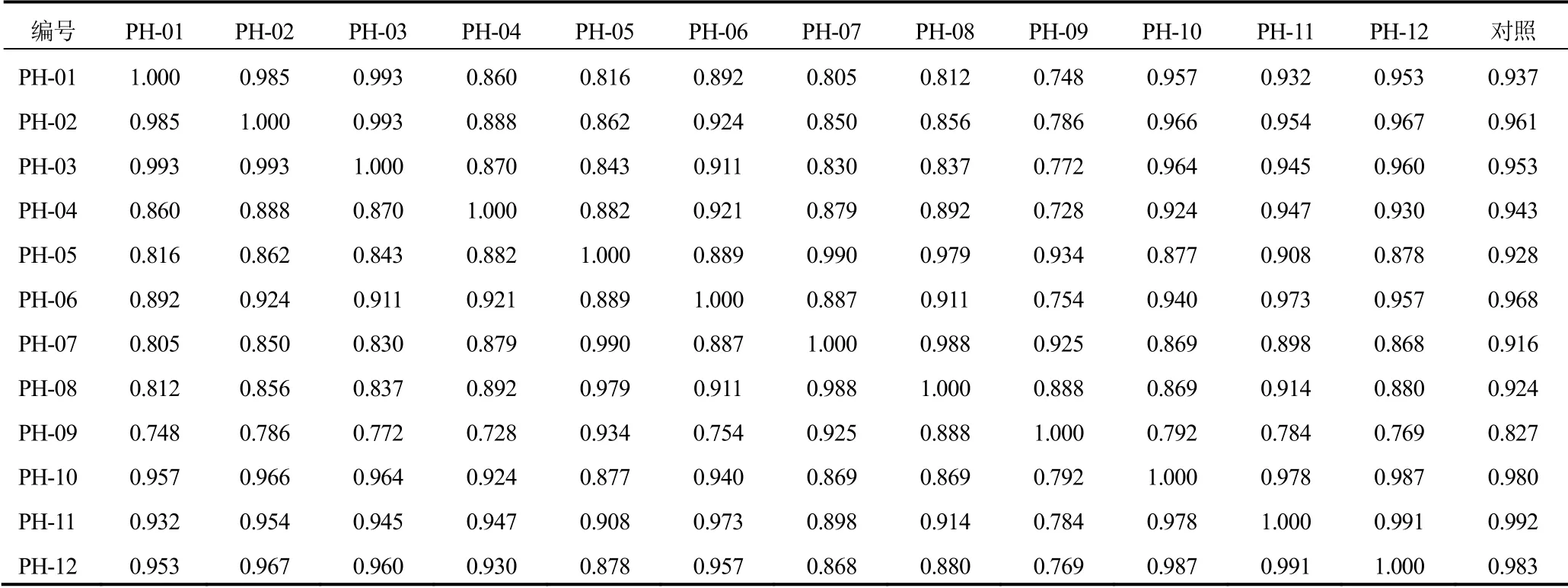
表4 12批生蒲黄标准汤剂指纹图谱相似度
2.2.8 聚类分析
香蒲新苷(4号峰)和异鼠李素-3-O-新橙皮苷(5号峰)为蒲黄的主要有效成分,而且分离良好,为所有样品共有,故选择4号峰和5号峰为变量,通过SPSS25.0软件对12批样品进行聚类分析,采用Ward联接法,以平方欧氏距离为样本测度,12批生蒲黄标准汤剂可分为3类,见图4。PH-02、PH-04、PH-06、PH-08、PH-11、PH-12为第一类,PH-01和PH-09为第二类,PH-03、PH-05、PH-07、PH-10为第三类。
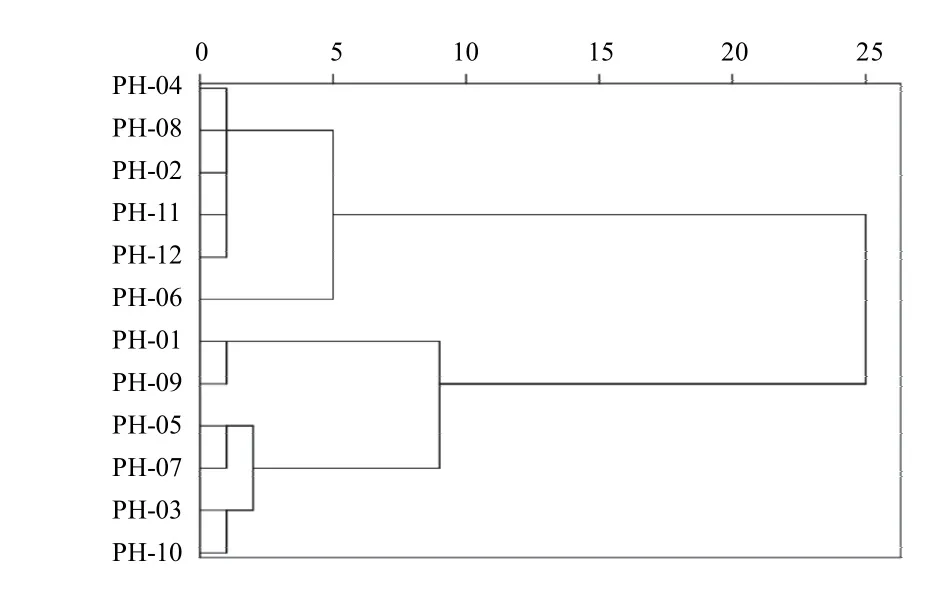
图4 12批生蒲黄标准汤剂聚类分析树状图
2.2.9 主成分分析
将12批标准汤剂色谱图中7个共有峰的峰面积导入SPSS25.0软件进行主成分分析。通过降维中的因子分析,进行KMO和巴特利特检验,KMO取样适切性量数为0.571,KMO>0.5且P<0.05,表明该数据适合做因子分析。提取3个主成分因子,计算得分值、累计方差贡献率、旋转后的成分矩阵和相关系数矩阵,结果见表5~表7。主成分1、2、3的累计方差贡献率达95.983%,表明这3个主成分能够代表样本的整体质量。成分矩阵显示,4号峰和5号峰对主成分1的影响最大,表明香蒲新苷和异鼠李素-3-O-新橙皮苷在蒲黄的质量控制中具有重要作用。根据主成分分析得分图可将生蒲黄标准汤剂分成4类,PH-04、PH-05、PH-07、PH-08为一类,PH-01~PH-03、PH-10~PH-12为一类,PH-06和PH-09与其他样品差异较大,单独列为两类。
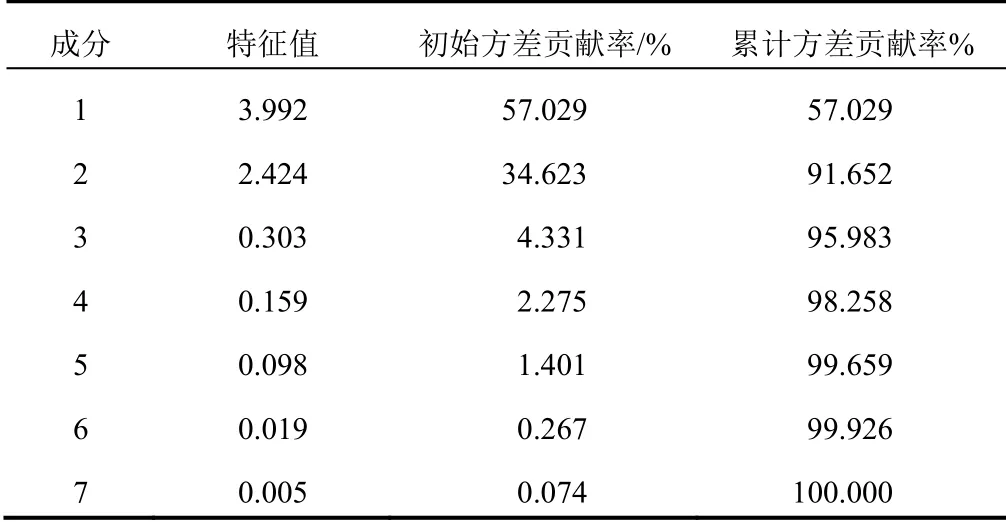
表5 生蒲黄标准汤剂主成分分析特征值及方差贡献率
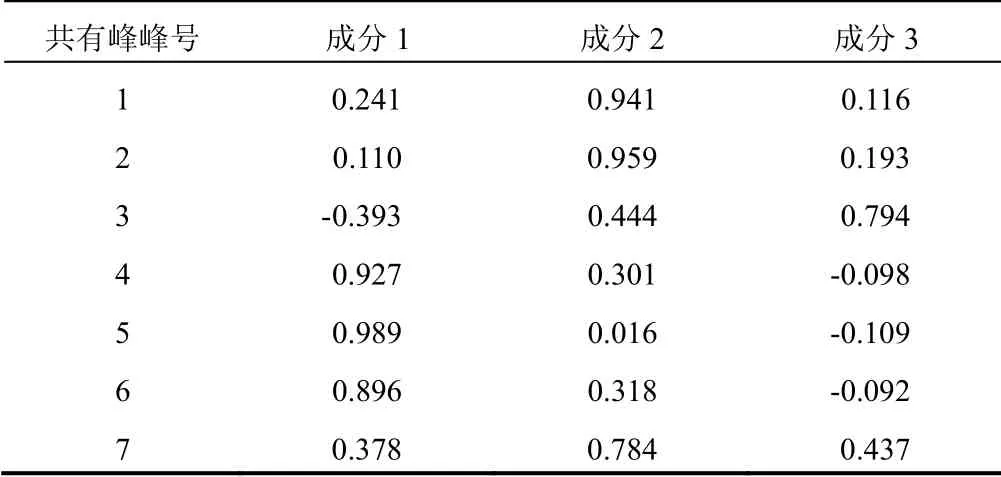
表6 各共有峰旋转后的成分矩阵
表7 各共有峰成分得分系数矩阵
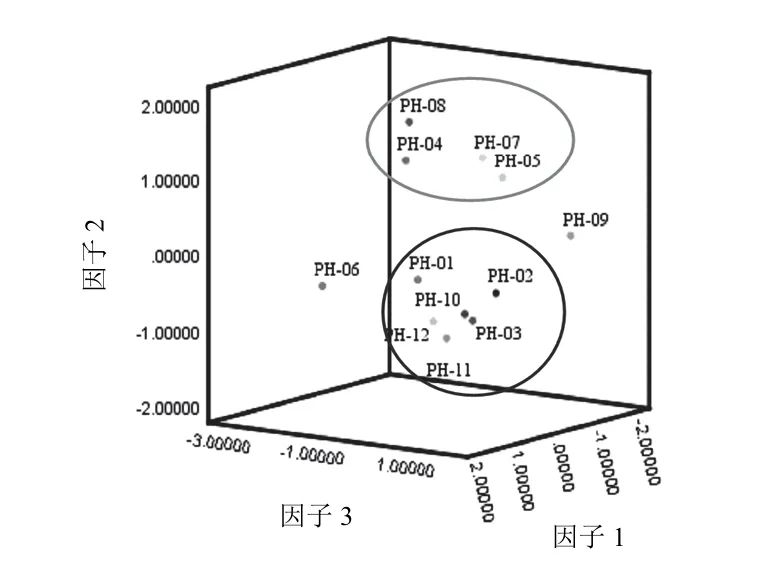
图5 生蒲黄标准汤剂主成分分析得分图
3 讨论
标准汤剂与中药饮片临床应用基本属性一致,同时能解决配方颗粒等用药形式性状缺失条件下的质量控制难题。本研究基于传统煎煮工艺,按照《技术要求》和《中药饮片标准汤剂研究策略》[7]推荐的制法制备标准汤剂,建立生蒲黄标准汤剂的制备方法,测定标准汤剂中香蒲新苷和异鼠李素-3-O-新橙皮苷含量,香蒲新苷转移率为79.41%±13.9%,异鼠李素-3-O-新橙皮苷转移率为58.66%±18.8%,出膏率为9.5%~14.5%,pH值为5.4~6.4;建立了标准汤剂HPLC指纹图谱,确认了7个共有峰,通过对照品比对指认出2个色谱峰,并通过聚类分析和主成分分析,提出对生蒲黄饮片分类的方法。
水烛香蒲主要分布于江苏、浙江、山东、安徽、湖北等省,东方香蒲产于贵州、山东、山西、东北各省[10]。蒲黄产地分布广泛,几乎遍布全国[11]。本研究样品来自不同产地、不同厂家,基本能够代表目前市售药材的实际情况。12批饮片中香蒲新苷和异鼠李素-3-O-新橙皮苷总含量为0.58%~0.97%,符合2015年版《中华人民共和国药典》(一部)要求(总含量≥0.5%)。
蒲黄药用部位为花粉。花粉、细小种子等细粉类药材临床使用时一般选择包煎,否则可能漂浮于水面上,不利于有效成分的煎出,或汤剂中有细小颗和绒毛,刺激咽喉[12]。但我们发现,蒲黄浸泡后混悬于水中,未呈现漂浮状态,能保证充分提取其有效成分,而且本工艺制备的标准汤剂中无细小颗粒或绒毛,故未采用包煎方法。此制备方法符合中医药传统理论和临床应用情况,满足工艺标准化、统一化的要求,可作为临床使用的最低标准,为中药配方颗粒、经典名方、中药整体质量控制提供参考。
蒲黄有水烛香蒲、东方香蒲等多个基源,从饮片形状上很难鉴别,基源的多样性可能导致多批样品指纹图谱相似性低。本研究除PH-09外,其余11批样品与对照图谱的相似度均大于0.9。分析数据发现,PH-09饮片和标准汤剂中香蒲新苷和异鼠李素-3-O-新橙皮苷的含量均低于其他样品,可能由于此样品质量虽然符合药典标准,但低于市场上饮片的平均质量水平所致。
由标准汤剂中香蒲新苷和异鼠李素-3-O-新橙皮苷含量测定结果可知,不同产地样品之间2种黄酮苷成分含量差异较大,产自内蒙古的饮片中2种黄酮苷总含量平均值高于江苏和山东饮片,这一结果与文献报道[13]相似。但以2种黄酮苷色谱峰面积为变量对12批样品进行聚类分析或主成分分析,结果均未发现样品质量与产地之间的相关性。可能除产地因素外,其他如基源、药材贮存时间等因素对样品质量亦有影响。聚类分析、主成分分析与指纹图谱相结合,可为评价蒲黄饮片及其制剂的质量提供参考。本研究结果未显示出道地产区江苏所产蒲黄[14]较其他样品的优越性。
样品的传统鉴定与DNA条形码相结合,可以精确到物种,比较不同基源的饮片差异[7]。本研究未对样品进行基源鉴定至物种,基源对蒲黄饮片质量的影响尚未可知。蒲黄成分复杂,其物质基础是多种成分构成的,仅用香蒲新苷和异鼠李素-3-O-新橙皮苷作为指标成分,多数共有峰未确认,可能存在片面性,今后可选择液质联用、核磁共振氢谱等方法对蒲黄饮片中的化学成分进行指认。临床中还可以蒲黄细粉直接制成散剂口服或外敷[15],标准汤剂能否作为外敷用药的标准有待商榷。另外,与生蒲黄相比,蒲黄炭黄酮苷类成分减少,鞣质类成分增加,鞣质与热解为苷元的黄酮类成分为蒲黄炭的主要有效成分[16],因此,蒲黄炭的标准汤剂应与生蒲黄有所差异。
综上,本研究遵从传统水煮工艺,依托现代检测手段,制定了生蒲黄标准汤剂的质量评价方法,可为蒲黄配方颗粒等其他口服汤剂的质量控制提供依据。

