六味地黄汤治疗新生儿缺血缺氧性脑病lncRNA-miRNA-mRNA转录网络整合分析
陈博威,郑飘,易健,刘柏炎,3
1.湖南中医药大学,湖南 长沙 410208;2.湖南中医药大学第一附属医院,湖南 长沙 410007; 3.益阳医学高等专科学校,湖南 益阳 413000
新生儿缺血缺氧性脑病(neonatal hypoxic- ischemic encephalopathy,HIE)是围产期常见疾病,可导致婴儿脑瘫、癫痫等神经系统疾病甚至死亡。目前西医以亚低温及神经营养治疗为主[1]。中医在整体观念和辨证论治原则指导下,其多环节、多靶点、整体调节方式在HIE疗效与安全性方面具有一定优势。六味地黄汤为传统补肾名方,具有调节细胞凋亡、代谢、增殖的作用[2]。本课题组前期通过对“肾通于脑”理论进行挖掘,认识到肾在脑的生长发育过程中占有重要地位,为六味地黄汤治疗HIE提供了理论基础[3-5]。临床研究显示,六味地黄汤可改善脑血流量、降低血黏度[6]。但既往研究均针对单一靶点与单一机制,无法系统阐明六味地黄汤治疗HIE的分子机制。 目前,由长链非编码RNA(lncRNA)、微小RNA(miRNA)及mRNA组成的转录网络越来越受到重视。lncRNA不能直接编码翻译蛋白质,但在转录后水平上,可作为竞争性内源RNA(ceRNA),通过特异性海绵吸附miRNA的方式,间接减少miRNA与下游靶基因的结合,从而实现对基因的调控[7]。既往研究发现,lncRNA在中枢神经系统中特异表达,并广泛参与对大脑发育、神经分化、突触可塑性、认知与记忆功能的调控[8]。目前,lncRNA及miRNA的表达谱已在HIE疾病中被发现,提示其可能对HIE的疾病发展起重要作用[9-10]。基于前期研究认识,本研究通过生物信息学手段,辅以网络药理学和分子对接技术,挖掘六味地黄汤治疗HIE的活性成分-靶点网络及lncRNA-miRNA-mRNA三元转录网络,以期阐明该方多途径、多靶点协同作用的分子机制,并为后续基础和临床研究提供依据。
1 资料与方法
1.1 六味地黄汤活性成分筛选与作用靶点预测
运用中药系统药理学数据库与分析平台(TCMSP,http://tcmspw.com/tcmsp.php)获取六味地黄汤组方药物熟地黄、山药、茯苓、山茱萸、牡丹皮、泽泻的活性成分。依据药物的药动学特性,以口服生物利用度(OB)≥30%、类药性(DL)≥0.18为条件[11]筛选活性成分。在该数据库中输入各活性成分,查询其潜在作用靶点,并通过Perl软件(https://www. perl.org)将靶点导入Uniprot数据库(http://www. uniprot.org),获取靶点官方基因名。
1.2 疾病差异表达lncRNA、miRNA、mRNA挖掘
从基因表达数据库(GEO,https://www.ncbi.nlm. nih.gov/geo)下载编号为GSE121178的基因原始矩阵文件,该基因数据来自扬州大学,包含3个HIE新生儿的全血标本和3个正常新生儿的全血标本,基因芯片平台为GPL22120(http://www.affymetrix.com)。通过Perl软件和R语言(https://www.r-project.org),以Log2(FC)的绝对值>1.5和P<0.05为筛选条件进行基因数据挖掘,得出差异表达lncRNAs。借助Mircode数据库(http://www.mircode.org)预测lncRNA结合的miRNA。将得到的miRNA结果映射到miRDB(http://mirdb.org)、miRTarBase(http://mirtarbase.mbc. nctu.edu.tw)、TargetScan(http://www.targetscan.org)数据库,预测miRNA靶向调控的mRNA。
1.3 活性成分-靶点网络及lncRNA-miRNA-mRNA转录网络构建
通过Perl软件将HIE疾病预测的mRNA与六味地黄汤预测靶点取交集,得到六味地黄汤治疗HIE可能涉及的活性成分及关键lncRNAs、miRNAs、mRNAs,运用Cytoscape3.7.0软件构建活性成分-靶点网络及lncRNA-miRNA-mRNA三元转录网络。将上述关键mRNAs输入STRING数据库(https://string-db.org/),并将物种设定为“homo sapiens”,最低互作得分设置为0.4,得到蛋白相互作用网络。
1.4 关键作用靶点GO功能及KEGG通路富集分析
运用R语言Biomanager、ClusterProfiler软件包对得到的关键靶点进行GO功能及KEGG通路富集分析。GO功能富集分析可描述基因产物可能形式的分子功能、参与的生物过程和所处的细胞环境。KEGG通路富集分析通过将已知的基因组注释信息进行分类,得出最显著的生物学过程。
1.5 分子对接分析
先用ChemOffice16.0软件将六味地黄汤主要活性化合物的3D结构保存为.mol2格式并使其能量最小化。从PDB数据库(https://www.rcsb.org/)下载主要靶点3D结构.pdb格式,运用PyMOL软件(https:// www.pymol.org)对蛋白进行去水、加氢等操作,利用Auto Dock 4.2软件将化合物及靶蛋白格式转换为.pdbqt格式,最后进行分子对接。一般认为,结合能<-5 kcal/mol时,配体与受体可实现较好结合[12]。
2 结果
2.1 六味地黄汤活性成分及作用靶点
通过TCMSP和Uniprot数据库得到六味地黄汤活性成分,其中熟地黄2个、山茱萸13个、山药12个、牡丹皮6个、泽泻7个、茯苓6个,合并重复项后得到活性成分41个,潜在作用靶点194个,见表1。
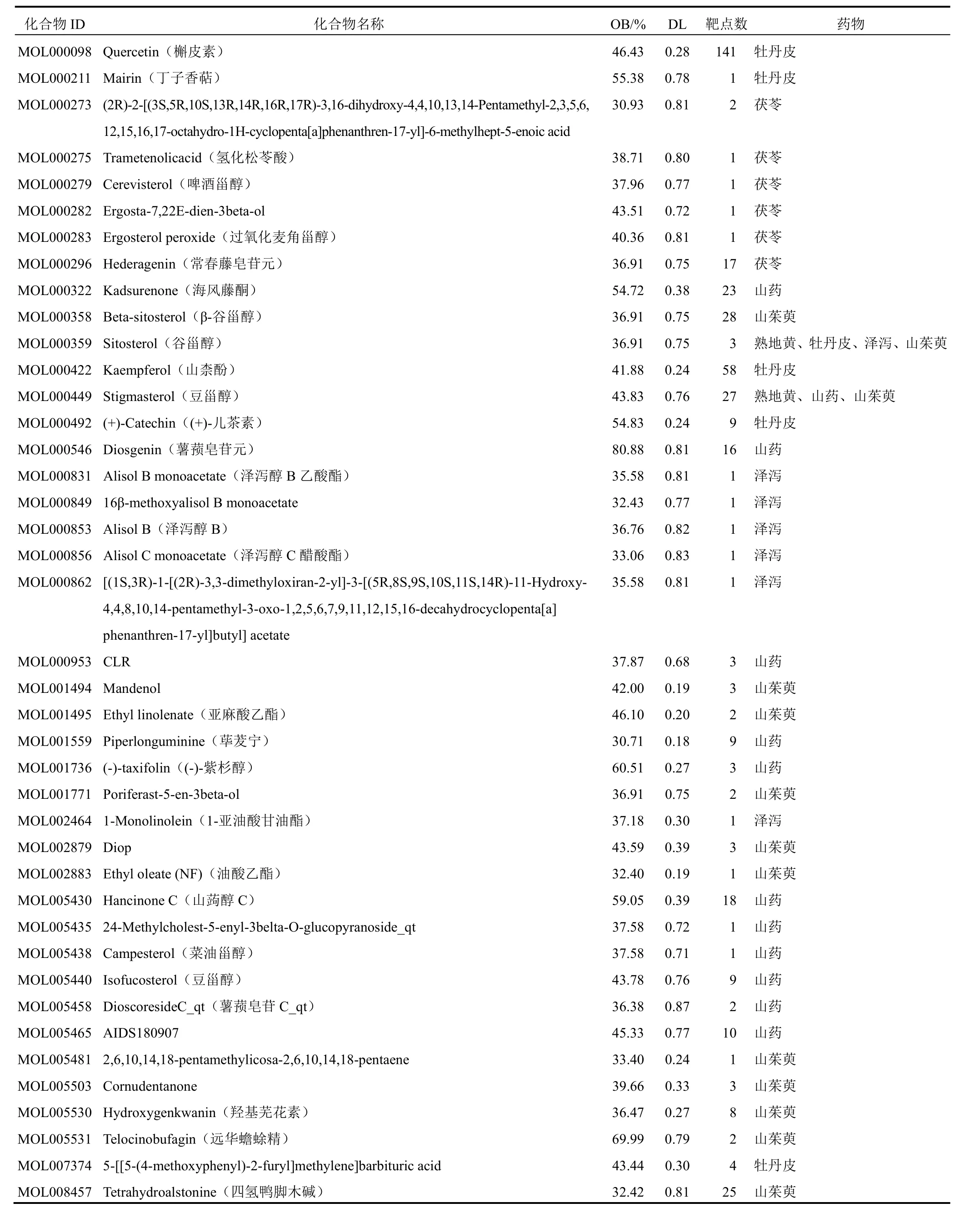
表1 六味地黄汤活性成分
2.2 疾病差异lncRNA、miRNA、mRNA
基于GSE121178的基因芯片共得出217个差异基因(见图1A),运用Perl软件筛选出31个差异lncRNAs(见图1B)。将差异表达的31个lncRNAs输入Mircode数据库,预测到546个lncRNA-miRNA的调控关系。通过miRDB、miRTarBase、TargetScan数据库预测得到miRNA的靶向mRNA。为保证结果可靠,本研究仅选取被3个数据库同时预测到的共1 900个miRNA-mRNA调控关系。
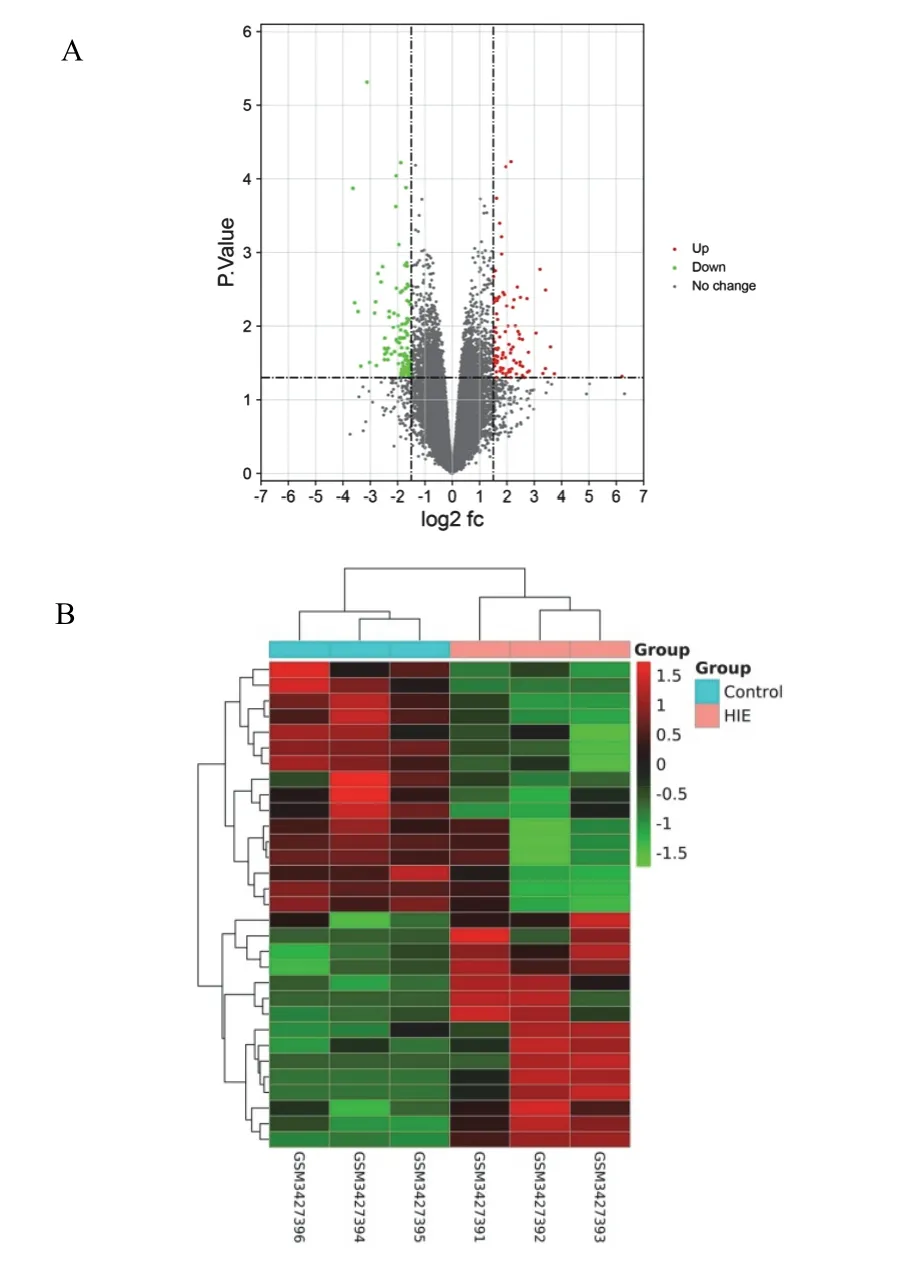
图1 HIE疾病GEO芯片差异表达基因
2.3 活性成分-靶点网络及lncRNA-miRNA-mRNA转录网络
将预测到的靶向mRNAs与六味地黄汤作用靶点取交集,得到有效成分33个,药物-疾病关键lncRNAs 13个,关键miRNAs 20个,关键mRNAs 33个。运用Cytoscape3.7.0软件构建活性成分-靶点网络,见图2。活性成分按节点度大小依次有槲皮素(Quercetin,MOL000098)、山柰酚(Kaempferol,MOL000422)、(+)-儿茶素((+)-Catechin,MOL000492)、薯蓣皂苷元(Diosgenin,MOL000546)等,见表2。由13个关键lncRNAs、20个关键miRNAs、33个关键mRNAs构成的三元转录网络见图3。其中,H19与miR-17-5p分别在lncRNA组及miRNA组的靶基因数目最多,见表3。借助STRING数据库,隐去无相互作用的蛋白后,绘制包含31个节点和198条边的蛋白相互作用网络,其中,节点度居前列的核心作用基因有MYC、JUN、VEGFA、CCND1、ESR1、MAPK1、PTGS2、FOS、MAPK8、CDKN1A等,见图4。
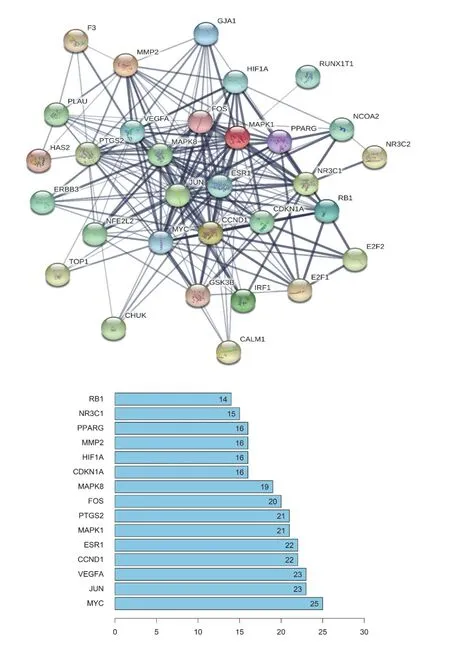
图4 六味地黄汤治疗HIE蛋白相互作用网络与核心作用基因

表3 六味地黄汤治疗HIE三元转录网络主要基因及其靶点
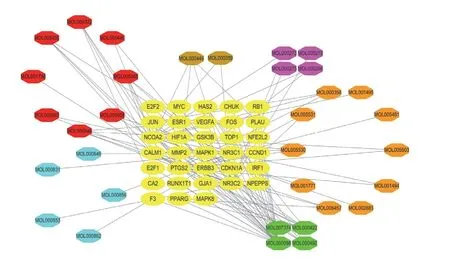
图2 六味地黄汤活性成分-靶点网络
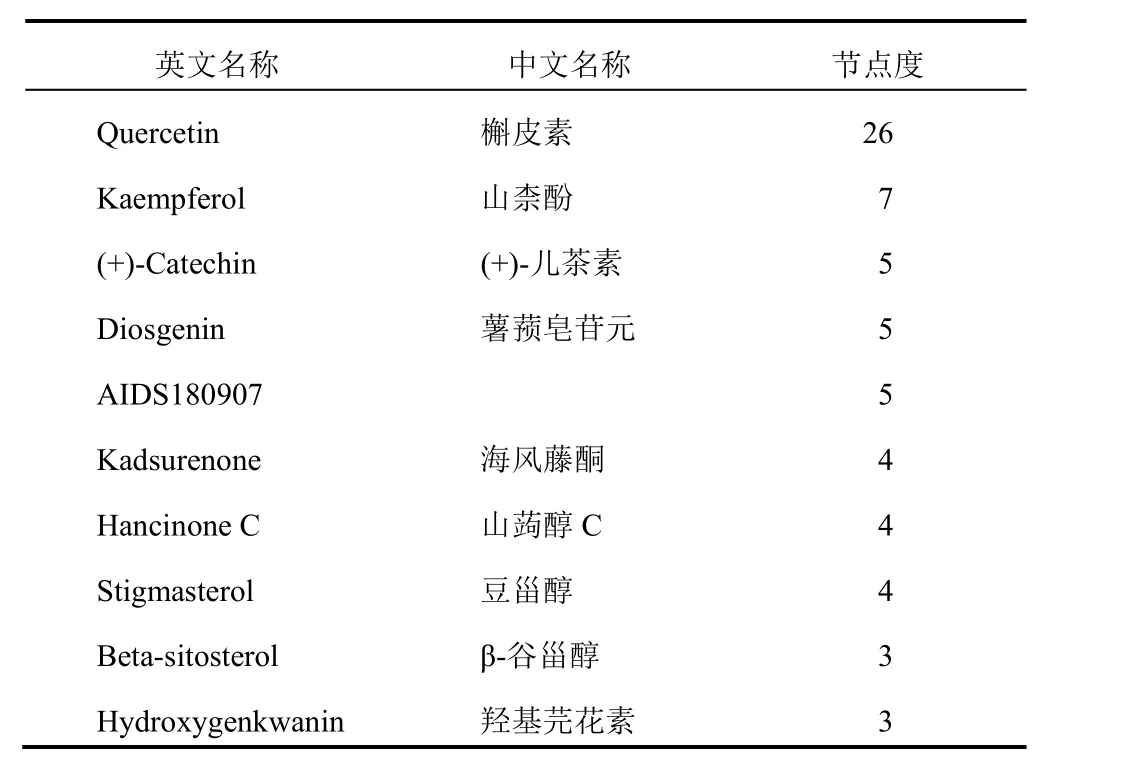
表2 六味地黄汤主要活性成分节点度
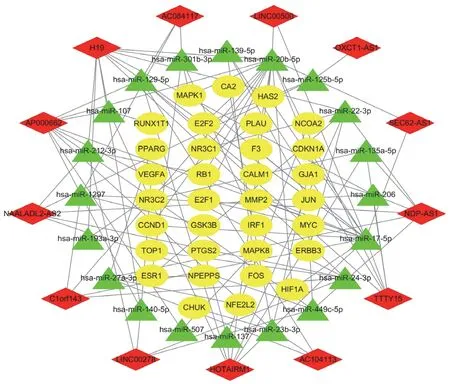
图3 六味地黄汤治疗HIE lncRNA-miRNA-mRNA转录网络
2.4 关键靶点富集分析
对关键靶点进行GO功能及KEGG通路富集分析,共获得679个GO功能富集结果,其中分子功能主要富集在转录因子活性与DNA、RNA聚合酶活性等,生物过程主要富集在对激素、氧浓度反应等,细胞组分主要富集在RNA聚合酶Ⅱ转录因子复合物及核转录因子复合物上。KEGG通路富集分析得到107条通路,主要包括PI3K-Akt信号通路、MAPK信号通路、IL-17信号通路、TNF信号通路及Wnt信号通路。此外,还可能涉及调控细胞衰老、细胞周期及细胞凋亡等,提示六味地黄汤治疗HIE与多条通路、多个生物过程有关。见图5、表4。

表4 六味地黄汤治疗HIE关键靶点KEGG通路富集分析主要通路及相关基因
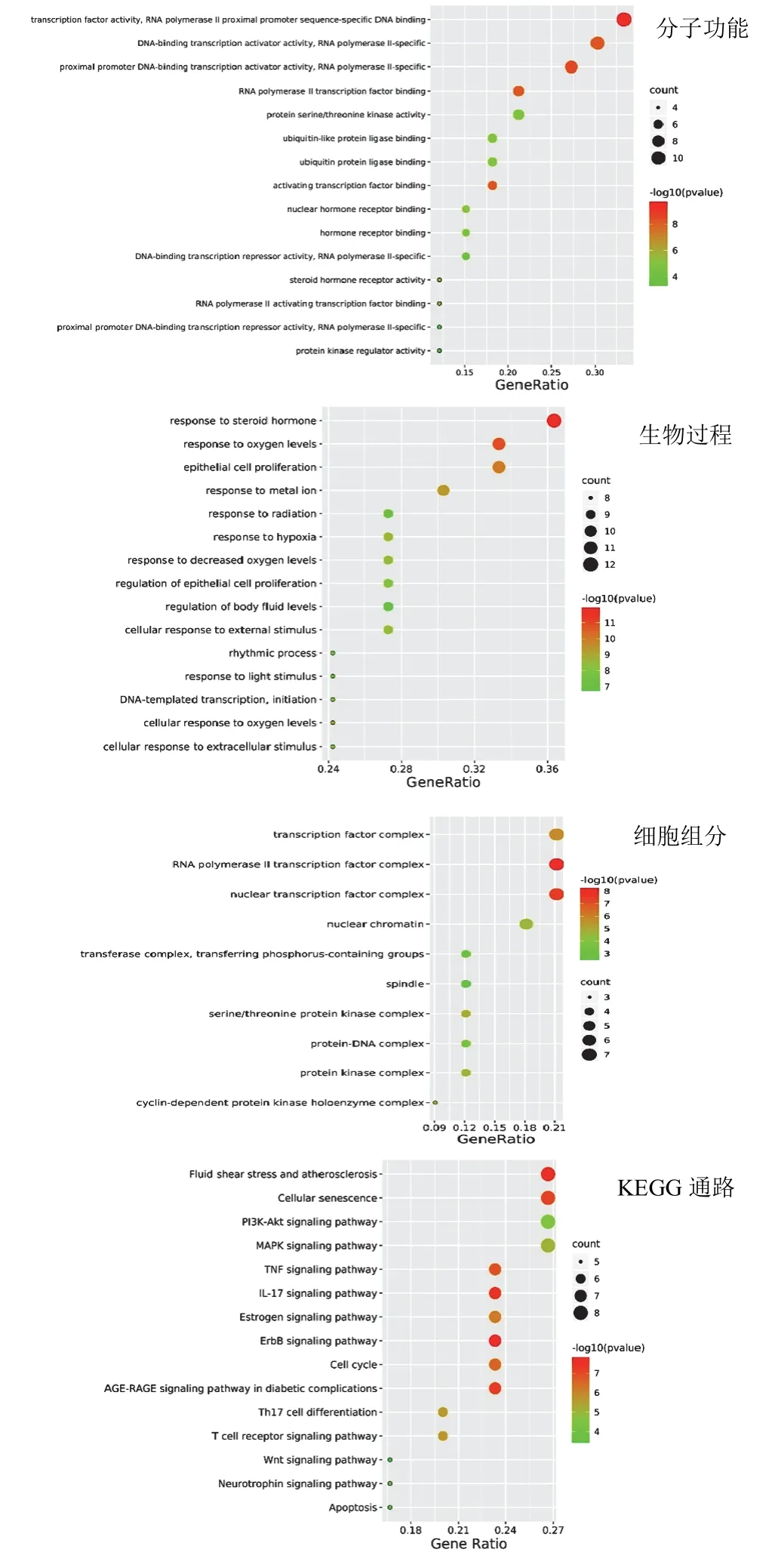
图5 六味地黄汤治疗HIE关键靶点GO功能及KEGG通路富集分析
2.5 分子对接结果
将六味地黄汤治疗HIE节点度值排名居前列的槲皮素、山柰酚、(+)-儿茶素及薯蓣皂苷元等活性成分与主要KEGG通路PI3K-Akt信号通路的2个标志蛋白PIK3CA(PBD ID:2RD0)、AKT1(PBD ID:1H10-1)进行分子对接。结果显示各活性成分与PIK3CA、AKT1的结合能均小于-5 kcal/mol,表明其均能与靶点较好结合,其中薯蓣皂苷元分别与2个靶点的结合能最低,见表5、图6。
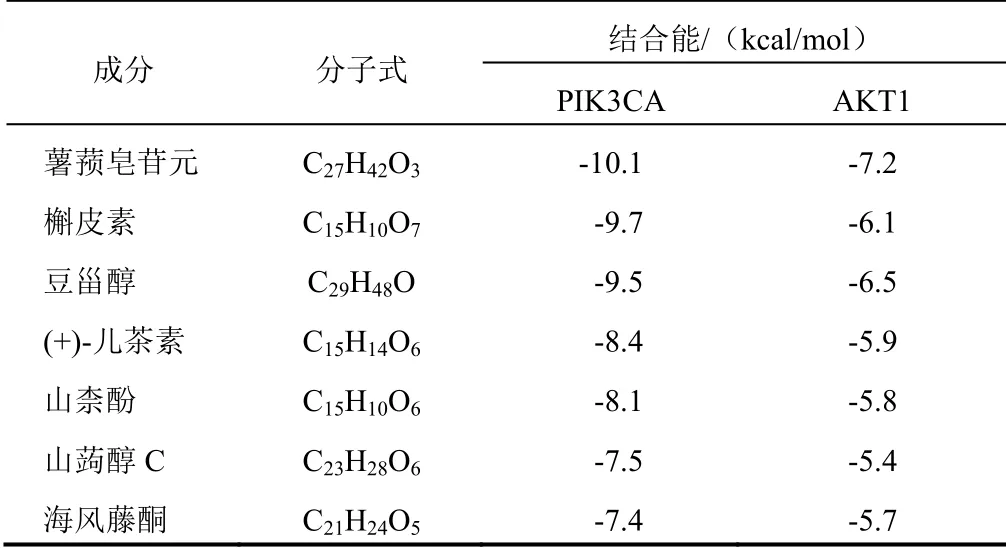
表5 六味地黄汤中主要活性成分的分子对接结合能
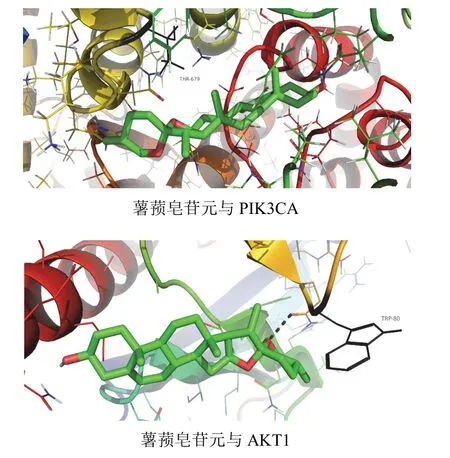
图6 薯蓣皂苷元与PIK3CA、AKT1分子对接示意图
3 讨论
HIE发病机制较为复杂,其脑损伤为多重因素、多种机制交互作用发生的“瀑布式”病理变化,包括神经细胞能量代谢障碍、神经炎性毒性损伤等[1],因此单一药物或措施无法逆转其病理改变。中药具有多组分、多靶点的特点,能够对疾病的不同病理环节发挥协同作用,为治疗HIE提供了新思路。根据HIE临床表现,可将其归属中医学“初生不啼”“胎搐”等范畴,主要病机为先天精血亏虚,胎元不足。基于“肾藏精,精生髓,髓聚脑”的“肾脑相关”理论,治以补肾固本、填精益髓,六味地黄汤为代表方剂。既往研究表明,六味地黄汤能清除HIE大鼠脑组织内的氧自由基,并能通过调控低氧诱导因子-1α的基因表达,促进HIE大鼠病变脑组织的修复[13]。
本研究发现,六味地黄汤中槲皮素、山柰酚、(+)-儿茶素及薯蓣皂苷元等活性成分与HIE疾病密切相关,另外通过STRING数据库发现MYC、JUN、VEGFA、CCND1、ESR1及MAPK1等可能是蛋白相互作用网络的关键蛋白。相关研究亦证实了上述成分及靶点的作用,如槲皮素能抑制HIE大鼠的神经细胞凋亡,并促进神经再生[14-15];山柰酚具有抑制神经炎性损伤及保护血脑屏障的作用[16];(+)-儿茶素能通过改善能量代谢及拮抗神经毒性的方式,改善缺血缺氧神经元活性[17];薯蓣皂苷元能通过抑制小胶质细胞活化降低炎症反应,减轻脑损伤[18]。关键蛋白中的FOS与MAPK1属于应激蛋白激酶,在神经系统信号转导中具有重要作用,广泛参与神经细胞的生长和分化等生理过程[19]。CCND1属细胞周期家族,具有调控细胞生长、分裂与死亡的作用[20]。VEGFA为血管内皮生长因子家族成员,与大脑缺血缺氧后的血管新生密切相关[21]。ESR1是一种雌激素受体,有研究表明ESR1具有维持神经系统正常功能的作用[22]。此外,分子对接结果显示主要活性成分均能与标志靶点较好结合,一定程度上验证了本研究的准确性。
在KEGG通路富集分析结果中,居前列的PI3K-Akt信号通路和MAPK信号通路是大脑缺血缺氧后的重要调控通路,与氧化应激、炎症反应及凋亡等病理过程密切相关[23-24]。PI3K-Akt通路是调控细胞生长、代谢及存活的经典通路,并且广泛参与了许多中枢神经系统疾病[25]。研究表明,HIE新生兔模型中PI3K-Akt通路被激活,并抑制神经元的凋亡[26],阻断PI3K-Akt通路则会诱导脑内炎症反应及细胞凋亡,加重神经功能损害[27]。有实验显示,在脑缺血后活化的MAPK通路会激活Nrf2通路,而补肾中药能够抑制MAPK通路的磷酸化,扭转Nrf2核移位,减少氧化应激[28];亦有研究发现,MAPK信号通路与炎症反应密切相关,其在大脑缺血后可激活下游的NF-κB通路,促进炎症反应[29],而抑制MAPK通路活化则可以减轻炎症反应,具有神经保护作用[30]。此外,IL-17信号通路、TNF信号通路为脑损伤后主要的炎症反应通路[31]。前期研究显示,脑损伤后会导致脑内炎症“级联反应”产生,而六味地黄汤能够抑制炎症反应,减轻脑损伤[4]。Wnt信号通路则是脑损伤后神经再生的重要调控通路[32]。综上,六味地黄汤治疗HIE的作用机制与多条通路、多个生物过程存在一定的联系,这与中医标本兼治的整体观念相吻合,同时体现了中药复方多靶点、多环节的治疗特点。
基于生物信息学技术,本研究初步构建了六味地黄汤治疗HIE的lncRNA-miRNA-mRNA转录网络,其中,H19和miR-17-5p分别在lncRNA组及miRNA组节点度值最高,且miR-17-5p可以靶向调控KEGG通路富集居前列的PI3K-Akt通路及MAPK通路中MAPK1、CCND1、CDKN1A等多个基因。lncRNA H19与中枢神经系统联系密切,有研究显示其在大脑缺血后表达显著增加,并且与美国国立卫生研究院卒中量表(NIHSS)评分及肿瘤坏死因子-α表达水平呈正相关[33];敲除lncRNA H19则会抑制脑缺血后的炎症反应,并促进神经再生[34]。lncRNA H19还能作为ceRNA海绵吸附miR-17-5p[35],且敲除lncRNA H19可上调miR-17-5p的表达[36]。miR-17-5p不仅能在脑缺血后抑制下游PTEN基因表达进而磷酸化PI3K-Akt通路,发挥神经保护作用[37],还能通过抑制下游p38-MAPK表达水平,减少HIE大鼠的神经细胞凋亡[38]。此外,有研究显示miR-17-5p能够通过抑制炎症反应等方式促进HIE大鼠的神经修复[39]。上述研究表明,lncRNA H19/miR-17-5p网络是一个与中枢神经系统的保护及修复有密切联系的调控网络,据此推测六味地黄汤治疗HIE过程中,lncRNA H19可能作为ceRNA海绵参与miR-17-5p对下游各类基因的调控,进而具有影响神经修复的作用。
综上所述,本研究运用生物信息学及网络药理学方法,初步探讨了六味地黄汤治疗HIE的有效成分及其潜在作用靶点,并构建了lncRNA-miRNA-mRNA三元转录网络,发现靶基因与大脑缺血缺氧后的氧化应激、炎症反应及凋亡等病理过程密切相关,还预测lncRNA H19/miR-17-5p轴可能是其重要ceRNA调控轴,并进行了分子对接验证,可为六味地黄汤的临床运用和实验研究提供依据和方向。考虑到中药活性成分在煎煮过程中及进入体内可能发生的复杂变化,有必要通过后续实验进一步验证。

