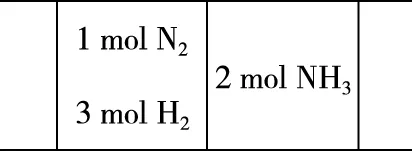基于学科素养的高中化学复习课“模课”教学模式探究
黑龙江 毕占龙 刘蓉璞
高中化学复习课设计决定着学生对所学知识是否升华到更高层次,深研复习课教学模式是高中化学教师教研的重要内容。复习课的“模课”教学模式让学生经历头脑风暴,做到把书本读厚再读薄、达到提升学科核心素养的目的。
一、问题提出
目前高中化学复习课教学情况是教师反映自己卖力讲题而收效甚微,学生努力做题却不见提升。这源自于化学学科特点:元素知识繁杂、微观世界抽象、化工原理深奥、结构有机难懂等因素,更有教师对新课程改革执行不到位致使教法单一、学生对化学学科认识有偏差致使理科学科文科化等因素。这导致素质教育进展缓慢。2014年春天,教育部发布《教育部关于全面深化课程改革落实立德树人根本任务的意见》,此《意见》明确提出教育必须以“立德树人”为根本教学任务。经过汇总专家组3年多的工作成果,在凝聚了社会各方面智慧和力量的基础上,新课程标准于2017年正式面世。学习研究并落实学科核心素养,对于教师专业化和学生学科素养提高都有很重要的现实意义。
二、“模课”介绍
高中化学学科核心素养中将“证据推理与模型认知”作为一个维度进行描述,说明了其对培养学生关键能力的重要性。而模型认知是指对研究的物质及其变化方面的问题提出假设,根据观察和实验得到的信息,通过抽象的模型思维,用简化、形象的模型,再现物质及其变化本质、内在特性及一般规律,并通过实验验证来完善模型。这足以说明学生不应只是简单的知识搬运工,学习过程需避免复制粘贴等简单粗暴的学习方式,学生应做知识学习的主人,主动的将所学知识进行整合与深加工,通过深入学习使学科升华。复习课的“模课”教学模式突出特点就是以学生为主体,围绕复习内容,思考如何解决遇到的实际问题并针对问题提出相应合理假设,搜集储备大量知识,建立解决问题模型,建立成功后用模型处理新问题并完善模型。建模的目的是为了对知识深加工,构建知识网络,形成知识体系。各个环节可概括为遇到问题、提出假设、建立模型、检验模型、修订模型、应用模型、再次修订,使学生形成模型意识、掌握建模方法、感悟构建过程、享受应用快乐。通过模型认知思维培养,学生自主利用模型解决问题并亲力亲为建构模型。这样,模型认知思维就逐渐形成了,学科素养的种子被种下并生根发芽。
三、教师储备
教师应先对高中化学知识进行初级建模,即进行必要的知识储备,先拥有自己的活水源,再与学生课上建立的模型进行接轨。主要包含以下四个模块:
1.体会教材体系,增容知识库存
高中化学课本分为必修内容和选修内容,必修内容重广度,选修内容重深度。所以,模型建立要注重实用范围,也可以进行必修内容复习课时先建立模型,选修内容复习课在原来基础上进行延伸甚至重组。模型构建过程要定位精准、提取精华、高度概括、形成框架、具有体系、实用性强。此模块可用概念图、思维导图、思维地图等方式体现。
2.整合宏观微观,制作校本素材
此模块的构建要充分利用信息技术,借助软件进行素材制作。要关注细小知识点,如有机化学中的结构式、结构简式、键线式、比例模型、球棍模型等;结构化学中包含的分子模型、晶体模型、杂化轨道模型等;物质制取装置、电化学原理装置等;碰撞原理、化学反应原理模型等。
3.解读课程标准,构建母题模型
化学课程标准是高考化学试题命题依据,一套好的试题应追求在知识种类与知识分布、知识广度与深度和课程标准高度一致,既考查了学生对基础知识的掌握,又测试了学生解决问题的能力,达到学以致用的目的。所以研究课程标准是教师的重要课题,通过对课程标准的理解,找寻母题题源,对基础知识进行平面考核,形成网络。打造一题多问、一问多解的母题模型。针对一个知识点多维度、多层次设计问题体现其内在相关性。可包含平衡状态判定、化学平衡移动引起各种量的变化、氧化性强弱应用、酸性强弱应用、工艺流程、实验装置流程、电化学原理等方面。
4.领悟命题意图,研发解法模型
试题设问多种多样,不同试题解题方式不同却也存在相关性,试题解法模型可以通过判断,让学生快速找到方法进入状态。比如针对化学计算试题,可用设计试题流程运用得失电子守恒或原子守恒处理;平衡问题可设计盒子模型处理;同分异构体问题可设计取代法插入等模型。
教师储备的四个模块间相互联系,相互依存,由表及里,由浅入深,应包含学生复习课所能构建的大部分模型,并在实践中不断完善,为复习课“模课”教学设计做充分准备。
四、模型建构
在平衡移动章节中,经常考查改变条件、改变投料比达到平衡后各种量的比较。所以,平衡移动引起量的变化复习课中,通过分析建立思考问题的模型体现条件变化或投料变化的本质及内在规律,通过比较模型间的关系,深入理解平衡移动引起量的变化这一重难点知识的分析方法。

1.a组充入1 mol N2和3 mol H2保持恒温恒容,达到平衡后反应物转化率α1,放出热量Q1,产物NH3物质的量的百分含量η1,气体平均摩尔质量M1,气体密度ρ1;b组充入2 mol NH3并保持恒温恒容,平衡后NH3的转化率α2,反应吸收热量Q2,NH3物质的量百分含量η2。
【分析】b组投入初始量可以等效成a组投入量,a、b两组达到化学平衡态后各组分物质的量完全相同,模型如图1所示,可看成两组分别从左右两端出发,在某点恰好相遇,正逆反应方向进行之和恰好按照计量系数完成反应,即α1+α2=1;Q1+Q2=Q;η、M、ρ均相同。

图1
2.c组充入0.5 mol N2和1.5 mol H2保持恒温恒容,达到平衡后反应物转化率α3,放出热量Q3,产物NH3物质的量的百分含量η3,气体平均摩尔质量M3,气体密度ρ3。
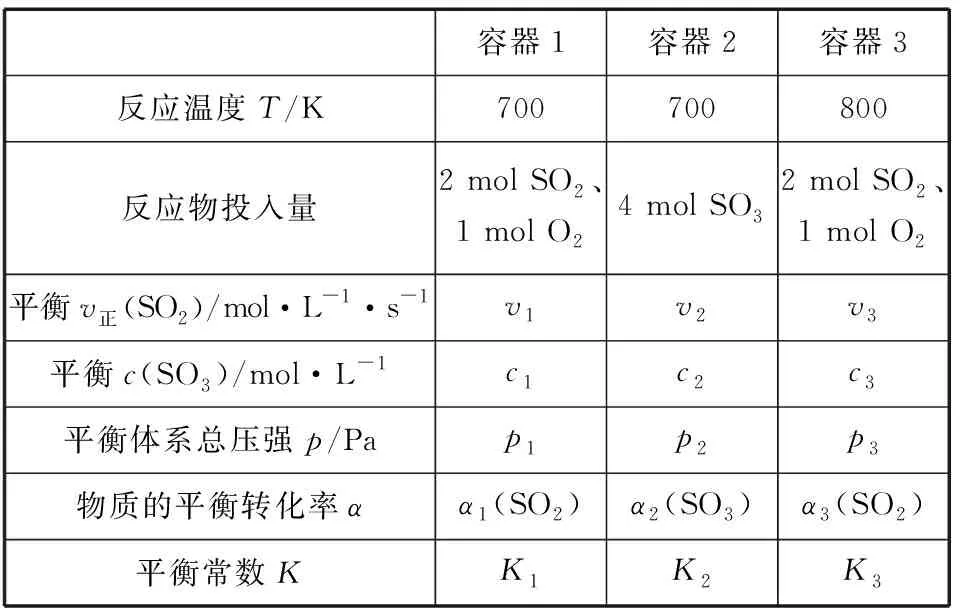
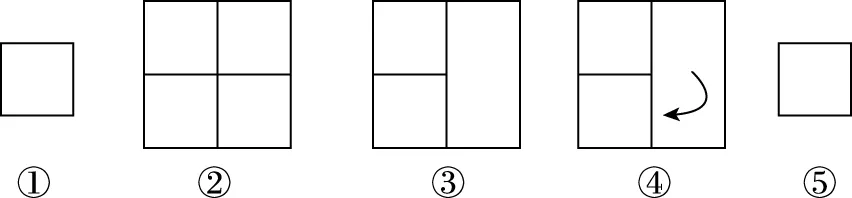
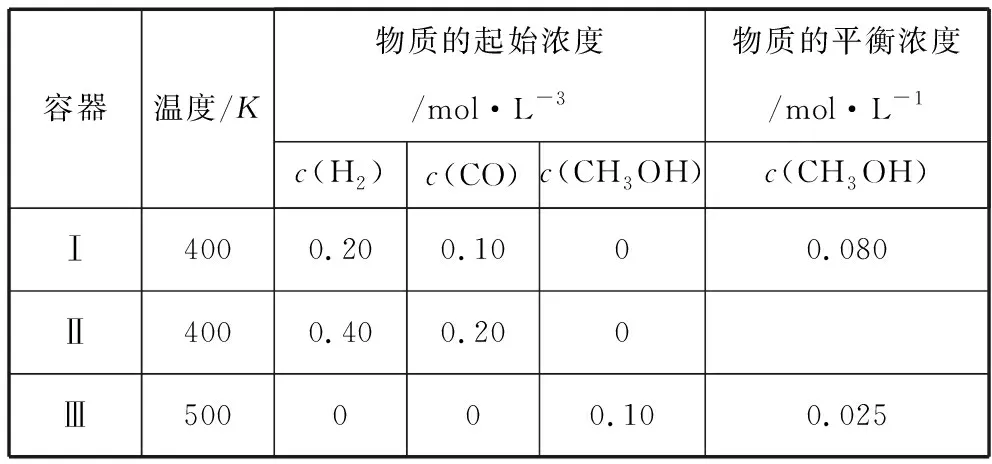
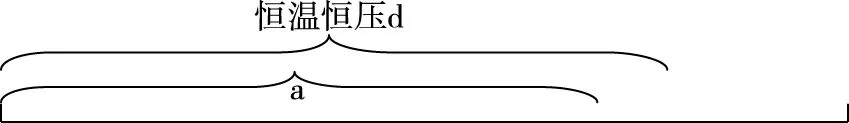
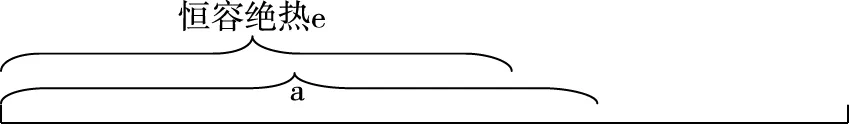
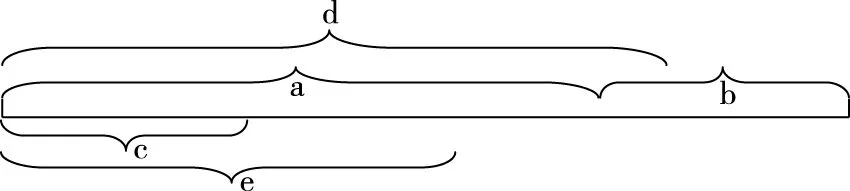
【分析】c组加入各物质的量为a组一半,可建立图2模型,容积共2 L,加入量共1 mol N2和3 mol H2,中间加隔膜,即等效成a组。1 L密闭容器中各组分物质的量是a组的一半,反应物转化率、气体平均摩尔质量、产物物质的量百分含量均与a组相同、放出热量是a组的一半。c组相当于从a组中移出0.5 mol N2和1.5 mol H2并撤去隔膜保持容积2 L不变。质量为a组的一半,体积由1 L增大到2 L,相当于减小压强,减压平衡逆向移动,模型如图3所示,可看成c组从左向右进行程度比a组的一半还少,即α3<α1;Q3<0.5Q1;η3<η1;M3 图2 图3 3.d组充入1 mol N2和3 mol H2保持恒温恒压,达到平衡后反应物转化率α4,放出热量Q4,产物NH3物质的量的百分含量η4,气体平均摩尔质量M4,气体密度ρ4。 【分析】如图4建立分析模型,a组保持恒温恒容,d组保持恒温恒压。已知工业合成氨正向进行气体压强减小,要想保持压强不变需向里推无摩擦隔膜,相当于对恒温恒容的a组继续加压,使平衡再正向移动,结果是压强不变,体积减小,正向进行程度更大。模型如图5,即α4>α1;Q4>Q1;η4>η1;M4>M1;ρ4>ρ1。 图4 图5 4.e组充入1 mol N2和3 mol H2保持恒容绝热,达到平衡后反应物转化率α5,放出热量Q5,产物NH3物质的量的百分含量η5。 【分析】绝热体系不与环境发生热量交换,正向吸热可使体系温度降低,正向放热可使体系温度升高,即为“自作自受”。合成氨正向反应为放热反应,平衡后绝热体系能量变大,温度升高,相对于恒温恒容条件下的平衡再逆向移动,模型如图6所示,即α5<α1;Q5 图6 综合以上五种情况,绘制统一图示如图7: 图7 通过以上五种情况对比分析可知,针对在条件不同、初始投料不同且存在一定数量关系的同一可逆反应中,若以恒温恒容为参照物,通过建立分析思维模型,更便于比较不同条件下平衡移动后各种量的变化情况。所以,通过领悟命题人的命题意图,深入思考研发解法模型,可以感知命题方向、优化解题方式、领悟知识关联、建立思维习惯、提高复习课实效、提升学生学科素养。 【例1】(2019·浙江选考·17)下列说法正确的是 ( ) D.1 mol N2和3 mol H2反应达到平衡时H2转化率为10%,放出热量Q1;在相同温度和压强下,当2 mol NH3分解为N2和H2的转化率为10%时,吸收热量Q2,Q2不等于Q1 【答案】B 【解析】缩小反应容器体积各种物质浓度增大,正逆反应速率均增大,A错误;变量不变说明反应已经达到平衡,B正确;若A、C均为气体,反应前后气体物质的量不相等,压强不变说明反应达到平衡,C错误;2 mol NH3可以等效成1 mol N2和3 mol H2,模型如图8,左右两侧挡板可自由移动,两者转化率相等,吸放热相同,所以Q2=Q1,D错误。 图8 表1 下列说法正确的是 ( ) A.v1 B.K1>K3,p2>2p3 C.v1 D.c2>2c3,α2(SO3)+α3(SO2)<1 【答案】CD 【解析】如图9,容器1中充入2 mol SO2和1 mol O2于700 K时反应,容器2中左上等同于容器1,右侧分别充入2 mol SO2和1 mol O2,容器2右侧等效成2份容器1,达到平衡后撤去右侧中间隔板,如图9③,各种物质浓度不变,平衡不移动,此时v(SO2)、c(SO3)、平衡总压强p与容器1相同,平衡转化率α1+α2=1、K1=K2,将图9④中平衡物质压缩到左下方,虚拟平衡正向移动得到如图9⑤,所以v1 图9 ( ) A.加入NaOH,可增大乙醇的物质的量 B.增大HBr浓度,有利于生成C2H5Br C.若反应物物质的量均增大至2 mol,则两种反应物平衡转化率之比不变 D.若起始温度提高至60℃,可缩短反应达到平衡的时间 ( ) 表2 A.该反应的正反应放热 B.达到平衡时,容器Ⅰ中反应物转化率比容器Ⅱ中的大 C.达到平衡时,容器Ⅱ中c(H2)大于容器Ⅲ中c(H2)的两倍 D.达到平衡时,容器Ⅲ中的正反应速率比容器Ⅰ中的大 【答案】1:D 2:AD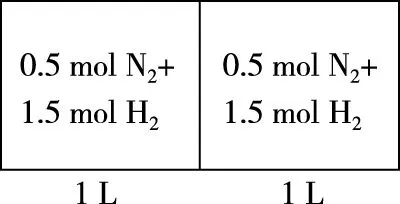


五、例题分析