元素综合推断题的常见考查方式分类例析
安徽 尉言勋 杜松庭
元素综合推断题考查面广,综合性强,题目通常给予物质结构、物质特性、框图等信息,以此推断元素类别。在知识层面上,结合“位、构、性”三者的对应关系,常考查短周期主族元素性质递变规律:如微粒半径大小、氢化物的稳定性、最高价氧化物对应水化物的酸碱性、金属性与非金属性、氧化性与还原性、电负性、第一电离能等基础知识。在能力层面上,考查学生在熟练掌握基本知识的情况下,能够灵活运用到对应题目所给信息的分析推理中去,即考查学生的分析推理能力以及宏观辨识与微观探析、证据推理与模型认知的学科素养。元素综合推断题在高考中的题型以选择题为主,预测2021年高考仍将以元素推断的形式呈现,考查角度不变。本文选取了典型高考试题,并进行了深度分类解析,希望对学生复习备考起到一定的帮助作用。
类型一 依据核反应方程式推断元素
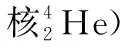
( )
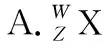
B.X、Y均可形成三氯化物
C.X的原子半径小于Y的
D.Y仅有一种含氧酸
【答案】B
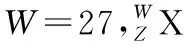
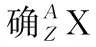
【关注点】试题可能会结合物理前沿最新发现,比如新的微粒的发现或新的化学元素的合成,以此作为题目的素材。
类型二 给予化合物的组成结构示意图
【例2】(2020·全国卷Ⅱ·13)一种由短周期主族元素组成的化合物(如图所示),具有良好的储氢性能,其中元素W、X、Y、Z的原子序数依次增大、且总和为24。下列有关叙述错误的是
( )
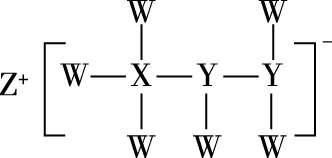
A.该化合物中,W、X、Y之间均为共价键
B.Z的单质既能与水反应,也可与甲醇反应
C.Y的最高化合价氧化物的水化物为强酸
D.X的氟化物XF3中原子均为8电子稳定结构
【答案】D
【解析】根据图示可知,W的原子能形成1个共价键,W为氢元素,Z为+1价阳离子,Z为Na元素,Y形成3个共价键,则Y应为N元素,W、X、Y、Z的原子序数之和为24,24-1-11-7=5,X为B元素。H元素、B元素、N元素三种非金属元素之间形成的化学键均为共价键,A正确;Na既可以与水反应,也可以和甲醇反应,B正确;N元素的最高价氧化物对应的水化物为硝酸,C正确;三氟化硼中硼原子最外层有3个电子,与氟原子之间形成3个共价键,即最外层共6个电子,不满足8电子稳定结构,D错误。
【点评】本题以图示形式呈现物质的结构特点,考查化学键的类型、物质的性质、酸性强弱等基础知识点。题目侧重考查学生的分析能力及逻辑推理能力,涉及化学核心素养中的证据推理与模型认知。元素推断是本题的难点,结合题目给出的信息以及元素的成键特点,可得X为B元素,Y为N元素,X容易误判为氮元素或碳元素。
【关注点】由于铍元素、硼元素最外层电子数较少,在形成化合物时,可形成两个和三个共价键,容易与氧元素、氮元素混淆,故而会增大题目难度,应当引起重视,可在教学中适当补充其相关知识。
类型三 给予电子总数关系式、反应现象
【例3】(2020·全国卷Ⅲ·13)W、X、Y、Z为原子序数依次增大的短周期元素,四种元素的核外电子总数满足X+Y=W+Z;化合物XW3与WZ相遇会产生白烟。下列叙述正确的是
( )
A.非金属性:W>X>Y>Z
B.原子半径:Z>Y>X>W
C.元素X的含氧酸均为强酸
D.Y的氧化物水化物为强碱
【答案】D
【解析】根据化合物XW3与WZ相遇会产生白烟,可知W为H元素,X为N元素,Z为Cl元素,又因四种元素的核外电子总数满足X+Y=W+Z,则Y为Na元素。Na为金属元素,非金属性最弱,非金属性Y
【点评】本题根据常见元素化合物的性质,推断元素种类,考查非金属性、原子半径、酸碱性等常规考点,要熟练掌握周期表的结构,元素周期律的相关知识,以及常见物质的性质。
【关注点】熟练掌握重要反应的典型信息,比如2018年全国卷Ⅲ13题,给出信息“盐YZW与浓盐酸反应,有黄绿色气体产生,此气体同冷烧碱溶液作用”,2018年全国卷Ⅰ12题,给出信息“W与Z形成的化合物可与浓硫酸反应,其生成物可腐蚀玻璃”。
类型四 依据原子结构特点推断元素
【例4】(2020·浙江7月选考·16)X、Y、Z、M、Q五种短周期元素,原子序数依次增大。Y元素的最高正价为+4价,Y元素与Z、M元素相邻,且与M元素同主族;化合物Z2X4的电子总数为18个;Q元素的原子最外层电子数比次外层少一个电子。下列说法不正确的是
( )
A.原子半径:Z B.最高价氧化物对应水化物的酸性:Z>Y>M C.X2Z—ZX2易溶于水,其水溶液呈碱性 D.X、Z和Q三种元素形成的化合物一定是共价化合物 【答案】D 【解析】根据Y的最高正价为+4,则证明该元素位于ⅣA族,又知Y元素与Z、M元素相邻,且与M同族,则在元素周期表位置应为 ⅣA族ⅤA族YZM 故推知Y为C元素,Z为N元素,M为Si元素;化合物Z2X4的电子总数为18,则推知该化合物为N2H4,X为 H元素;Q元素的原子最外层电子数比次外层少一个电子,可知Q为Cl元素。原子半径:Z(N) 【点评】本题可通过原子序数、元素的位置、原子结构等相关信息来推断元素,考查半径、酸碱性、化合物类型等常规考点,侧重考查学生提取信息能力、分析与应用能力。 【关注点】肼(N2H4)是除了NH3之外常见的氮的化合物,应关注,可在教学中适当补充其相关知识。 【例5】(2020·山东卷·3)短周期主族元素X、Y、Z、W的原子序数依次增大,基态X原子的电子总数是其最高能级电子数的2倍,Z可与X形成淡黄色化合物Z2X2,Y、W最外层电子数相同。下列说法正确的是 ( ) A.第一电离能:W>X>Y>Z B.简单离子的还原性:Y>X>W C.简单离子的半径:W>X>Y>Z D.氢化物水溶液的酸性:Y>W 【答案】C 【解析】由题意基态X原子的电子总数是其最高能级电子数的2倍,若X为第二周期元素原子,则X可能为Be元素或O元素,若X为第三周期元素原子,不符合题意。Z与X能形成Z2X2的淡黄色化合物,可推测为Na2O2,则X为O元素,Z为Na元素;Y与W的最外层电子数相同,则Y为F元素,W为Cl元素。四种元素中第一电离能:F>O>Cl>Na,A错误;简单离子的还原性:O2->Cl->F-,B错误;简单离子半径:Cl->O2->F->Na+,C正确;HCl的酸性强于HF,D错误。 【点评】本题通过原子序数、元素化合物知识、原子结构来推断元素,考查第一电离能、离子的还原性、半径等相关知识,侧重考查学生分析问题的能力以及应用能力。 【例6】(2020·天津卷·8)短周期元素X、Y、Z、W的原子序数依次增大。用表中信息判断下列说法正确的是 ( ) 元素最高价氧化物的水化物 XYZWH3ZO40.1 mol·L-1溶液对应的pH(25℃)1.0013.001.570.70 A.元素电负性:Z B.简单离子半径:W C.元素第一电离能:Z D.简单氢化物的沸点:X 【答案】A 【解析】由H3ZO4为弱酸可得Z为P元素;根据pH为0.70,可得该物质为多元强酸,结合原子序数依次增大,可得W的最高价氧化物对应的水化物为硫酸,则W为S元素;pH为13.00,说明该物质为一元强碱,为NaOH,则Y为Na元素;pH为1.00,说明该物质为HNO3,则X为N元素。S的电负性大于P,故A正确;电子层数越多离子半径越大,简单离子半径:S2->Na+,故B错误;ⅡA、ⅤA族元素的第一电离能比相邻两个主族的电离能大,故第一电离能:P>S,故C错误;由于氨气分子间含氢键,则简单氢化物的沸点:NH3>PH3,故D错误; 【点评】本题结合原子序数、最高价含氧酸的pH来推断元素种类,涉及元素的电负性、第一电离能、离子半径等相关知识的考查,侧重考查学生提取图表信息能力,分析问题能力及应用能力。难点是需要注意物质含分子间氢键可以增大其熔沸点。 【关注点】综合分析例5、例6两题得到如下结论:①题目中涉及知识点有第一电离能、基态原子、最高能级电子、电负性、氢化物沸点——氢键知识。知识点出处为2019年新教材人教版和鲁科版选择性必修2《物质结构与性质》的内容。②例5、例6出自2020年山东和天津高考题,从中可以看出考题内容不再拘泥于传统考题的选考模式,《物质结构与性质》所有内容都为必修、必考,使得物质相关性质的知识更完整、更系统、更全面,命题者可以从更多的角度出发设计试题,考查学生对知识体系的全面熟悉程度和综合运用能力。这是新高考的趋势,需要引起我们的重视,新高考省份要注意必修2与选择性必修2《物质结构与性质》的综合考查。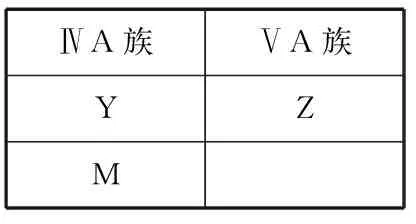
类型五 给予电子总数与能级之间的关系以及物质颜色
类型六 以表格形式给予信息