核心素养理念下的化学平衡常数计算命题特点探析
河北 李子春 袁 颖
《普通高中化学课程标准(2017年版2020年修订)》对化学平衡常数的考查要求较高,要求学生“能书写”平衡常数,“能进行”平衡常数和转化率的计算,“能利用”平衡常数与浓度商的关系判断反应是否达到平衡及平衡移动的方向,这“三能”是学生必备的关键能力。化学平衡常数计算考查学生的“归纳与论证”能力,是新高考的热点题型。
一、化学平衡常数的考查内容分析
化学平衡常数是化学平衡理论的核心概念,命题特点是通过生产生活或学术探索情境,培养学生的学科核心素养。考查的目标是创设可逆反应并通过数据计算论证可逆反应是否达到平衡、平衡移动的方向、组分的平衡浓度。近三年高考和2021年1月5省适应性考试的考查内容如表1所示:
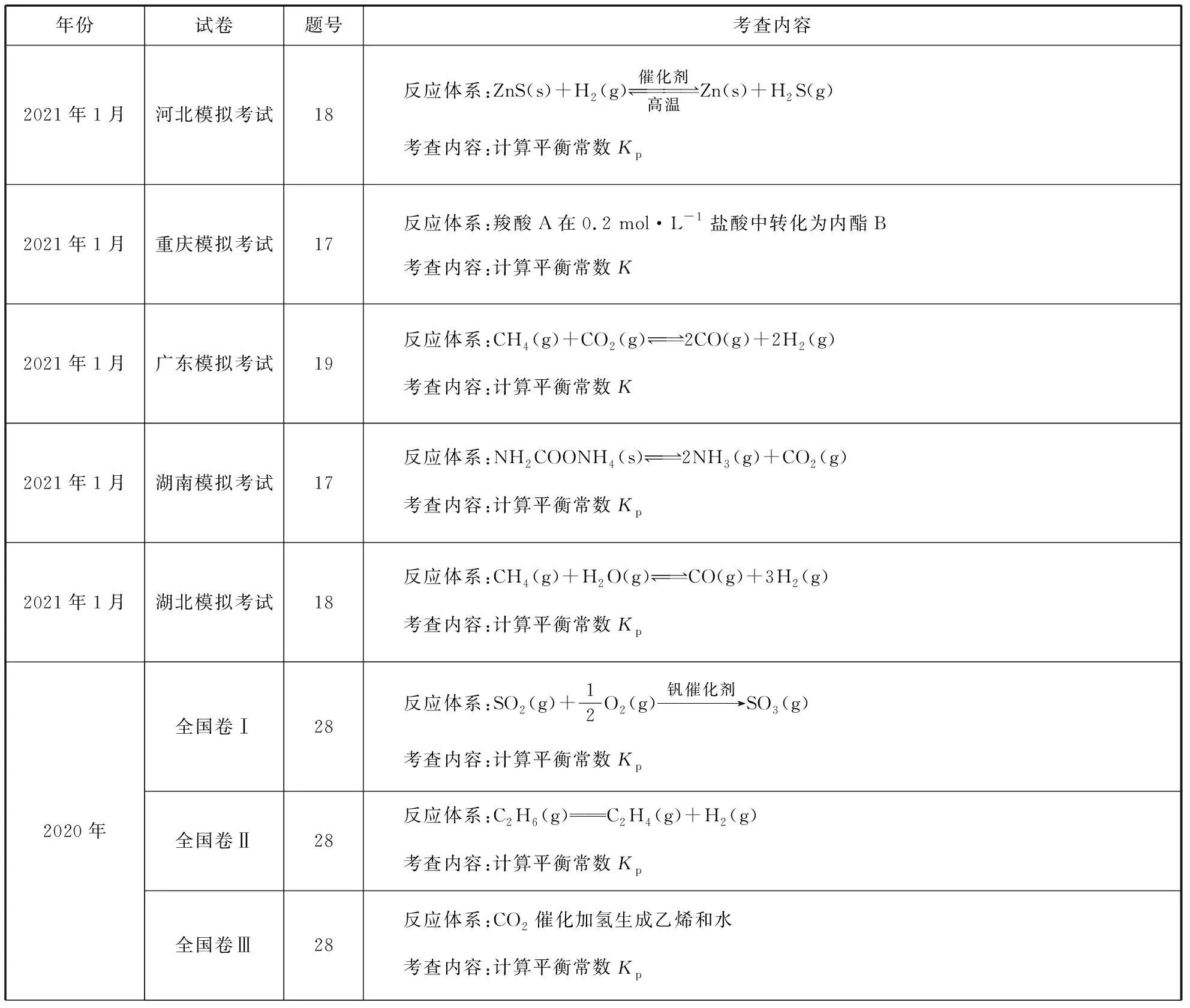
表1

续表
二、化学平衡常数的考查形式分析
近三年高考和2021年1月5省适应性考试情境创设均聚焦在平衡体系的创设上,情境可分为单一反应体系、连续反应体系和平行反应体系,而求解平衡常数的公式通常用浓度或压强来表示。
1.创设单一反应体系情境,凸显知识的基础性
要掌握化学平衡常数的计算问题,首先建立反应体系,从题干数据入手进行归纳和论证,从而找到解决平衡常数计算的依据和方法。
【例1】(2019·全国卷Ⅲ·28节选)近年来,随着聚酯工业的快速发展,氯气的需求量和氯化氢的产出量也随之迅速增长。因此,将氯化氢转化为氯气的技术成为科学研究的热点。回答下列问题:

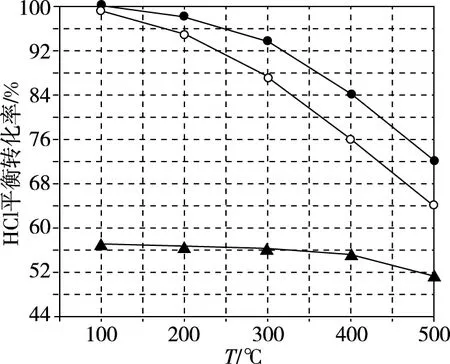
图1
可知反应平衡常数K(300℃)________(填“大于”或“小于”)K(400℃)。设HCl初始浓度为c0,根据进料浓度比c(HCl)∶c(O2)=1∶1的数据计算K(400℃)=________(列出计算式)。

【情境创设】本题的反应体系由单一反应构建,通过列三段式可求出物质的平衡浓度。
【数据论证】根据化学方程式可知,HCl的平衡转化率越大,平衡常数越大,结合图像可知,升高温度,HCl的平衡转化率降低,说明升高温度平衡向逆移,则K(300℃)>K(400℃);由图像知,400℃时,HCl的平衡转化率为84%,通过列三段式对数据进行处理:

2Cl2(g)+2H2O(g)
起始浓度c0c00 0
变化浓度 0.84c00.21c00.42c0
0.42c0
平衡浓度(1-0.84)c0(1-0.21)c00.42c0
0.42c0

【模型构建】依据原料的起始量和转化量计算各组分的平衡浓度,可构建如下思维模型:
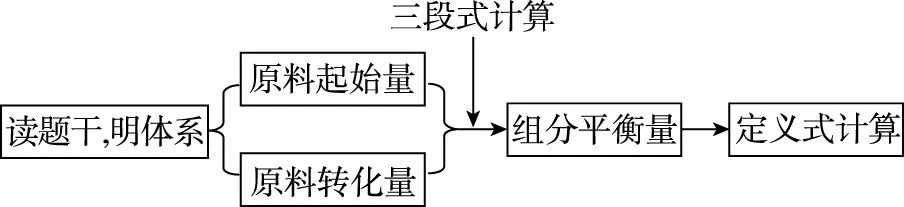
图2
2.创设多反应体系情境,凸显能力的综合性
创设多反应体系情境将平衡常数计算的难度增大,而解决该问题的关键是理清反应次序关系和数据关系。
【例2】(2020·山东卷·18节选)探究CH3OH合成反应化学平衡的影响因素,有利于提高CH3OH的产率。以CO2、H2为原料合成CH3OH涉及的主要反应如下:



回答下列问题:
一定条件下,向体积为VL的恒容密闭容器中通入1 mol CO2和3 mol H2发生上述反应,达到平衡时,容器中CH3OH(g)为amol,CO为bmol,此时H2O(g)的浓度为________mol·L-1(用含a、b、V的代数式表示,下同),反应Ⅲ的平衡常数为________。

【情境创设】本题为平行反应体系,解决问题的关键为理清各种物质量的关系,确定了平衡的浓度,即可进行计算。
【数据论证】假设反应Ⅱ中,CO反应了xmol,则反应Ⅱ中生成的CH3OH为xmol,反应Ⅰ生成的CH3OH为(a-x) mol,反应Ⅲ生成的CO为(b+x) mol,根据:

(a-x) mol 3(a-x) mol (a-x) mol (a-x) mol

xmol 2xmolxmol

(b+x) mol (b+x) mol (b+x) mol (b+x) mol
【例3】(2019·天津卷·7节选)在1 L真空密闭容器中加入amol PH4I固体,t℃时发生如下反应:


达平衡时,体系中n(HI)=bmol,n(I2)=cmol,n(H2)=dmol,则t℃时反应①的平衡常数K值为________(用字母表示)。

【情境创设】本题的反应体系为连续反应体系,解决问题的关键为寻找每种物质的最终平衡量,即容器中每一种微粒平衡时的浓度只有一个。

【模型构建】依据反应确定化学反应平衡的体系,理清反应次序,确定体系达到平衡时各微粒的转化关系,由此计算化学平衡常数。
3.创设信息迁移情境,凸显现场学习能力
近几年高考试题素材新颖,通过给出公式或定义式考查学生现场学习能力和运用知识解决问题的能力。该角度由表1可看出已成为近几年命题的热点,着重考查学生现场学习能力。
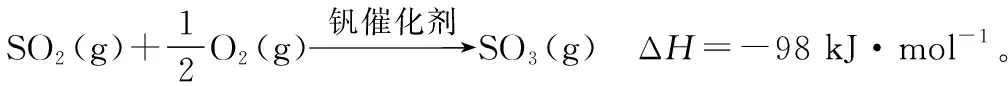

图3

图4
将组成(物质的量分数)为2m% SO2(g)、m% O2(g)和q% N2(g)的气体通入反应器,在温度t、压强p条件下进行反应。平衡时,若SO2转化率为α,则SO3压强为________,平衡常数Kp=________(以分压表示,分压=总压×物质的量分数)。
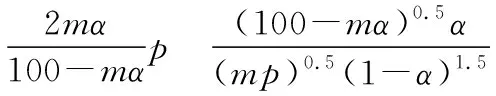
【情境创设】在恒压条件下计算各气体组分的平衡分压,计算各组分的物质的量分数是必要的条件。
【数据论证】根据反应的化学方程式,运用平衡计算的方法,设起始总的物质的量为1 mol,可以列出以下关系(为简化,单位略写):
化学计量数: 1 0.5 1
起始量: 2m%m% 0
转化量: 2m%αm%α2m%α
平衡量: 2m%-2m%αm%-m%α2m%α

【例5】(2018·全国卷Ⅰ·28节选)F.Daniels等曾利用测压法在刚性反应器中研究了25℃时N2O5(g)分解反应:


2N2O4(g)
其中NO2二聚为N2O4的反应可以迅速达到平衡。体系的总压强p随时间t的变化如表所示(t=∞时,N2O5(g) 完全分解):
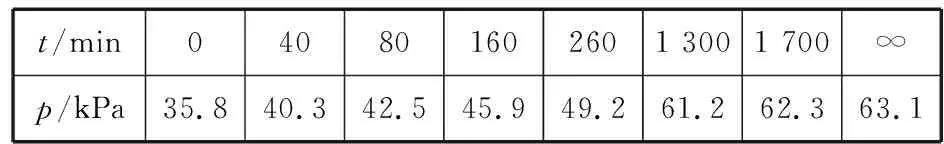
t/min040801602601 3001 700∞p/kPa35.840.342.545.949.261.262.363.1

【答案】13.4
【情境创设】体系总压随反应进行发生变化,反应达到平衡时,根据各组分的压强,计算平衡常数。


初始压强/kPa 0 71.6
转化压强/kPax2x
平衡压强/kPax71.6-2x

【模型构建】若为可变压强的条件,要利用物质的量比等于压强比求平衡总压;若为恒压条件,直接利用物质的变化量分数进行解答。此题的关键点为通过分压定义式进行计算,题干中给出的平衡分压定义需要学生现场学习,因此要培养学生现场迁移应用的能力。
三、原创展示,剖析化学平衡常数计算的命题特点
试题情境聚焦在平衡建立的体系上,情境可分为单一反应体系、连续反应体系和平行反应体系。计算平衡常数时可以用浓度或压强表达,试题通常以两种体系进行考查:容器压强随反应进行不变的体系;容器压强随反应进行可变的体系;多角度考查学生归纳与论证能力。
【原创题】氢能源属于二次能源,目前从石化资源中制取氢气是满足人们氢能需求的主要途径。其中水煤气变换反应在氢气生产环节中占有重要地位,每年有超过4千亿立方米的氢气由该反应产生:

回答下列问题:
水煤气变换反应的机理被广泛研究,相关研究者认为其按以下步骤进行:

①平衡常数K可用于表示反应体系中气体物质的分压表示,即K表达式中用平衡分压代替平衡浓度,分压=总压×物质的量分数。写出水煤气变换反应的平衡常数Kp的表达式:____________________。
②在一定温度,100 kPa下,将等物质的量的CO和H2O(g)充入2 L恒容密闭容器中发生反应,达到平衡时测得HCOOH与CO2的压强之比为1∶3,CO的转化率为40%,则反应Ⅰ的平衡常数Kp=________ (kPa)-1。

【情境创设】试题以新能源研发过程涉及的平衡理论为命题点,要求学生理解“水煤气变换反应”的反应机理,理清反应顺序,能计算化学平衡常数。
【识别证据】读懂设问①的语言与概念,联想平衡常数Kp的表达式。理解恒容条件下CO和H2O连续反应变化的规律,通过迁移化学平衡常数定义解决问题。


起始 /molaa0
变化 /mol 0.4a0.4a0.4a
平衡 /mol 0.6a0.6a0.4a
考虑到反应Ⅱ的发生,设在反应过程中HCOOH的物质的量变化为xmol,可列出三段式:
起始 /mol 0.4a0 0
变化 /molxxx
平衡 /mol 0.4a-xxx

四、结束语


