福林酚法测定檀香橄榄中总多酚含量的研究
吴晓青,孙燕丽,钟碧萍
(福建生物工程职业技术学院,福建 福州350007)
橄榄又名青果,为橄榄科植物橄榄(Canarium album Raeusch.)的果实,是一种药食两用的水果[1]。有研究表明:橄榄中所含的主要成分为多酚类化合物,如没食子酸、并没食子酸、短叶苏木酚等,具有增强免疫、抗氧化、抗病毒、抗菌消炎、镇痛、解酒护肝、抑制血糖升高、增加骨密度和骨钙含量、抗乙肝病毒等作用[2-4]。 福建橄榄产量居全国之首,故开发橄榄多酚产品对带动和促进橄榄的产业化发展具有重要意义。 目前对于橄榄总多酚含量测定的方法多采用福林酚(folin-ciocalteu,FC)法,但随着产地或品种的不同,试验条件各不相同[5-7]。 檀香橄榄是橄榄科橄榄属下的植物,为福建省名贵的果树,原产于闽清县安仁溪一带,宋朝开始栽培,已有数百年的栽培历史,现已发展到闽侯、福州郊区、长乐、连江、永泰、莆田、仙游及漳浦等地栽培。 故本研究建立FC 法测定檀香橄榄中总多酚的含量,为进一步筛选闽产橄榄品种,开发橄榄多酚产品提供参考。
1 仪器与试药
1.1 仪器 UV-1800PC DS2 型紫外可见分光光度计(上海美谱达仪器有限公司);AL 204 电子天平(梅特勒-托利多仪器上海有限公司);KQ-600GKDV 型高功率恒温数控超声波清洗器(昆山市超声仪器有限公司);SHA-B 恒温振荡器(常州国华电器有限公司);DS-1 高速组织捣碎机(上海精科实业有限公司)。
1.2 试药 檀香橄榄(产地:福建闽清,经福建中医药大学中药鉴定教研室范世明高级实验师鉴定为橄榄科植物橄榄(Canarium album Raeusch.)的果实;没食子酸对照品(上海源叶生物科技有限公司,批号 B20851,纯度≥98%);碳酸钠、FC、无水乙醇等试剂均为分析纯。
2 方法与结果
2.1 供试品溶液的制备 取橄榄鲜果适量,去核,60 ℃热风干燥,粉碎(过40 目筛),即得橄榄粉末;精密称取橄榄粉末约1 g,加60%乙醇溶液30 mL,40 ℃水浴超声提取25 min,趁热过滤,取2 mL 滤液至50 mL 量瓶中,加水稀释至刻度,即得供试品溶液。
2.2 对照品溶液的制备 精密称取没食子酸对照品0.100 8 g,置 100 mL 量瓶中,蒸馏水溶解,并稀释至刻度,摇匀,即得1 mg/mL 没食子酸对照品贮备液;精密吸取对照品贮备液2.5 mL 至100 mL 量瓶中,蒸馏水稀释至刻度,即得浓度约为25 μg/mL的没食子酸对照品溶液。
2.3 测定波长的选择 分别精密量取供试品溶液和对照品溶液适量,分别置于刻度离心管中;加FC试剂 2.0 mL、10%碳酸钠6 mL,摇匀,加水稀释至25.0 mL,在30 ℃恒温振荡器中反应1 h,以溶剂试剂为空白,反应后在600~900 nm 波长范围扫描。结果表明:两种溶液在765 nm 处均有最大吸收峰,故选择 765 nm 为测定波长。 结果见图1。

图1 对照品溶液和供试品溶液吸收光谱图
2.4 FC 法测定条件的优化
2.4.1 FC 试剂用量的考察 取1.0 mL 供试品溶液至刻度离心管中,分别加入FC 试剂0.5、1.0、1.5、2.0、2.5、3.0 mL,加 10% Na2CO3溶液 6.0 mL,加水稀释至25.0 mL,摇匀,在30 ℃恒温振荡器中反应1 h,于765 nm 处测定吸光度。 结果表明:当FC 试剂加入量为2.0 mL 时吸光度趋于稳定,故确定FC 试剂用量为 2 mL。 结果见图2。
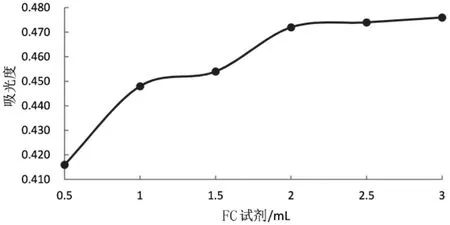
图2 FC 试剂用量考察图
2.4.2 10% Na2CO3溶液用量的考察 取1.0 mL 供试品溶液至刻度离心管中,加FC 试剂2.0 mL,分别加入 10% Na2CO3溶液 3.0、4.0、5.0、6.0、7.0、8.0 mL,加水稀释至25.0 mL,摇匀,在30 ℃恒温振荡器中反应1 h,于765 nm 处测定吸光度。 结果表明:当10% Na2CO3溶液加入量为4.0 mL 时吸光度达到最大,而加入量大于6.0 mL 时,吸光度反而开始下降。故确定10% Na2CO3溶液加入量为4.0 mL。 结果见图3。

图3 10% Na2CO3 溶液用量考察图
2.4.3 反应温度的考察 分别取1.0 mL 供试品溶液至刻度离心管中,加FC 试剂2.0 mL,再加入10%Na2CO3溶液 4.0 mL,加水定容至 25.0 mL,摇匀,分别在 30、40、50、60 ℃的恒温振荡器中反应1 h,于765 nm 处测定吸光度。 结果表明:相同时间内,在50 ℃恒温振荡器中反应的吸光度最大,反应最完全,故确定供试品溶液反应温度为50 ℃。 结果见图4。
2.4.4 反应时间的考察 分别取1.0 mL 供试品溶液至刻度离心管中,加入FC 试剂2.0 mL,10%Na2CO3溶液 4.0 mL,加水定容至 25.0 mL,摇匀,在50 ℃恒温振荡器中分别反应 15、30、45、60 min 后,于765 nm 处测定吸光度。结果表明:反应30 min 时吸光度达到稳定,故确定供试品溶液反应时间为30 min。 结果见图 5。
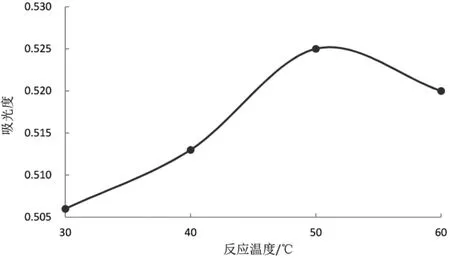
图4 反应温度考察图

图5 反应时间考察图
2.4.5 正交设计试验与结果分析 为进一步考察各因素之间的交互作用,采用L9(34)正交试验进一步优化,分别精密量取1.0 mL 供试品溶液,其他实验条件一致,对 FC 试剂用量(A)、10% Na2CO3溶液用量(B)、反应温度(C)和反应时间(D) 4 个因素进行优化。 实验因素水平设计见表1,正交实验结果见表2。
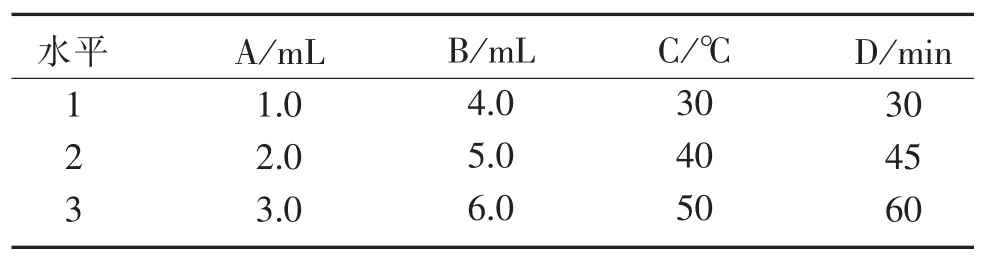
表1 因素水平表
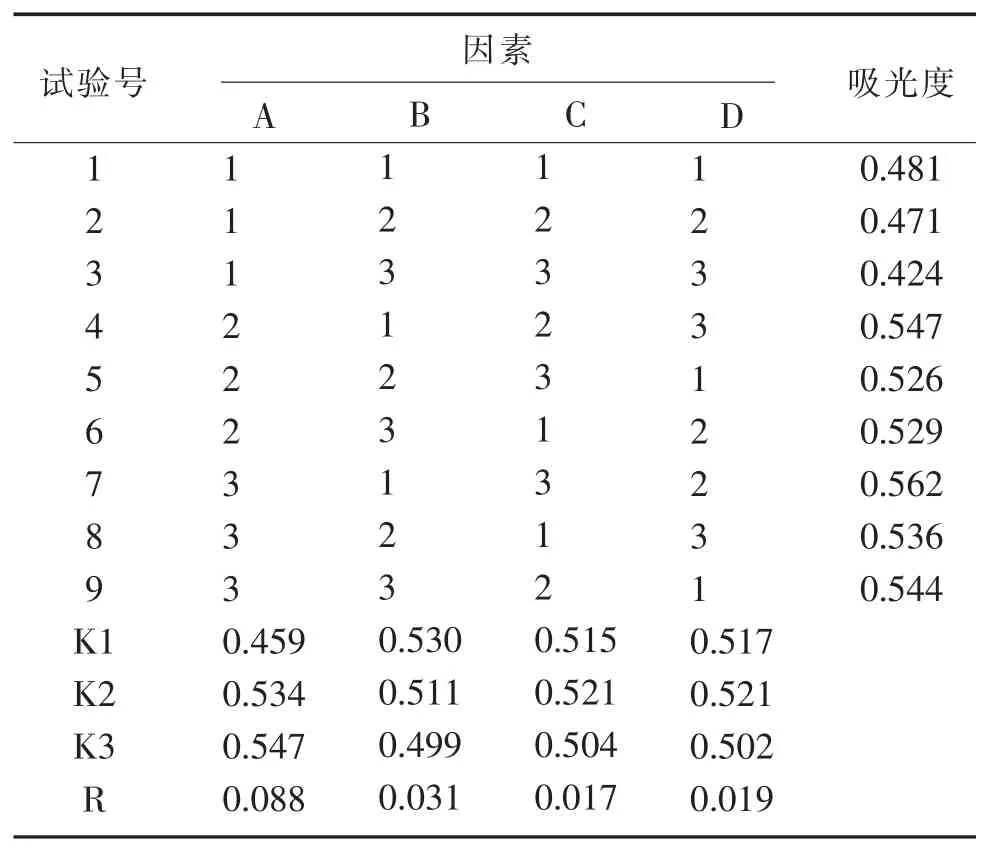
表2 正交试验结果
对表2 进行直观分析可知:极差大小显示各因素的影响作用依次为A>B>D>C,最佳显色条件为 A3B1C2D2,即 1.0 mL 供试品溶液中加 FC 试剂3.0 mL,10%碳酸钠溶液 4.0 mL,40 ℃恒温振荡器中反应45 min。 由于反应条件最佳理论组合不在9 个实验中,故追加验证实验。 取3 批次的供试品溶液,分别取1.0 mL,按最佳反应条件进行验证实验,反应后测得的吸光度(0.569、0.568、0.564)均略高于正交试验中试验号 7 的测定值(0.562、0.563、0.559),因最佳组合温度更低,更节能,故选择最佳理论组合作为FC 法测定闽产檀香橄榄总多酚含量的条件。
2.5 方法学验证
2.5.1 标准曲线的制备及线性关系的考察 精密量取对照品溶液 1.0、2.0、3.0、4.0、5.0 mL,分别置刻度离心管中,按檀香橄榄总多酚含量测定的最佳条件,以溶剂试剂为空白,测定吸光度,以吸光度为纵坐标,浓度为横坐标,绘制标准曲线,结果见图6。回归方程为:y=0.1350x+0.006 9,r=0.999 7,表明没食子酸在 1.008 0~5.040 0 μg/mL 范围内具有良好的线性关系。
2.5.2 精密度实验 分别精密吸取同一对照品溶液1.0 mL,共6 份,分别置刻度离心管中,按檀香橄榄总多酚含量测定的最佳条件,测定吸光度,吸光度分别为 0.569、0.567、0.559、0.562、0.565、0.564,RSD=0.63%。 结果表明仪器精密度良好。

图6 没食子酸标准曲线图
2.5.3 重复性实验 精密称取同一批闽产檀香橄榄粉约1 g,共6 份,按“2.1”项下和檀香橄榄总多酚含量测定的最佳条件测定吸光度值,计算闽产檀香橄榄总多酚含量,结果分别为7.80%、7.62%、7.59%、7.79%、7.72%和7.76%,檀香橄榄总多酚的平均含量为 7.71%,RSD=1.18%。 结果表明该方法重复性符合要求。
2.5.4 稳定性实验 取供试品溶液1.0 mL,按檀香橄榄总多酚含量测定的最佳条件,显色后室温下放置,于 0、2、4、6、8、12 h 测定吸光度,吸光度分别为0.565、0.568、0.569、0.567、0.564、0.560,RSD=0.58%。结果表明反应后放置12 h 均稳定。
2.5.5 加样回收率实验 分别精密称取同一批次檀香橄榄粉约0.5 g,共6 份,分别精密加入约38.55 mg没食子酸对照品,按“2.1”项下和檀香橄榄总多酚含量测定的最佳条件测定吸光度值,计算回收率,结果见表 3。 结果表明该方法准确可靠,可用于檀香橄榄总多酚的定量分析。
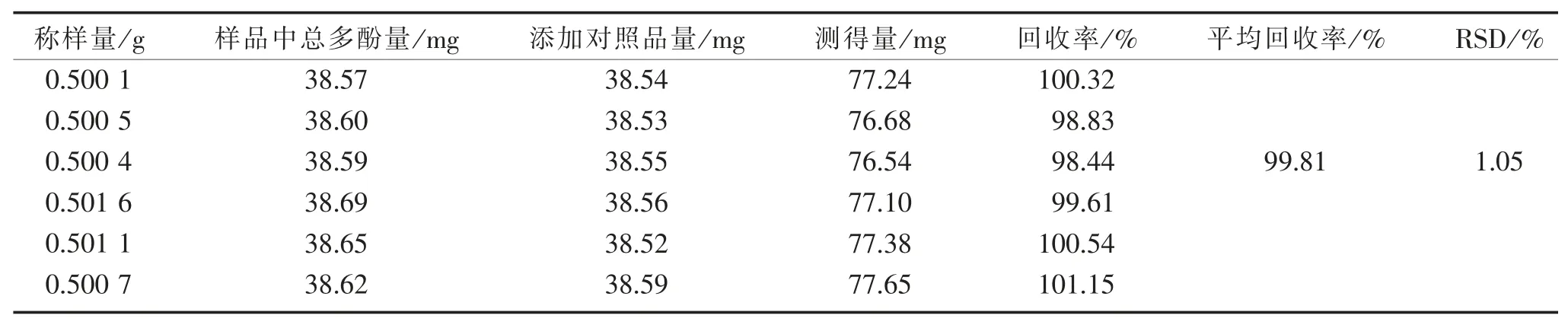
表3 加样回收率实验结果
2.5.6 檀香橄榄中总多酚含量测定 分别取3 批次橄榄,每批次平行测定3 份,按“2.1”项下和檀香橄榄总多酚含量测定的最佳条件测定吸光度值,计算总多酚含量。 结果见表4。
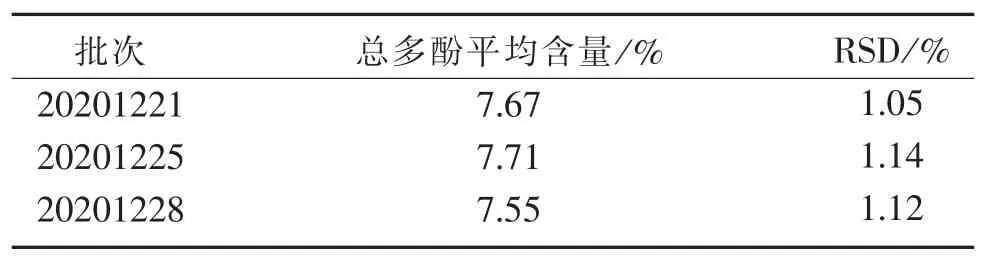
表4 檀香橄榄中总多酚含量测定结果
3 讨 论
FC 法是利用在碱性溶液中,酚类化合物可将钨钼酸还原(使W6+变为W5+),生成蓝色的化合物,颜色的深浅与酚含量成正比的原理进行测定总多酚含量。 本实验以闽清檀香橄榄为测定对象,首次采用单因素试验结合正交试验对FC 法的测定条件进行优化。 根据比尔定律,吸光度与吸光物质量的浓度成正比,对于同一供试品溶液,吸光度越大,说明反应越完全,故本实验以吸光度作为衡量测定条件优劣的评价指标,建立了檀香橄榄中总多酚的含量测定方法。本实验首次采用单因素结合正交实验优化FC 法测定檀香橄榄总多酚的条件,充分考虑各因素的交互作用,建立的方法稳定、简单、准确,可作为檀香橄榄总多酚含量的测定方法,为后续闽产橄榄多酚产品的开发奠定基础。

