长链非编码RNA MIAT在幽门螺杆菌感染胃溃疡中的表达和作用机制
严皓哲,王勇兴,贝 艺
(普陀医院 消化内科,浙江 舟山 316100)
胃溃疡可导致患者出现腹痛、反酸、嗳气、呕血、便血,甚至胃穿孔等严重并发症。部分患者由于胃溃疡迁延不愈,可进一步恶化为胃癌,严重威胁患者的生命健康安全[1]。针对胃溃疡的抗生素结合胃黏膜保护剂、抑酸药物等三联治疗方案取得了一定的治疗效果,但胃溃疡的发生率依然居高不下[2]。相较于miRNA等其他非编码RNA,长链非编码RNA的生物学作用复杂,具有调控多种基因和其他非编码RNA的转录,转录后修饰,蛋白翻译前、翻译后修饰,功能蛋白转运和定位等作用[3-4]。大量研究[5]发现,长链非编码RNA参与机体生长发育和多种疾病的发生,幽门螺杆菌感染是导致胃溃疡发生的重要因素。本研究探讨长链非编码RNA MIAT在幽门螺杆菌感染胃溃疡中的表达意义和作用机制。
1 材料和方法
1.1 主要试剂和仪器 DMEM培养基、胎牛血清、磷酸盐缓冲液(PBS)、0.25%胰蛋白酶-DETA、青霉素-链霉素等均购自Hyclone公司,弯曲杆菌琼脂基础培养基、Trizol、Lipofectamine 3000购自Thermo公司,PrimeScriptTMRT reagent Kit with gDNA Eraser、SYBR©Premix Ex TaqTMII购自TaKaRa公司,CCK-8细胞活力检测试剂盒、Annexin V-FITC/ PI流式凋亡试剂盒购自江苏凯基生物科技有限公司,IL-1β、IL-6和TNF-α ELISA试剂盒购自R&D公司。CO2细胞培养箱购自冠森生物科技(上海)有限公司,倒置显微镜购自日本奥林巴斯公司,紫外分光光度计购自梅特勒-托利多国际有限公司,实时荧光定量PCR仪购自Applied Biosystems公司,流式细胞仪购自BD公司。
1.2 一般资料 收集2016年1月—2018年12月普陀医院幽门螺杆菌感染的胃溃疡患者120例及经胃镜检查胃黏膜正常的患者100例。纳入标准:①胃溃疡患者经胃镜检查和胃黏膜病理诊断确诊为胃溃疡;②胃黏膜正常患者经胃黏膜病理检查诊断胃黏膜正常。排除标准:①存在胃炎、胃间质瘤、胃恶性肿瘤等胃肠道其他疾病患者;②存在慢性感染、免疫功能障碍或其他可影响治疗观察指标的疾病患者;③存在心肺功能不全、肝肾功能障碍等内外科严重疾病患者。胃溃疡组男60例,女60例;年龄20~60岁,平均(35.6±8.7)岁。正常组男50例,女50例;年龄20~60岁,平均(35.2±8.1)岁。两组研究对象年龄、性别比较差异均无统计学意义(P>0.05)。本研究经医院伦理委员会批准,全部研究对象均签署知情同意书。
1.3 细胞和幽门螺杆菌培养 人胃黏膜上皮细胞GES-1购自中科院上海细胞库,采用含10% 胎牛血清和1%青链霉素的DMEM培养基培养,培养条件为37℃、5% CO2。全部细胞学实验传代次数小于10次。幽门螺杆菌(H.pylori)购自美国National Collection of Type Culture(国际标准株NCTC11637)。采用一次性涂布器将对数生长期的幽门螺杆菌液100 μL(2×107CFU/mL)均匀接种至弯曲杆菌琼脂基础培养基,于85% N2、10% CO2和5% O2的三气培养箱中培养48 h后,收集细菌置入无菌PBS中获取细菌悬液,采用麦氏比浊仪检测幽门螺杆菌菌液浓度。
1.4 胃黏膜损伤模型构建 分别以感染复数(MOI)1∶1、50∶1、100∶1、150∶1、200∶1、250∶1、300∶1的剂量培养GES-1细胞和幽门螺杆菌24 h。采用CCK-8检测细胞活性,计算IC50,作为幽门螺杆菌感染造模的MOI值[6]。
1.5 组织、血浆和细胞RNA提取 胃镜活检时夹取研究对象5 mm溃疡或正常组织2~3块。于胃镜检查前抽取肘静脉血2 mL,置EDTA抗凝管中,4℃ 1 200 g离心10 min,收集上清血浆。收集生长状态良好的GES-1细胞加入1 mL Trizol混匀。组织、血浆和细胞RNA提取均采用Trizol法[7]。
1.6 实时荧光定量PCR 采用逆转录试剂盒去除总RNA中残留的基因组DNA,反转录构建cDNA,反应体系20 μL,按照试剂盒说明书步骤进行。实时荧光定量PCR反应条件:50℃ 2 min,94℃ 10 min,(94℃ 15 s,60℃ 1 min)持续40个循环。引物均由北京博迈德生物技术有限公司设计合成,采用GAPDH mRNA 为内参。引物: MIAT: F: 5’-TTACTTTAACAGACCAGAA-3’, R’: 5’-CTCCTTTGTTGAATCCAT-3’;GAPDH: 5’-AGAAGGCTGGGGCTCATTTG-3’,R:5’-GCAGGAGG CATTGCTGATGAT-3’。
1.7 细胞转染 MIAT过表达质粒(MIAT-OE)和MIAT-empty vector阴性对照空载体(MIAT-EV)由上海吉玛生物科技有限公司协助设计并合成。选取生长状态良好的GES-1细胞,胰酶消化并充分重悬细胞,以5×105接种至6孔板中。采用Lipofectamine 3000分别转染MIAT-OE和MIAT-EV至GES-1细胞,转染6 h后换液,继续培养48 h后提取RNA。采用实时荧光定量PCR检测MIAT的表达效果。
1.8 细胞活性 采用CCK-8试剂盒检测GES-1细胞活性。GES-1细胞以100 μL(3×103个细胞)接种于96孔培养板中,同时加入100 μL不含细胞的DMEM培养基作为空白对照组,每组4个重复孔。持续培养24、48、72、96和120 h后,每孔加入10 μL CCK-8试剂,37℃继续孵育3 h,采用酶标仪检测450 nm波长的吸光度值(A),计算细胞存活率。细胞存活率(%) =(A转染-A空白)/(A对照-A空白)×100%。
1.9 细胞凋亡检测 分别向6孔培养板每孔中接入5×105个生长状态良好的正常GES-1细胞,生长至汇合度90%时采用不含EDTA的胰酶充分消化细胞,获取单细胞悬液,依次加入5 μL Annexin V-FITC+PI避光孵育15 min,1 h内采用流式细胞仪检测细胞凋亡情况。
1.10 炎症因子水平检测 收集细胞培养上清液,12 000 g离心10 min后取上清液。采用IL-1β、IL-6和TNF-α ELISA试剂盒检测,按照试剂盒说明书步骤进行。
1.11 统计学处理 全部实验重复3次,采用SPSS22.0统计软件。计量资料比较采用t检验,计数资料比较采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 MIAT在幽门螺杆菌感染胃溃疡患者中的表达 胃溃疡组溃疡组织和血浆的MIAT的表达水平均低于正常组,差异有统计学意义(P<0.001)。120例胃溃疡患者中,76例为幽门螺杆菌阳性。幽门螺杆菌阳性的胃溃疡患者的溃疡组织和血浆中的MIAT表达水平均低于幽门螺杆菌阴性的胃溃疡患者,差异有统计学意义(P<0.001)。见图1。

***P<0.001。图1 MIAT在幽门螺杆菌感染胃溃疡患者中的表达Figure 1 The expression of MIAT in patients with gastric ulcer infected by Helicobacter pylori
2.2 幽门螺杆菌感染胃溃疡模型的构建 分别向GES-1细胞中加入不同MOI的幽门螺杆菌处理,培养24 h后,经CCK-8检测,发现随着MOI的升高,细胞增殖逐渐降低。据此计算IC50,MOI=116.32∶1,见图2a。以MOI=116.32∶1为幽门螺杆菌感染的MOI值,培养24 h,检测GES-1细胞中MIAT的表达。幽门螺杆菌感染后GES-1细胞的MIAT表达水平降低,差异有统计学意义(P<0.001),见图2b。
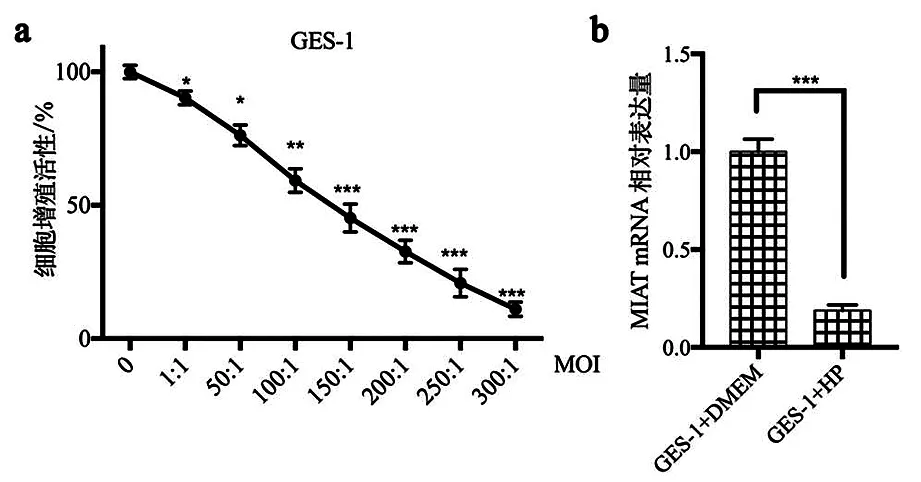
a: CCK-8检测幽门螺杆菌感染后GES-1细胞的增殖;b: 实时荧光定量PCR检测幽门螺杆菌感染后GES-1细胞的MIAT表达;***P<0.001, **P<0.01, * P<0.05。图2 幽门螺杆菌感染胃溃疡模型的构建Figure 2 Construction of Helicobacter pylori infection gastric ulcer model
2.3 过表达MIAT对幽门螺杆菌感染的GES-1细胞增殖的影响 MIAT过表达转染后的GES-1细胞的MIAT表达增加,差异有统计学意义(P<0.001),见图3a。感染幽门螺杆菌72、96、120 h后,GES-1细胞增殖均降低,差异均有统计学意义(P<0.05)。转染MIAT后,HP感染的GES-1细胞的增殖均高于未转染MIAT的GES-1细胞和未转染MIAT的HP感染的GES-1细胞,差异均有统计学意义(P<0.05),见图3b。
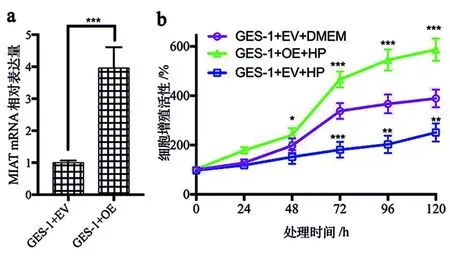
a: 实时荧光定量PCR检测GES-1细胞的MIAT表达;b: CCK-8检测GES-1细胞的增殖;* P<0.05, **P<0.01, ***P<0.001。图3 过表达MIAT对幽门螺杆菌感染的 GES-1细胞增殖的影响Figure 3 The effect of overexpression of MIAT on the proliferation of Helicobacter pylori-infected GES-1 cells
2.4 过表达MIAT对幽门螺杆菌感染的GES-1细胞凋亡的影响 感染幽门螺杆菌后,GES-1细胞的凋亡率升高,差异有统计学意义(P<0.05)。转染MIAT后,HP感染的GES-1细胞的凋亡率均低于未转染MIAT的GES-1细胞和未转染MIAT的HP感染的GES-1细胞,差异均有统计学意义(P<0.05),见图4。
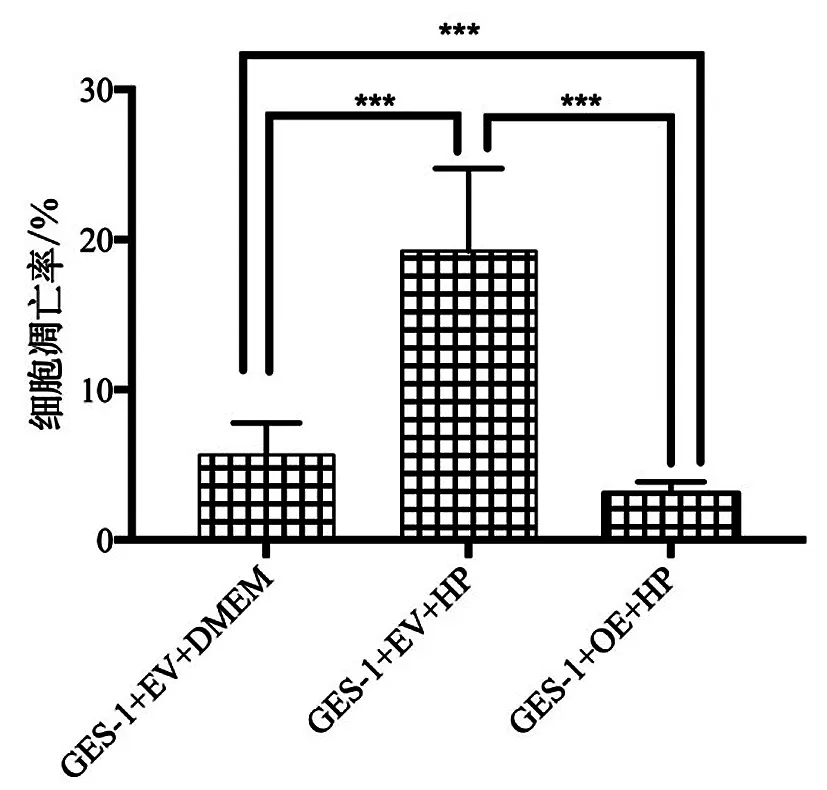
***P<0.001。图4 过表达MIAT对幽门螺杆菌感染的 GES-1细胞凋亡的影响Figure 4 The effect of overexpression of MIAT on the apoptosis of GES-1 cells infected by Helicobacter pylori
2.5 炎症因子水平 感染幽门螺杆菌后,GES-1细胞的IL-1β、IL-6及TNF-α水平均增加,差异均有统计学意义(P<0.05)。转染MIAT后,HP感染的GES-1细胞的IL-1β、IL-6及TNF-α水平均低于未转染MIAT的GES-1细胞和未转染MIAT的HP感染的GES-1细胞,差异均有统计学意义(P<0.05),见图5。
3 讨论
有研究[8]报道,MIAT在胃癌组织中存在异常的高表达现象,与患者的不良预后结局存在显著的相关性,进一步的机制研究发现MIAT通过调控miR-141/DDX5通路,可促进胃癌细胞的增殖、侵袭和转移,抑制凋亡,抵抗放化疗作用。MIAT 最早被发现于2000年,其染色体定位22q12.1,总长度30 051 bp。除胃癌外,已有研究[9-12]报道了MIAT在肝癌、肺癌、乳腺癌、卵巢癌、前列腺癌、肾癌、白血病、淋巴瘤、胶质瘤等恶性肿瘤中均存在促癌作用。MIAT在乳腺癌、肾癌中均存在显著的高表达现象,与患者不良预后结局高度相关,显著缩短患者生存时间[13-14]。另有研究[15-17]发现,高糖环境可通过调控MIAT的表达增强血管平滑肌细胞活力,体外培养的过表达MIAT血管内皮细胞可参与TNF-α介导的炎症反应等。
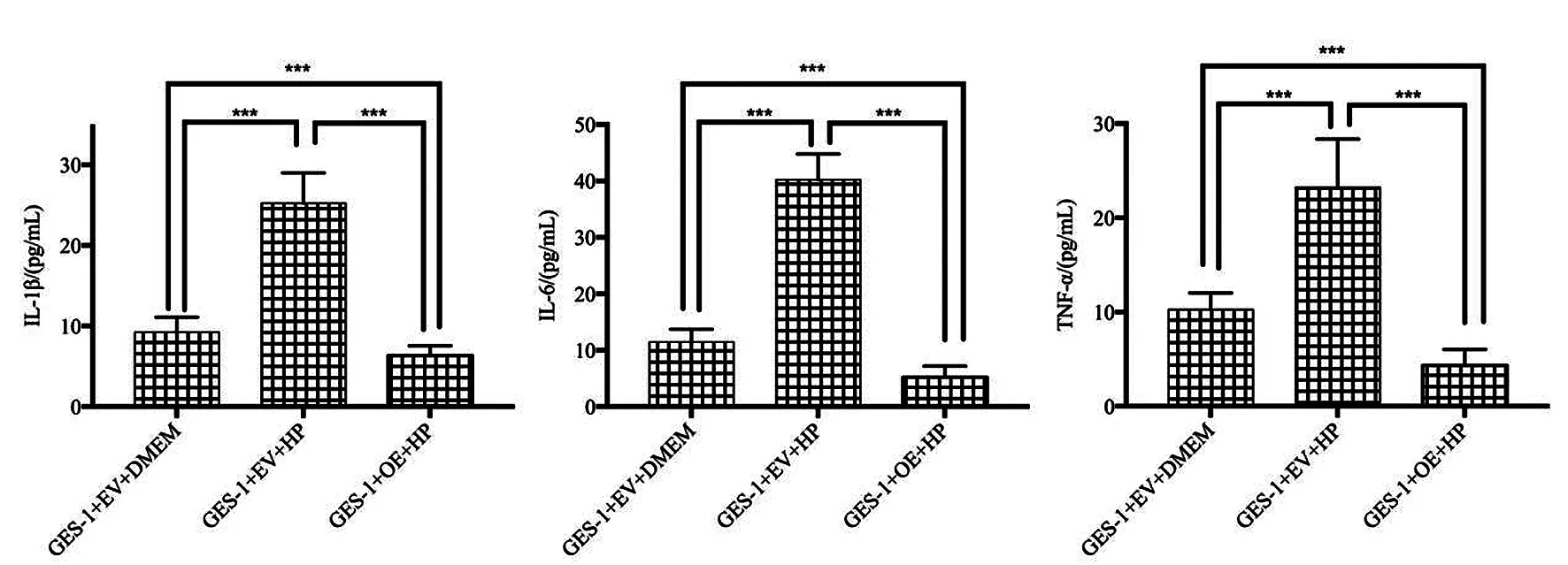
***P<0.001。图5 过表达MIAT对GES-1细胞炎症因子的影响Figure 5 The effect of overexpression of MIAT on inflammatory factors in GES-1 cells
本研究结果显示,胃溃疡组溃疡组织和血浆的MIAT的表达水平均明显低于正常组,幽门螺杆菌阳性的胃溃疡患者的溃疡组织和血浆中的MIAT表达水平均明显低于幽门螺杆菌阴性的胃溃疡患者,提示MIAT低表达参与胃溃疡的发生、发展,且MIAT低表达与幽门螺杆菌的感染存在可能的相关性[18-20]。本研究结果同时显示,幽门螺杆菌感染后GES-1细胞的MIAT表达水平明显降低。
另外,本研究结果显示,与未转染MIAT的GES-1细胞和未转染MIAT的HP感染的GES-1细胞比较,转染MIAT后,HP感染的GES-1细胞的增殖明显增加,凋亡率和炎症因子IL-1β、IL-6及TNF-α水平均明显降低,提示胃黏膜细胞MIAT的表达下调可影响胃黏膜细胞的活性和稳定性,导致胃黏膜细胞凋亡和炎症反应;推测通过提高幽门螺杆菌感染的胃黏膜细胞的MIAT表达水平,可增强胃黏膜细胞的活性,维持其稳定性,控制炎症反应,实现胃黏膜的保护作用。
综上,长链非编码RNA MIAT在幽门螺杆菌感染的胃溃疡中存在低表达现象,MIAT的过表达可促进幽门螺杆菌感染后的胃黏膜上皮细胞增殖,降低凋亡率和炎症反应。

