多联噻吩连接的共价三嗪骨架聚合物的研究
吴 凯,周瑞雪
(江汉大学 化学与环境工程学院,湖北 武汉 430056)
共价有机框架化合物(covalent organic frameworks,COFs)是将有机单体以共价键结合,通过热力学控制的可逆反应生成二维或三维高度有序结晶性多孔聚合物。这类化合物通常具备质量轻、比表面积高、化学稳定性和热稳定性好的优点,而且COFs 结构还有可设计性好、功能可调控性强的特点,在气体存储与分离、催化、传感、储能和传输性材料等方面都有广泛的应用。其中,共价三嗪骨架聚合物(covalent triazine-based frameworks,CTFs)是以三嗪环为核心,通过功能化的单体连接,最终聚合形成的框架结构聚合物[1]。CTFs 合成较为简单,引入非对称结构单体形成的聚合物有着丰富的孔道结构,辅以变化丰富的连接基元结构或单体官能团,如含特殊官能团的芳腈单体,所得到的功能化的CTFs 材料在荧光材料、锂硫电池电极材料、二氧化碳选择性吸附、可见光催化剂等方面都已有应用报道[2-6]。
另一方面,和金属有机骨架材料(metal organic frameworks,MOFs)类似,金属与COFs 形成的复合物也表现出不俗的性能[7]。其中,非贵金属或无金属CTFs 在性能上并不突出,通常较少被重视,但这一类研究成果在经济性和广泛性方面具有明显优势,因此依旧具备较好的研究前景[8-9]。比如,利用三嗪环的强吸电子性和荧光性质,与富电子的噻吩衍生物共同构建的星型化合物,聚合后形成了十分稳定的具有电氧化和电还原双极电性质的聚合物[10]。三嗪和噻吩结构组合形成的可调荧光CFTs,具备三嗪骨架的热稳定性和良好的电子传输特性,同时引入的噻吩连接官能团改变了原有化合物的光学特性,可应用于光化学器件[11-14]。本研究则在此类设计思路基础之上,制备以不同数量的噻吩结构连接的共价三嗪骨架结构聚合物,以期获得具备系列光学特性的CTFs。
1 材料与表征仪器
1.1 材料
合成所使用的分析纯5-溴-2-噻吩甲腈、2,5-二溴代噻吩、2-噻吩甲腈、碳酸钾、特戊酸、四(三苯基膦)钯、N,N-二甲基乙酰胺(DMF)、甲苯、四氢呋喃、丁醇、二甲亚砜、三氟甲磺酸和二氯甲烷均从萨恩化学采购。
1.2 测试仪器
红外光谱仪(布鲁克(德国)TENSOR27);紫外可见光谱仪(上海美析UV-1900);扫描电镜(日立(日本)SU8010);热失重分析仪(耐驰(德国)TG209F3);比表面积及孔径分析仪(麦克默耐瑞提克(美国)ASAP2020M)。
2 单体和聚合物的合成
2.1 S2、S3 和 S4 的合成
如前文所述,单体合成是CTFs 聚合反应的原料。本系列使用的二联、三联、四联噻吩单体S2、S3 和S4 合成步骤相对简明经济。合成路线如图1 所示,其典型过程可概述为:每一当量的含溴杂环单元,加入对应3 倍溴位点数当量的2-噻吩甲腈,1.5 倍溴位点数目当量的碳酸钾和0.15 倍的特戊酸,催化剂用量为每个位点对应4%的四(三苯基膦)钯。以干燥的N,N-二甲基乙酰胺和甲苯混合溶液为溶剂,比例为1∶1(体积比),溶度为0.23 mol/L,氩气保护下,110 ℃搅拌,反应持续48 h。反应结束后,反应混合物加水稀释,用硅藻土辅助过滤获得固体,再用乙醚洗涤。固体在四氢呋喃/乙醚1∶1(体积比)混合溶剂中溶解后,离心除去白色沉淀。上清液蒸发掉溶剂获得粗产物,再将其在适当的溶剂如1-丁醇或者甲苯中重结晶,最终产物二联噻吩单体S2产率为19.7%,三联噻吩单体S3 产率为39%,四联噻吩单体S4 产率为17.5%。
2.2 聚合物 T1S2、T1S3 和 T1S4 的合成
CTFs 的合成路线从最初的离子热法发展而来,目前,三氟甲烷磺酸催化室温聚合是其中较为简便高效的。此方法合成的CTFs 多为无定形或低结晶度的聚合物,但又具备一定的比表面积,其骨架架构虽不及高度结晶的COFs 规整,但其光学特性得以较大保留,且反应条件温和利于后续制膜工艺步骤[15],故以此为本研究所涉及聚合物的合成方法。具体合成方法如下:取单体200 mg 溶于二甲亚砜3 mL,加入约3 mL 的三氟甲磺酸,混合物迅速大量放热,并出现大量固体,然后Ar 气氛保护下,混合物搅拌加热至100 ℃并持续反应8 h。反应结束后冷却至室温,加入200 mL 冰水,大量固体析出,过滤得粗产物。然后水洗,二氯甲烷洗,烘干,得到最终产物:T1S2 为 147 mg、T1S3 为 168 mg、T1S4 为 152 mg,产率分别为:73.5%、84%、76%。
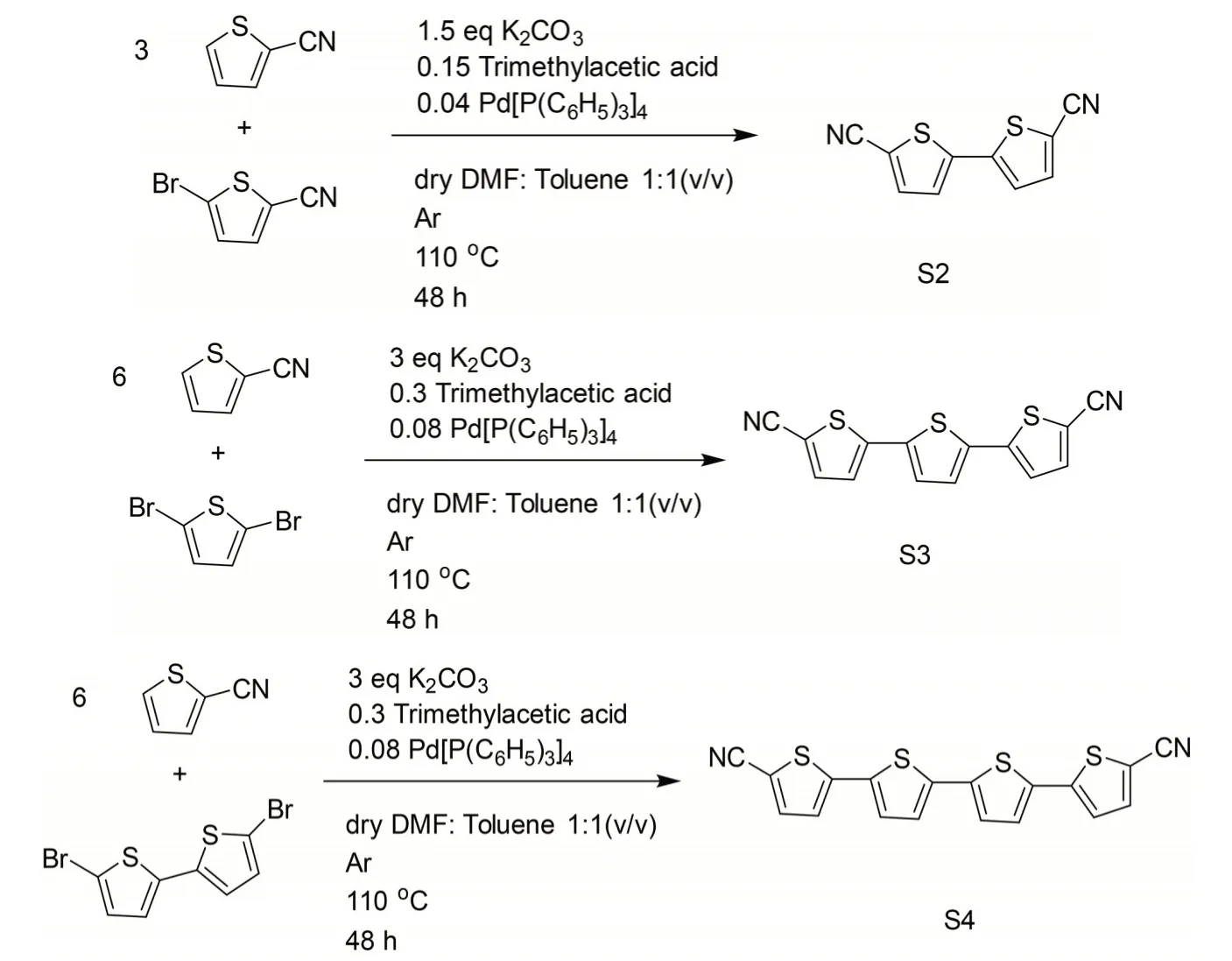
图1 噻吩单体S2、S3 和S4 的合成路线Fig.1 Synthesis of monomers S2, S3 and S4
3 结果与讨论
3.1 单体及聚合物的结构表征
聚合物T1S2、T1S3 和T1S4 结构如图2 所示,递增数量的噻吩基团作为连接部分,与三嗪结构共同组合为聚合物的一个重复单元,而后构建聚合物的网络结构。考虑到本方法所得聚合物特性为结晶度较低,直接获取单晶以解析绝对构型难度太大,因此,本工作采用超导核磁共振谱图确认单体结构,而后通过红外光谱,对比单体与聚合物在聚合反应前后的变化,以及同系列聚合物的差异。红外谱图如图3 所示。
以二联噻吩单体S2 和对应的聚合物T1S2 为例,单体氰基峰(2 212 cm-1)在聚合后几乎消失,并在3 000 cm-1以上区域出现聚噻吩的宽吸收峰。单体典型的峰位因共轭程度增加而出现向较低波数方向移动的情况,如典型C-S 键强峰(807 cm-1)。单体聚合后还出现了位于1 666 cm-1和1 299 cm-1处的三嗪环特征吸收峰。比较每一组单体和对应聚合物的红外谱图,均有类似的变化,可以推测单体在聚合过程中已经较好地转化为聚合物。
需要注意的是,当每一个重复单元内引入的噻吩基元达到4 个时,单体S4 的红外光谱已出现类似聚噻吩结构的特点,在3 000 cm-1以上区域有宽吸收。聚合以后,T1S4 的峰型也更为尖锐,3 300 cm-1附近呈现出多分子缔合的宽吸收带,结合单体S4 在3 300 cm-1左右的吸收峰可以看出聚合后噻吩链之间更强的相互作用。1 044 cm-1附近C-C 键峰不仅向低波数移动更为明显,且透过率相对其他峰而言已大幅增加,可能是连接单元结构的强相互作用所致。

图 2 单体 S2、S3、S4 以及聚合物 T1S2、T1S3、T1S4 的结构Fig.2 Structures of monomers S2, S3, S4, and polymers T1S2, T1S3, T1S4

图 3 单体 S2、S3 和 S4 以及对应 CTFs 聚合物 T1S2、T1S3 和 T1S4 的红外光谱Fig.3 IR spectra of S2, S3, S4, and CTFs T1S2, T1S3, T1S4
3.2 聚合物热稳定性表征
CTFs 的热稳定性是决定其功能化应用范围的重要性质。本工作涉及的CTFs 系列产物的热稳定性呈现规律性变化(图4)。伴随着引入的噻吩结构增多,热失重曲线中分解温度逐渐增加,T1S2 最低,T1S3 和T1S4 的分解温度已经由240 ℃提升至300 ℃以上。由此证明,较多的噻吩单元对聚合形成的CTFs 的热稳定性提供了正向的影响。但是,由图4 可以明确看到,聚合物的分解温度并不是线性增长,没有伴随噻吩单元的数量递增而出现线性相关的变化。由此推测,强吸电子的三嗪结构和富电子的噻吩结构间,虽然存在强烈的相互作用,并提升了结合力,改善了结构的稳定性,但是较长的噻吩连接链中,并非所有杂环重复单元都受这种电子结构的影响,当引入的噻吩环达到4 个时,聚合物的热稳定性被影响的趋势已经放缓,热稳定性变化趋近平稳。

图4 聚合物T1S2、T1S3、T1S4 的热失重曲线Fig.4 TG curves of T1S2, T1S3, T1S4
3.3 聚合物孔结构表征
CTFs 通常具备多孔结构,且常表现出大孔特性。聚合物T1S2、T1S3、T1S4 的孔结构依靠实测氮气吸脱附曲线和理论计算来表征。图5(a)是氮气吸附曲线表现出比表面积的对比,T1S3呈现出与另外两种材料完全不同的特征,3 种材料没有拐点或明显吸附平台,并且吸附气体量随组分分压的增加而加速上升,T1S3 与另外两者相比存在一个H3 型回滞环,代表T1S3 孔形状尤为不规整,这一点在扫描电镜结果(图6)中得到了印证。图5(b)是孔径分布图像,由峰型与峰位置可以看出T1S2 与T1S4 的孔径分布更加分散,聚合物的孔结构呈现典型的大孔材料特点,存在明显拐点并且没有平台过程。伴随着引入的连接链基团的长度增加,其聚合物孔径并不是简单的线性增长,而是呈现更复杂的变化趋势。相对于T1S2 与T1S4,代表T1S3 的孔径特征峰明显更窄,并且峰位置更加靠近左侧,峰位置集中于15 ~20 nm 之间,这代表T1S3 的孔径分布虽更集中,部分符合介孔材料的描述,但孔分布依旧分散;而T1S2 与T1S4 峰宽更大,说明这两种物质的孔径分布更为分散,大部分孔的孔径要大于50 nm。这一数据表示,3 个噻吩连接的T1S3聚合物,有较大可能性是最优的支撑这类CFTs 的结构设计,能够提供足够的孔径并保有合适的强度,在适度的共轭作用下,保持较大的孔径结构。

图5 聚合物T1S2、T1S3、T1S4 的氮气吸脱附曲线(a)和孔径分布(b)Fig.5 N2 adsorption-desorption isotherms (a) and pore size distribution curves (b) of T1S2, T1S3, T1S4
扫描电镜结果(图6)从微区形貌描述方面印证了这一点,图6(b)为T1S3 的扫描电镜图像,相比于另两种聚合物,T1S3 具有更大更开放的空腔,但没有明显的孔洞。而T1S2 和T1S4 的电镜图片(图6(a)和图6(c))反映出约50 nm 直径的孔洞和复杂的交联结构。推测加长的噻吩链由于缺乏足够的作用力支撑,所形成的多孔结构没有随着链的延长而扩张,反而由于强烈的电子推拉和π 电子作用,电子结构改变,聚合物呈现多维复杂的交联状态。

图 6 聚合物 T1S2(a)、T1S3(b)、T1S4(c)的扫描电镜图Fig.6 FESEM images of T1S2 (a), T1S3 (b), T1S4 (c)
3.4 聚合物光谱性质表征
本工作设计的系列CTFs 具备光学领域应用的可能性,因此本工作针对系列聚合物的基础光学性质进行了探索。图7 为系列聚合物溶解在N,N-二甲基乙酰胺中的紫外-可见吸收光谱,浓度为0.05 g/L,可以看出系列聚合物的吸收谱带如设计思路中预测的,发生了明显改变:T1S3聚合物具有最宽吸收,边带位于500 nm 附近,可推测其带隙出现最多的缩减,而T1S4 则呈现较窄的紫外区强吸收。以上变化证明噻吩基团的引入已经对聚合物的光学性质做出了大范围的调节。
这一结果和上文中孔结构的分析结果相互印证。对于刚性相对较弱的联噻吩连接基团,数量上噻吩环的递增直接影响了聚合物π-π*的最大吸收边带,从T1S2 到T1S3,出现明显红移,图2 中展示的重复单元的光学性质就与此相似,据报道称线性递增[12]。但当聚合物形成,更强的单元或分子间共轭作用使得这一性质在引入4 个噻吩环之后,反而出现蓝移。这也正是本系列设计聚合物需要探索的光学性质变化。

图 7 聚合物 T1S2、T1S3、T1S4 的紫外-可见光谱Fig.7 UV-vis spectra of T1S2, T1S3, T1S4
4 结论
本研究设计制备了一系列以三嗪环为骨架,以数个噻吩为连接基元的共价多孔聚合物,测试了其孔分布、热稳定性和光学性质,并推测了变化规律。研究结果显示逐步增多的噻吩结构提升了系列聚合物的热稳定性,并明显大幅改变了孔结构和吸光性能,但是多种性质的变化趋势不是线性的,聚合物的性质并不随单体噻吩链接基元的增加而线性递增,相反,噻吩和三嗪的互相作用更多地影响了聚合物的电子结构,以上多重因素共同作用,完成对系列CTFs 物化性质的调控。

