多指标综合评分结合正交试验法优选大鼠对乙酰氨基酚肝损伤模型
李紫元 , 龙小铃 , 陈彩萍 , 刘逸雷 , 梁伟燊 , 刘俊丹 ,邱文才 , 伦健炽 , 唐陆平 , 何永明
(佛山科学技术学院动物医学系 , 广东 佛山 528000)
对乙酰氨基酚又名扑热息痛(APAP)、醋氨酚,是临床上常用的解热镇痛药。治疗剂量的APAP有效、安全,但大剂量用药时会对实验动物和人造成肝损伤甚至肝衰竭[1-2]。目前,采用对乙酰氨基酚制作的肝损伤模型应用广泛,但是并没有一个稳定的造模方法,使得造模效果有较大差异[3-4]。本试验旨在探究给药剂量、染毒途径和采血时间等因素对APAP造成大鼠肝损伤模型效果的影响,为制作药源性急性肝损伤模型优化出最佳的条件。
1 材料与方法
1.1 实验动物 SPF级SD大鼠,体质量(170±20) g,雌雄各半,合格证号:SCXK(粤)2013-0002;高压灭菌全价颗粒饲料;动物和饲料由广东省实验动物中心提供。所有动物饲养于佛山科学技术学院动物室,室内温度为20~25 ℃,相对湿度为50%~70%。 每天12 h日光灯照明。垫料为消毒玉米芯。适应性饲喂3 d,挑选体重均匀的100只用于试验。
1.2 供试品和试剂 对乙酰氨基酚,购自河北冀衡(集团)药业有限公司,批号:71610195;丙氨酸氨基转移酶(谷丙转氨酶ALT,批号:16111503)、天冬氨酸氨基转移酶(谷草转氨酶AST,批号:16063002),均购自南京建成生物工程研究所;碱性磷酸酶(ALP,批号:H-170301)、总蛋白(TP,批号:Z-1601131)、白蛋白(ALB,批号:Z-160809)、总胆红素(TBIL,批号:A-171028)、直接胆红素(DBIL,批号:A-161120)等,均购自北京利德曼生化股份有限公司。
1.3 主要仪器 AU2700全自动生化分析仪,购自美国Backman公司;Leica组织切片机,购自上海徕卡显微系统有限公司;KD-BM生物组织包埋机、KD-T生物组织摊靠片机,均购自浙江省金华市科边仪器设备有限公司;G&G-JJ500电子天平,购自常熟双杰测试仪器厂。
1.4 正交设计 以APAP染毒剂量、染毒途径、采血时间为3个因素,每个因素选3个水平,按照L9(34)正交表安排试验,因素和处理见表1和表3。APAP用40 ℃蒸馏水配制,大鼠分别以灌胃(ig)、腹腔注射(ip)、皮下注射(sc)方式染毒,染毒后4、16 h和28 h用乙醚诱导麻醉,后腔静脉采血,分离血清用于生化检测(生化项目委托佛山市南海区第五人民医院检测)。取出肝脏,称量,计算肝系数。取相同部位肝脏用4%甲醛固定,进行组织病理学观察。
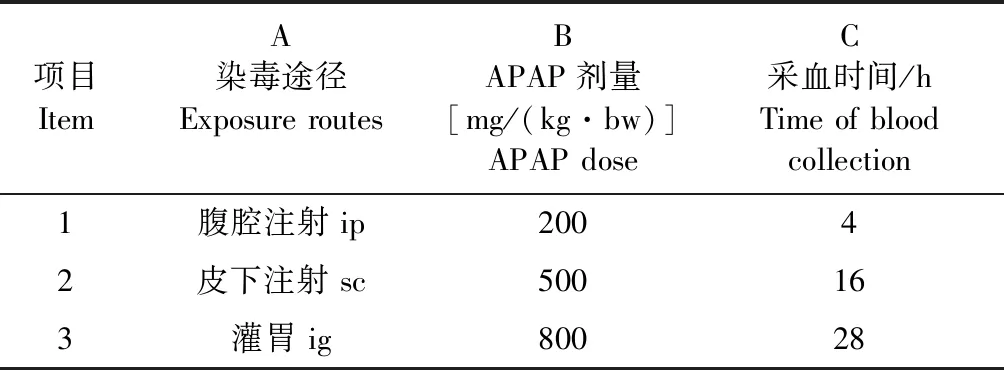
表1 APAP致大鼠肝损伤正交因素水平表Table 1 Orthogonal test of liver damage induced by APAP in rats
1.5 肝损伤综合评价 对乙酰氨基酚一般引起肝实质性细胞坏死,使得丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)、直接胆红素(DBIL)和总胆红素(TBIL)均会有显著升高,并且使肝脏肿大[5-6],根据各项指标在筛选条件中的主次赋予加比权重:ALT和AST为0.4 U/L;DBIL和TBIL为0.2 μmol/L;肝系数0.02;其他各项指标和为0.1。由此计算肝损伤的综合评价指标X。X=(ALT/ALTmax + AST/ASTmax)×0.4+(DBIL/DBILmax+TBIL/TBILmax)×0.2+肝系数/肝系数max×0.02+其他指标/其他指标max×0.1。
1.6 统计学处理 采用Excel表格收集整理数据,采用IBM SPSS Statistics 22.0软件进行统计学处理。资料先进行一般描述性分析,计算各计量资料的平均数、标准差。计量资料进行正态性检验,符合正态分布及方差齐性采用单因素方差分析;非正态分布或方差不齐采用秩和检验。性别统计分析组间差异采用t值分析。以P<0.05表示差异具有统计学意义。
2 结果
2.1 大鼠APAP致肝损伤的生化检测 结果见表2。肝系数(Liver coefficient,LC)第3组最高,各试验组显著高于对照组(P<0.05)。ALT第3组最高,各试验组显著高于对照组(P<0.05)。AST第3组最高,第1、2、3、4、6、8、9组显著高于对照组(P<0.05)。碱性磷酸酶各试验组与对照组间差异不具有显著性(P>0.05)。DBIL第2、3组最高,第2、3、4、5组显著高于对照组(P<0.05)。TBIL第4组最高,第1、2、3、4、9组显著高于对照组(P<0.05)。
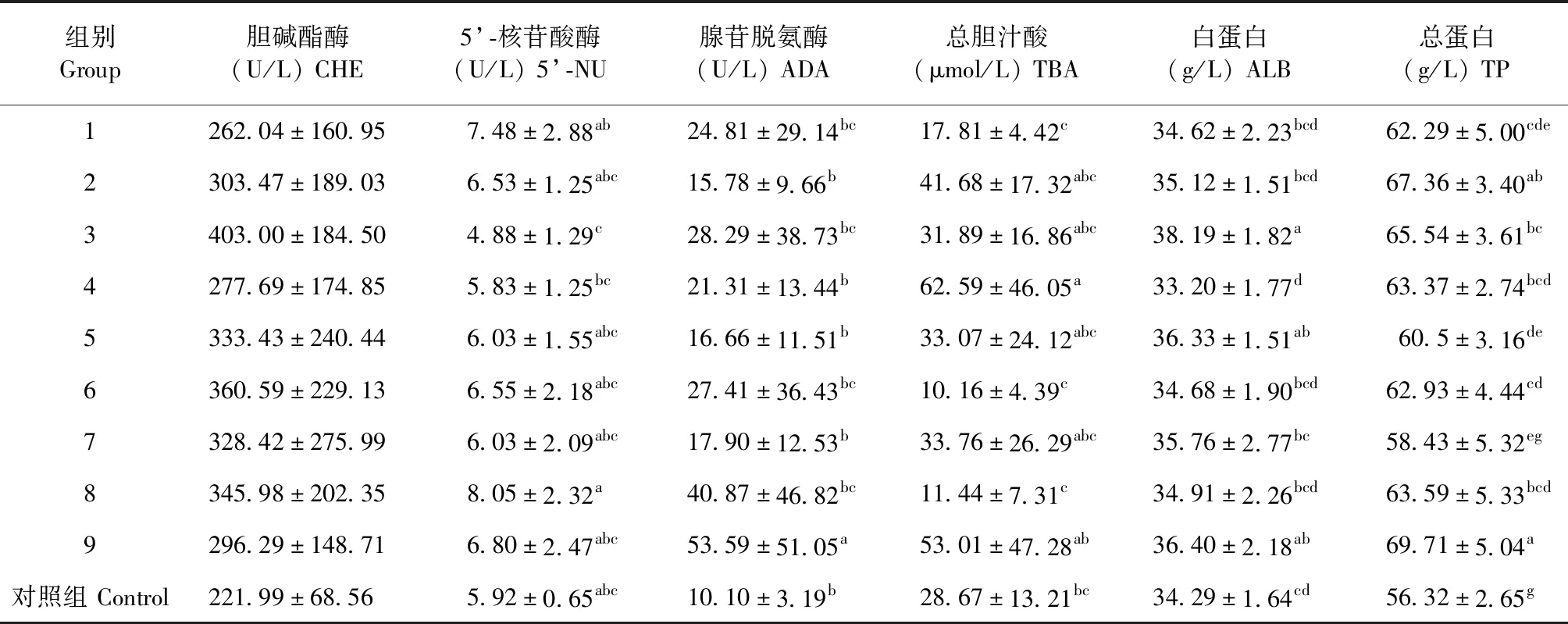
表2 APAP致大鼠肝损伤L9(34)正交试验优化结果 (续表)Table 2 L9 (34) orthogonal test results of liver injury induced by APAP in rats(continued)
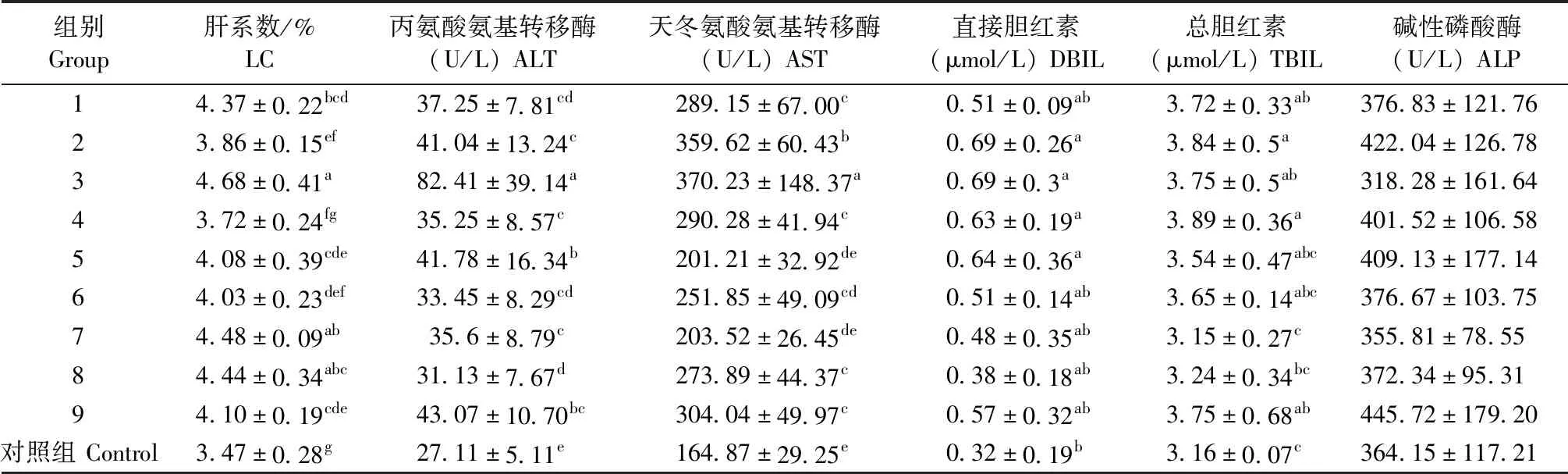
表2 APAP致大鼠肝损伤L9(34)正交试验优化结果Table 2 L9 (34) orthogonal test results of liver injury induced by APAP in rats
2.2 大鼠APAP致肝损伤综合评价 结果见表3。第3号结果最好,正交试验优选出的造模条件为A1B3C3。
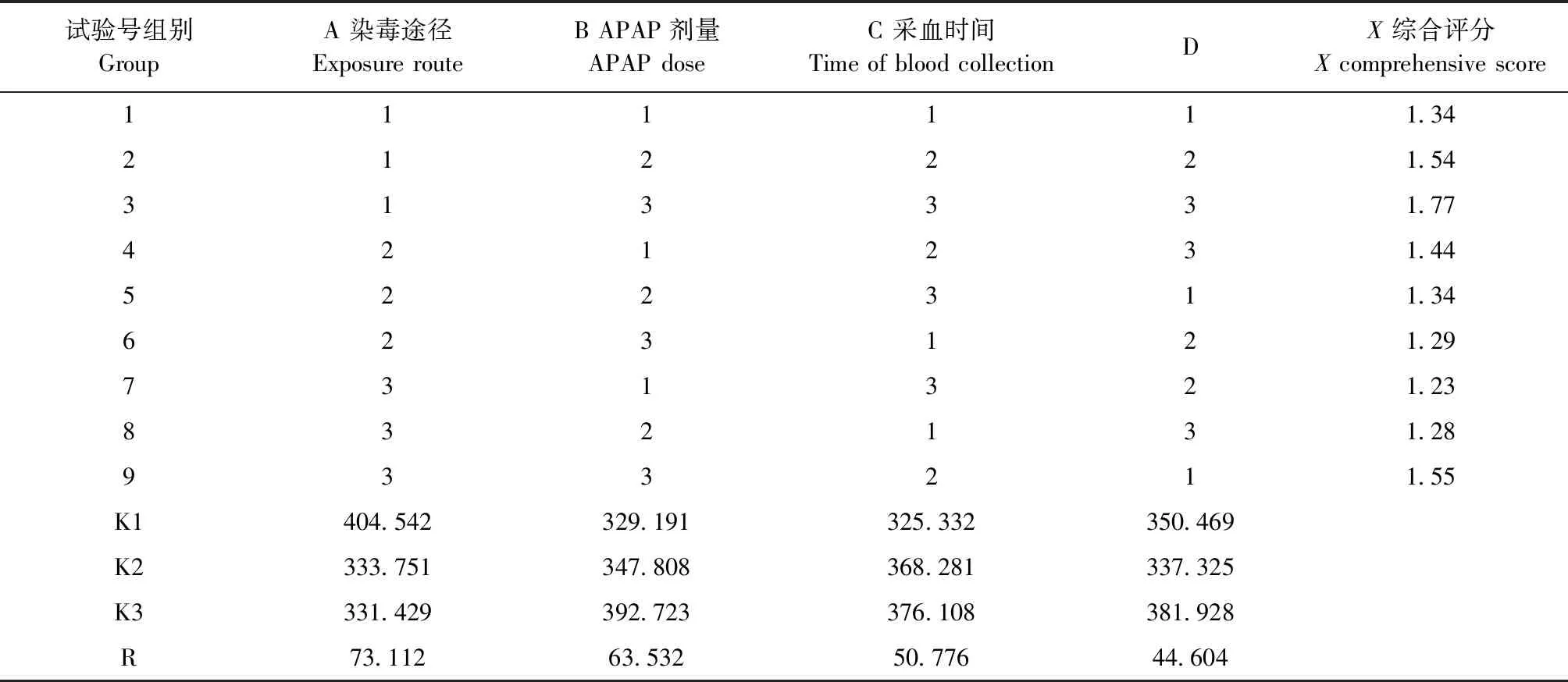
表3 正交试验安排与优化结果Table 3 Orthogonal test arrangement optimization results
2.3 大鼠APAP致肝损伤生化项目不同性别比较 结果见表4。ALT、DBIL、TBIL和ALP这4个肝损伤主要的生化指标,公鼠均大于母鼠且差异显著(P<0.05)。5′-核苷酸酶(5′-NU)、白蛋白(ALB)、胆碱酯酶(CHE)和总蛋白(TP)这4项指标,母鼠大于公鼠且差异显著(P<0.05)。肝系数(LC)和天冬氨酸氨基转移酶(AST)和腺苷脱氨酶(ADA)3个指标,公、母大鼠差异不显著(P>0.05)。
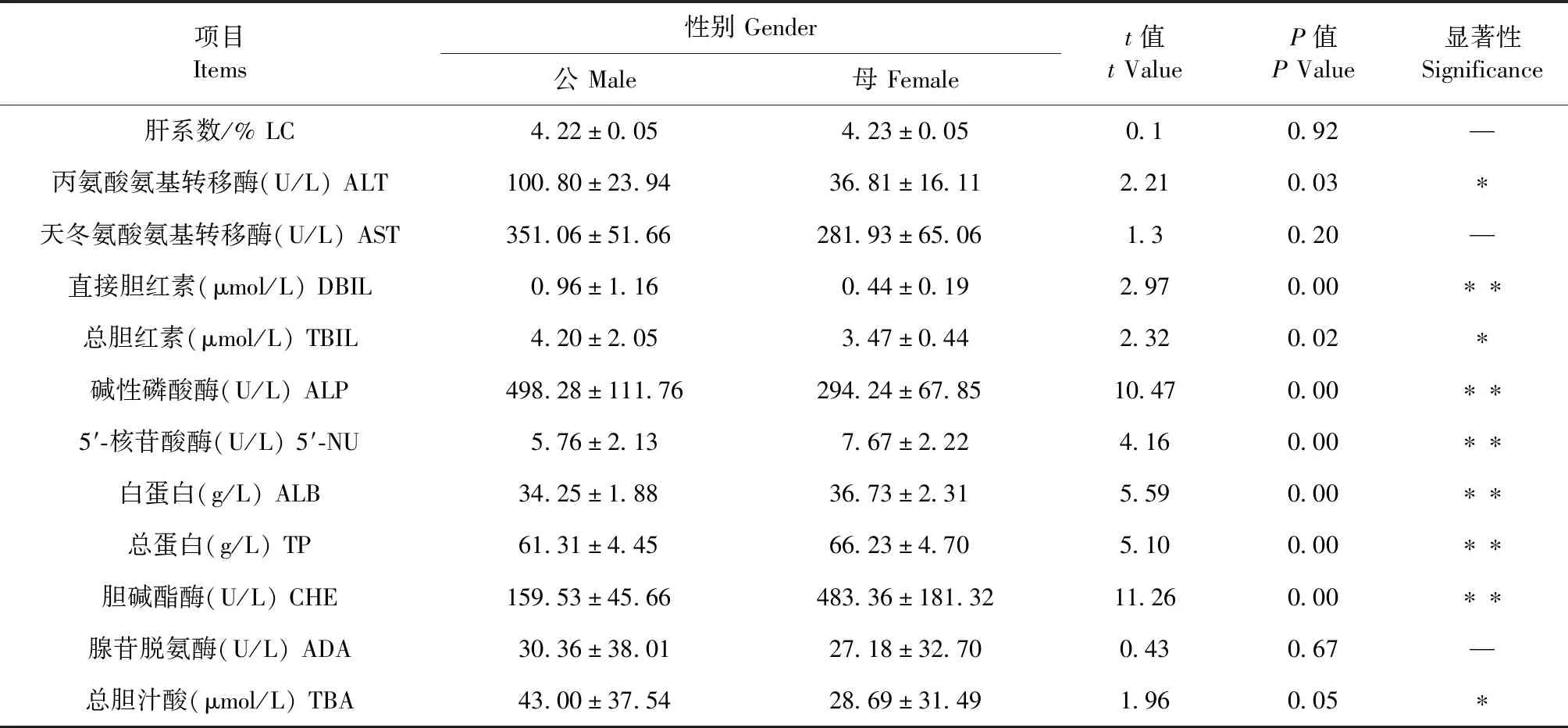
表4 APAP致大鼠肝损伤性别比较Table 4 Gender comparison of APAP induced liver injury in rats
2.4 肝脏组织病理学观察 结果见中插彩版图1。不同剂量、不同时间和不同的中毒途径均出现了明显的肝细胞空泡变性和肝细胞坏死等病变。
综合以上结果, 800 mg/(kg·bw) APAP经腹腔注射雄鼠,28 h后可得大鼠肝损伤最佳模型。
3 讨论
对乙酰氨基酚(APAP)是肝损伤的常用造模药物。其造成肝损伤的机制是APAP通过细胞色素P450代谢成为N-乙酰基-对-苯醌亚胺(N-acetyl-para-benzoquinone imine,NAPQI),其会导致急性肝小叶中央型坏死,谷胱甘肽(Glutathione,GSH)会与其结合消除毒性。当GSH耗尽时,NAPQI会发挥其肝毒性作用并与蛋白质巯基相结合为APAP蛋白质加合物,此加合物会传播和放大肝毒性[7-8]。文献报道,大鼠APAP染毒致肝损伤造模剂量在200~1 000 mg/(kg·bw) 不等[9]。在大鼠体内药动学研究表明,口服给药后在1~2 h内会到达血药浓度最高峰,T1/2 ka和T1/2 kb分别在0.2~0.5 h和3.5~4.5 h[10]。肝损伤模型的主要染毒方式为灌胃(ig)、腹腔注射(ip)和皮下注射(sc)[11],皮下注射时药物主要是通过局部的毛细血管和淋巴管吸收而进入体内造成肝损伤,腹腔注射则是药物可以通过大量的毛细血管和淋巴管吸收进入体内,而灌胃主要通过胃肠吸收到达体内,而小肠黏膜具有丰富的绒毛并且血流量较大,故急性肝损伤造模效果优于皮下给药[12]。
依据以上的3个条件选出染毒剂量、染毒方式和采血时间进行正交试验。结果显示,9组试验均对大鼠造成不同程度的肝损伤,但以上3个条件对肝损伤的影响均不显著。从数据筛选可以得出以800 mg/(kg·bw)腹腔注射APAP、28 h后能得到最佳的肝损伤模型。在造模剂量上与前人研究较为符合,随着给药剂量的增大,造模效果越好;腹腔给药造模效果优于口腔灌胃,而且操作便捷,故选择腹腔注射;在模型形成的时间上,可知APAP并未随着其血药浓度而损伤肝脏,推测由于APAP并不直接损伤肝脏,而是调控细胞色素P450代谢而损伤肝脏,故存在一定的延时性。
性别对肝损伤模型也有较大影响。已有研究表明,APAP急性肝损伤的性别差异存在于成年小鼠,具体表现为成年雄性小鼠比成年雌性小鼠肝脏损伤更明显。本试验发现,大鼠公鼠在肝损伤主要指标上高于母鼠且差异显著,对APAP的敏感性高,造模效果优于母鼠。其机制可能与成年雄性鼠肝脏抗氧化代谢酶活性比成年雌鼠低,继而导致肝损伤加重。母鼠在5′-核苷酸酶、白蛋白、胆碱酯酶、总蛋白这4个指标中高于公鼠,虽然对肝损伤判定有一定指导意义,但不是肝损伤的主要生化指标。所以在APAP肝损伤模型性别选择上尽量用公鼠,也可以因试验目的选择合适的性别。
意外的是,试验组中白蛋白和总蛋白较对照组有显著的增高,与肝损伤的表现不同[13],怀疑与血浆浓缩或肾功能损害有关,需要继续研究。
此试验为药物性肝损伤优选出了最佳的造模条件,并为药物性肝损伤的药理药效学研究提供了基础数据。

