湖南怀化地区猪源大肠埃希菌耐药性及耐药基因检测
陈 良 , 邓 炜 , 陈 告 , 王水莲 , 朱国华 , 邱小燕
(1.怀化市农业科学研究所 , 湖南 怀化 418000 ; 2.湖南农业大学动物医学院 , 湖南 长沙 410000 ; 3.怀化学院生物与食品工程学院 , 湖南 怀化 418000)
猪大肠埃希菌病是由致病性大肠埃希菌(Escherichiacoli)引起的猪的一种细菌性传染病,广泛存在于世界各地,给养猪业带来严重损失[1],常引起仔猪白痢、仔猪黄痢和仔猪水肿等疾病。治疗该病的药物主要为抗菌类药物,但是药物长期不合理的使用,使得大肠埃希菌耐药程度和多重耐药性问题愈发突出[2-6],并且大肠埃希菌血清型复杂,交叉免疫保护力不高,免疫效果不理想,导致其防治日益严峻,形势不容乐观[7-8]。
为了掌握湖南省怀化地区中小规模养猪场的大肠埃希菌耐药现状,建立该区域针对性的防治措施,本试验在辖区20个中小规模养殖户采集120份样品,依托本单位畜牧实验室进行药敏试验和耐药基因检测。为指导该地区养殖户针对该病正确防治和相关兽药监管提供参考。
1 材料与方法
1.1 试验材料
1.1.1 试验菌株 试验用大肠埃希菌分离自2019年3—7月从怀化地区的溆浦县、中方县、洪江区、鹤城区、洪江地区、芷江县、新晃县、辰溪县、麻阳县和会同县10个县(地区、区)内的20个中小规模养猪场采集的120份粪便拭子。
1.1.2 主要试剂及药敏纸片 麦康凯琼脂、伊红美蓝培养基、TSA营养琼脂粉、MH琼脂培养基,均购自青岛海博生物有限公司;2×TaqMaster Mix、DL2 000 DNA marker,均购自天根生化科技(北京)有限公司;引物由北京擎科新业生物技术有限公司合成;10种药敏纸片购自杭州微生物试剂有限公司,药敏纸片及浓度分别为:红霉素(15 μg/片)、诺氟沙星(10 μg/片)、环丙沙星(5 μg/片)、复方新诺明(25 μg/片)、氯霉素(30 μg/片)、青霉素(10 U/片)、氨苄西林(10 μg/片)、头孢唑啉(30 μg/片)、丁胺卡那霉素(30 μg/片)、庆大霉素(10 μg/片)。
1.2 大肠埃希菌的分离鉴定
1.2.1 样品采集与初步分离鉴定 采用直肠拭子法采集样品,放入盛有0.9%生理盐水的EP管中,冷藏运输。将采集的样品无菌操作划线于麦康凯培养基上,37 ℃ 培养18~24 h后,将圆形、光滑、隆起、湿润、红色疑似菌落在伊红美兰培养基上37 ℃再培养18~24 h,然后选取紫黑色带有金属光泽疑似大肠埃希菌,用革兰染色法进行染色和镜检。根据观察结果,将其纯化培养,4 ℃冷藏备用。
1.2.2 PCR扩增检测 参照文献[9-11]提取大肠埃希菌DNA。16S rRNA通用引物序列为F:5′-AGAGTTTGATCCTGGCTCAG-3′;R:5′-GGTTACCTTGTTACGACTT-3′,以提取的细菌DNA为模版,反应体系为25 μL:DNA模版1 μL、上下游引物各1 μL、2×TaqMaster Mix 12.5 μL,加ddH2O补足至25 μL。 PCR反应条件为35个循环,预变性94 ℃ 5 min, 进入循环94 ℃ 50 s,58 ℃ 50 s,72 ℃ 50 s,72 ℃延伸10 min,4 ℃保存或将PCR产物在1%琼脂糖凝胶电泳检测。将含有目的片段的凝胶回收送北京擎科新业生物技术有限公司进行测序,将测序结果与GenBank中大肠埃希菌参考基因进行比对。
1.3 药敏试验 采用K-B纸片琼脂扩散法对分离菌株进行10种常用抗菌药物的敏感性试验[12]。将分离菌株分别接种于营养肉汤,37 ℃ 培养18 h,用生理盐水调节菌液至0.5麦氏浊度(含菌量1×108CFU/mL),然后量取100 μL菌液,用涂布棒在MH琼脂培养基均匀涂布,待干后,在培养基上分别将药敏纸片均匀粘贴,37 ℃ 培养16~18 h。结果参照《抗菌药物敏感性试验执行标准》2012版[13-14]进行判定。
1.4 耐药基因扩增 参考相关文献[15-16]扩增大坏内酯类(emB、emC、emF)、磺胺类(Sul1、Sul2)、氨基糖苷类[aadA1、aac(3′)-Ⅱa]和酰胺醇类floR共4类8种耐药基因,引物信息见表1,引物由北京擎科新业生物技术有限公司合成。以提取的细菌DNA为模版进行PCR扩增。反应体系为25 μL:模版1 μL、上下游引物各1 μL、2×TaqMaster Mix 12.5 μL,加ddH2O 补足至25 μL。PCR反应条件为35个循环,预变性95 ℃ 5 min,进入循环94 ℃ 50 s,按各引物Tm值退火50 s,72 ℃ 50 s,72 ℃ 延伸10 min,结束后用1%琼脂糖凝胶电泳鉴定。

表1 耐药基因引物信息Table 1 The primers of PCR for antibiotic genes
2 结果
2.1 菌株初步鉴定 从120个粪便拭子中分离86株疑似大肠埃希菌,其在麦康凯培养基中表现为边缘光滑整齐、分布均匀的粉红色、扁圆形的菌落;伊红美蓝培养基表现为大小一致、具有金属光泽的黑色菌落。经革兰染色后在显微镜下观察为革兰阴性菌,单个或成对存在,有菌毛、无芽胞,两端钝圆的粗短杆菌。
2.2 PCR鉴定 用16S rRNA的通用引物对86株分离菌株进行PCR检测,其片段大小为1 474 bp目的条带,产物的测序结果与GenBank中大肠埃希菌参考基因序列同源性为99%,进一步验证本试验分离菌株为大肠埃希菌,部分菌株PCR结果见图1。
图1 大肠埃希菌16S rRNA PCR鉴定Fig.1 16S rRNA PCR identification of Escherichia coliM:DL2 000 DNA marker; N:阴性对照; 1~10:分离菌株M:DL2 000 DNA marker; N:Negative control; 1-10:Isolated strains
2.3 药敏试验 将分离鉴定出的86株猪源大肠埃希菌进行7类10种抗菌药物的敏感试验,试验结果表明,该批次分离的大肠埃希菌对参试的部分抗生素药物耐药率高,如红霉素、复方新诺明分别为93.02%、86.05%,但丁胺卡那霉素敏感率最高,为86.05%,中敏率介于4.65%~32.56%,见表2。
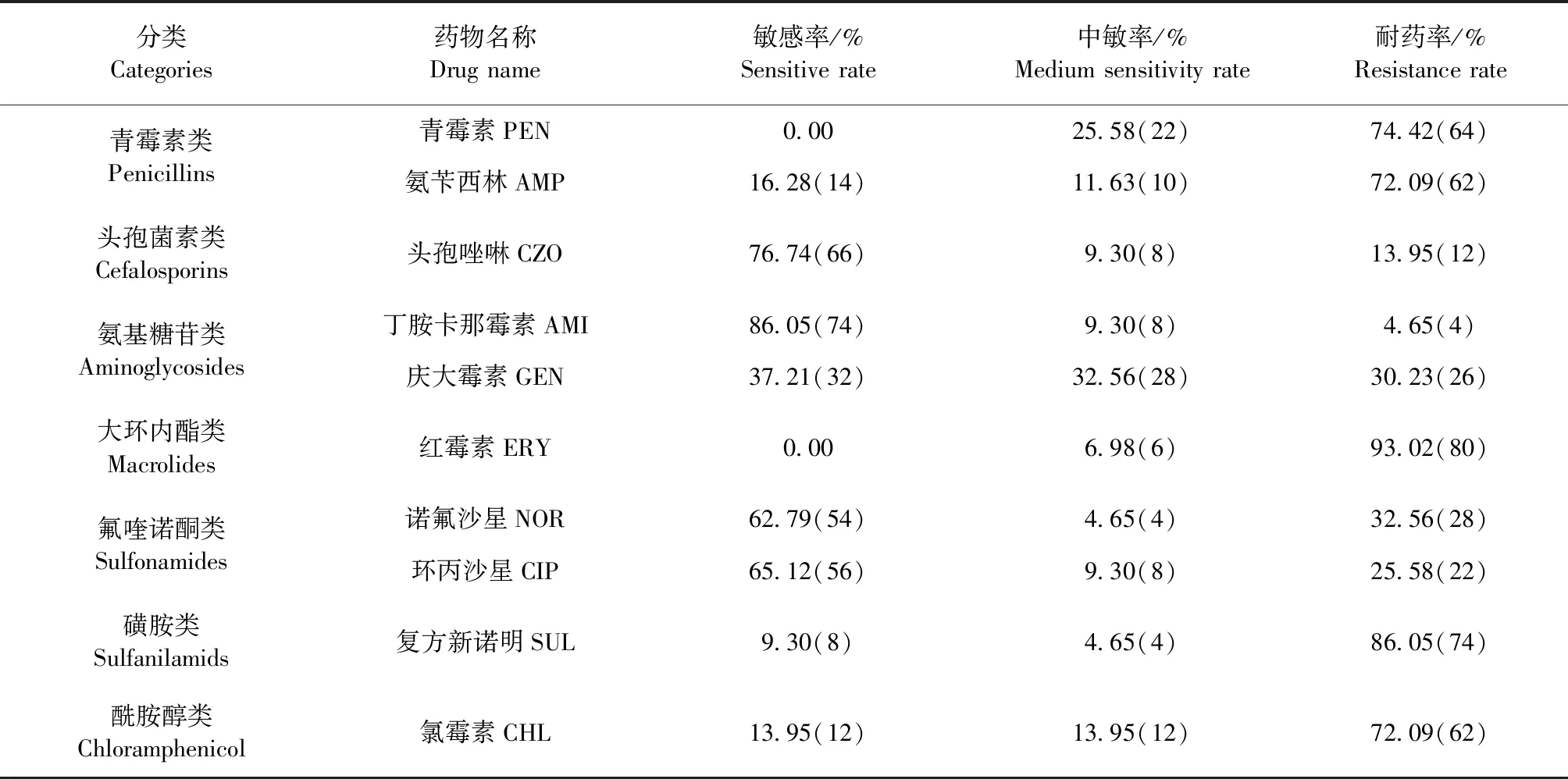
表2 药物敏感性试验Table 2 Drugs sensitivity test
2.4 耐药基因检测 对86株分离菌株进行了4类8种耐药基因检测,8种耐药基因[aadA1、aac(3′)-Ⅱa、floR、Sul1、Sul2、emB、emC、emF]电泳检测和抽样测序结果显示,扩增的片段大小与预期基本一致,且电泳检测结果显示,各基因阴性对照成立。耐药基因检出率显示,Sul2的检出率最高,为86.05%,其他依次为emF、floR、emB、aac(3′)-Ⅱa、aadA1、Sul1和emC,见表3。
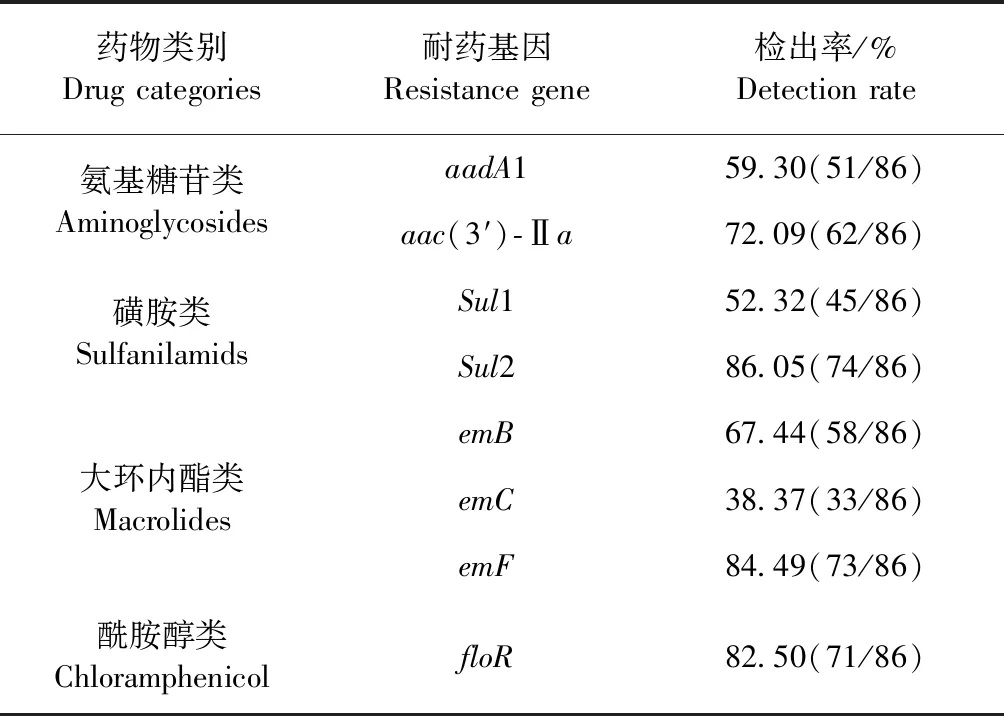
表3 86株猪源大肠埃希菌耐药基因检出率Table 3 The drug resistance genes detection rate of 86 Escherichia coli strains isolated from swine
3 讨论
本试验对成功分离和鉴定出的86株Escherichiacoli开展的7类10种抗菌药物的药敏试验,结果显示,分离菌株对部分抗菌药物的耐药性严重,其中红霉素耐药率最高,为93.02%;复方新诺明、青霉素、氨苄西林和氯霉素耐药率也比较严重,介于72.09%~86.05%;诺氟沙星、环丙沙星、头孢唑啉的耐药率在13.95%~32.56%;但对丁胺卡那霉素耐药率最低,为4.65%,该结果与其他动物源Esche-richiacoli的部分耐药率有所差异,这可能与地域、菌株来源、动物种类、药物使用习惯等药物使用背景等因素有关。战晓微[17]开展了47株大肠埃希菌中检出产超广谱β-内酰胺酶29株对四环素、环丙沙星、庆大霉素耐药性试验,其耐药菌株检出率分别70.21%、20.27%、14.89%;吴立婷[18]对扬州地区临床分离获得的226株宠物源大肠埃希菌菌株进行体外抑菌试验,其耐药检出率分别为庆大霉素28.32%、氨苄西林72.12%、氯霉素为32.30%;葛晨玲等[15]对广西猪源大肠埃希菌进行31种抗菌药物的药敏试验,结果显示,对青霉素、磺胺甲恶唑、庆大霉素等耐药性均高达87.10%;张莉莉等[19]对122株奶牛乳房炎大肠埃希菌的分离菌株进行青霉素药敏试验,其耐药率高达99.19%。值得注意的是,氯霉素在本试验中的耐药率是吴立婷[18]试验结果的2.2倍,提示在日常的用药过程中尽量避免使用酰胺醇类药物。同时,所有参试的药物中敏率居于4.65%~32.56%,可能长期使用同类药物或短时期内高频率的使用同类药物。为此,在本地区的畜牧生产应避免使用红霉素和青霉素,并尽量少使用复方新诺明、氨苄西林和氯霉素等耐药性较强或敏感性低的药物,应合理用药、轮换用药。
耐药基因检测结果表明,怀化地区中小型养猪场耐药基因检出率整体水平较高,其中Sul2、emF、floR相对较高,其检出率分别为86.05%、84.49%、82.50%;其次为耐药基因aac(3′)-Ⅱa、emB、aadA1、Sul1和emC,依次为72.09%、67.44%、59.30%和52.32%;而emC的检出率最低,为38.37%。这与在对本地区养殖户实地走访中了解到的情况基本相符,当地养殖户常使用磺胺类、酰胺醇类和大环内酯类药物,可能的原因是此类药物价格便宜、疗效较好、抗菌谱广,作为药物或饲料添加剂深受养殖户青睐。该试验结果与其他动物源Escherichiacoli部分结果存在差异,特别是耐药基因floR、sul2远远高于其他研究结果。汤景元等[20]开展氨基糖苷类的耐药基因aadA1的检测,检出率为65.89%;张炳亮等[21]对洛阳地区氨基糖苷类的耐药基因aac(3′)-Ⅱa进行检测,检出率为88.20%;马超[11]对宁夏地区抗生素类药物的耐药基因Sul1、Sul2、aac(3′)-Ⅱa、aadA1进行检测,检出率分别为31.8%、37.4%、27.1%、19.3%;索朗斯珠等[22]对西藏6个不同地区的200株牦牛源大肠埃希菌耐药基因检测,其中floR、Sul1、Sul2检出率分别为25%、7%、7%。本试验中,多数病原菌株的耐药率与基因检出率情况大致相同,但是氨基糖苷类结果差距较大,可能存在下面几点原因:(1)本试验所检测的氨基糖苷类的耐药基因偏少,没有对其他可能的耐药基因进行检测;(2)目前已知氨基糖苷类耐药机制有3种,可能是由于其他或新的非耐药基因介导机制造成耐药表型与耐药基因的符合率存在较大差异;(3)样品采集的局限性,如样品量、动物的年龄、用药习惯、样品保存条件等,导致大肠埃希菌遗传背景多样化,导致的耐药基因检出率与耐药率不符。
怀化地区中小型规模养猪场的大肠埃希菌对红霉素、复方新诺明和青霉素耐药严重,磺胺类药物的耐药基因Sul2检出率为86.05%。建议本地区养殖户对致病性大肠埃希菌所引发的疾病进行防治时应首选氟喹诺酮类、氨基糖苷类药物。

