洱海四种沉水植物对弱光环境的适应性比较*
张忠海,杨 桐,王 昊,张霄林,曹 特,倪乐意,袁昌波
(1:大连海洋大学,大连 116023)(2:大理市洱海管理局,大理 671000)(3:中国科学院水生生物研究所,武汉 430072)
近年来,随着经济加速发展和资源利用剧增,人类对湖泊开发过度,湖泊内营养源富集,导致湖泊生态系统退化,蓝藻水华大量暴发,水体透明度不断下降,沉水植被退化[1].沉水植物是水生生态系统的生产者,其兴衰对湖泊生态系统的结构和功能有重要影响[2].沉水植物通过提高湖泊的空间异质性,抑制生物性和非生物性悬浮物的生成;提高水体溶解氧浓度;降低水体氮磷营养盐浓度,抑制藻类生长,改善水下光照条件;为上游食物链中的各类生物类群提供了食物来源、栖息地和其他必需条件[3-5];沉水植被的各项直接和间接的生态作用促进了湖泊维持清水稳态[6].因此,在湖泊修复过程中水生植被恢复具有重要意义.
在污染严重的水体中,沉水植物难以自然恢复,湖泊水柱中极低的透明度及植物繁殖体的缺乏是限制水生植被恢复的主要因素[7-8].在这种情况下,对于植被严重退化的湖泊应尽快采用有效的生态措施,积极开展水生植被恢复与重建工作[9].世界各地对于湖泊沉水植被恢复做了许多尝试,但少有大空间尺度上沉水植被恢复成功的先例,其中一个重要的原因就是过于注重植物本身而忽视了其生长所需的环境条件[10].水生植物生长受到多种因素的影响,如光照、温度、水质、底质和生物因素等.一般认为光照强度是影响沉水植物生长的主要限制因子[11],王韶华等研究后海沉水植物发现:透明度过低引起的光照不足是后海沉水植物死亡的主要原因[12];符辉的研究发现:近30年来,洱海水质(透明度)下降对沉水植物造成严重的弱光胁迫,导致沉水植被退化[13].因此,研究沉水植物对弱光胁迫的适应能力对于沉水植被恢复十分必要.一般认为环境光强持久或短时间显著低于植物光饱和点的光环境,可以称为弱光逆境[14].此条件下,沉水植物的光合作用受到强烈影响,生长严重受抑[15],生理上也会受到损伤[16].当前,对于弱光胁迫下沉水植物的响应多采用室内控制实验进行研究,这导致实践时往往难以起到很好的效果,本研究选择洱海水生植被重度退化区域进行原位实验,对水生植被的恢复可以起到良好的指导作用.
洱海位于云南大理州境内,属于高原淡水湖泊.洱海南部有一部分湖区(25.64375°~25.71297°N,100.21799°~100.24011°E)湖底高程较高,形成一处高于四周区域的“平台”(以下称“湖心平台”).1998年之前,湖心平台尚有大片沉水植被分布,是洱海沉水植物成片连续分布的最大区域.1981-1983年,湖心平台水域水生植被分布面积达到23 km2,占全湖水生植被面积的29.76%[17];1984-1994年,洱海受富营养化影响而水质变差,并在1996年发生第一次水华,对沉水植被造成了极大的破坏,1997年实施了“双取消”工程(取消网箱养鱼和机动船只)后,沉水植被大量恢复, 其分布面积和生物量显著增加[18-19];至1998年湖心平台区域水生植被分布面积达到33.41 km2,占全湖水生植被面积的34.80%,而后2003年洱海再次暴发水华,此后2年多的时间里湖心平台植被逐渐消失殆尽[13](表1).因此,若能在此大面积退化区域恢复水生植被,将显著增加洱海水生植被面积,对洱海生态功能的修复具有重要意义.
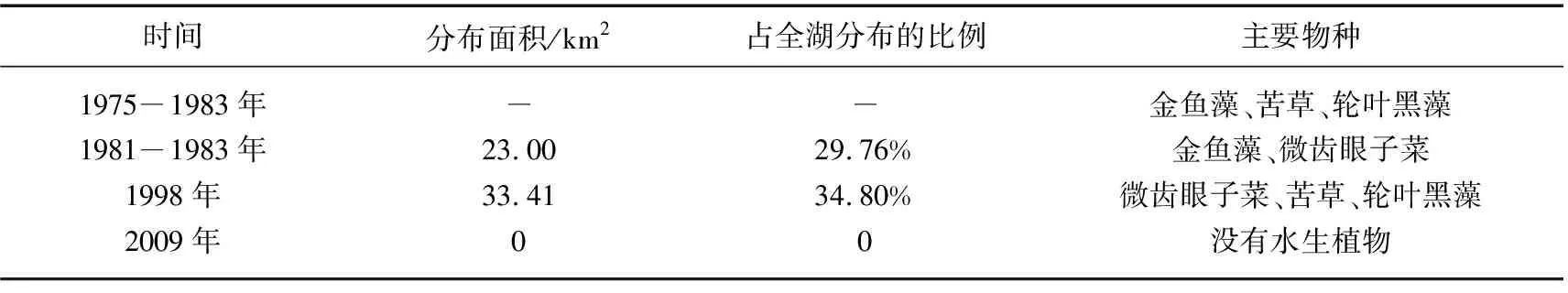
表1 洱海南部湖心平台水域水生植被变化[17-18,20-21]
2015年以来,随着洱海环保力度加大,洱海水质逐年变好,透明度逐年提高,水质得到改善,理论上湖心平台有沉水植物恢复的可能性,但是一直没有出现沉水植被的自然恢复,因此我们希望通过人工强化的修复措施实现该区域的沉水植被重建.本研究的核心问题是,洱海哪种常见本土沉水植物可以在湖心平台存活并形成稳定群落?根据湖心平台区域水生植被消失之前的优势物种和湖心平台的环境特征,选择4种可能适应该区域的沉水植物:苦草(Vallisnerianatans)、轮叶黑藻(Hydrillaverticillata)、穗花狐尾藻(Myriophyllumspicatum)、竹叶眼子菜(Potamogetonwrightii),其中苦草和轮叶黑藻是湖心平台的历史优势种,两者耐污能力强,有较强的净化能力;穗花狐尾藻耐污能力强,净化效果好,繁殖快,再生能力强,竹叶眼子菜地下茎发达,对水质具有较强的适应能力,4种植物是沉水植被恢复中经常被选择的物种[22],具有在湖心平台恢复的可能性,并且在洱海容易获取.根据这4种沉水植物的原位生长状况,比较四者的适应能力,来筛选哪些植物最适合作为退化区植被恢复的物种.
1 材料与方法
1.1 实验材料
实验用的4种沉水植物均来自洱海水生植物种苗繁育基地,基地培养的沉水植物种源均源于洱海湖区.同一种植物选用的是生长茂盛、健康和生长指标大体一致的植株,4种植物株高保持大体一致(70~90 cm).
1.2 实验时间
实验时间选择沉水植物在洱海的生长旺盛的时期,从2018年6月7日-8月7日,共9周(63 d).
1.3 实验地点
实验地点选择在湖心平台中心区域(25.684234°N,100.226728°E)(图1).
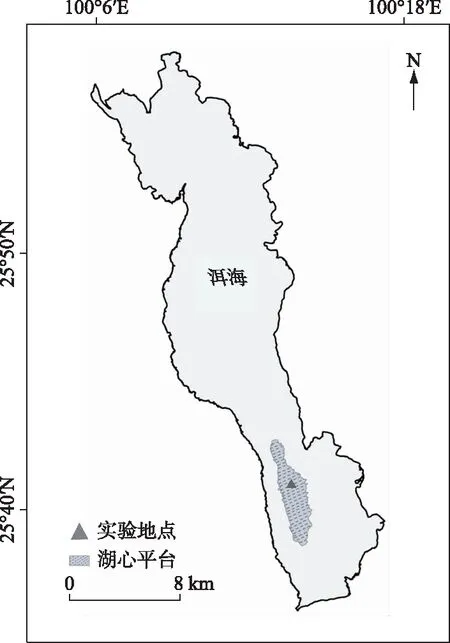
图1 实验区域示意图
1.4 实验设计
将4种沉水植物作为4个实验组,通过测定生物量、株高以及叶绿素、C、N、游离氨基酸、可溶性糖、淀粉含量,比较其在原位生长的适应性.
本研究采用沉桶盆栽的方式开展.种植桶是白色塑料桶(上直径35 cm,高33 cm,底直径27 cm),在桶内填充底质(湖心平台底部淤泥)15 cm,按照每桶30株的密度将相应植株均匀植于桶内,每个实验组设置20个平行(桶).种植桶沉入水底前,用另一端绑着浮标(直径10 cm的白色泡沫球)的绳子系在桶上,绳长度7.5 m,略大于实验地点的水深,保证种植桶不受浮标飘动影响,然后缓慢沉入实验区域.
1.5 测量指标
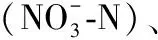
1.5.2 沉水植物生长和生理指标 在实验前每种植物取5株样本,测量株高和生物量,以其平均值作为初始株高和初始生物量.实验周期内,各物种按照5桶为单位进行循环监测,每周统计5桶中数植株数量作为存活量,并分别从每桶随机取1株植株带回实验室,测量植株株高(相对株高=测量株高/初始株高),取植株从上到下第3片叶片来测量叶绿素含量,叶绿素含量通过丙酮-乙醇提取法测定[24],之后经80℃烘干至恒重后以测量生物量(相对生物量=测量生物量/初始生物量),将5株植物干样合并进行研磨成粉末并经200目筛过滤后,测定游离氨基酸、可溶性糖、淀粉、碳、氮含量.植物组织碳、氮含量通过元素分析仪(Flash EA 1112,CE Instruments,Italy)测定;将50 mg烘干的植物组织用80%乙醇在80℃的水浴萃取20 min,重复2次,离心后合并上清液,并定溶到5 mL用于测定可溶性糖和游离氨基酸的含量,萃取后的残渣中加入2 mL 30%的高氯酸继续萃取120 min,离心10 min后收集上清液用于测定淀粉含量.可溶性糖的测定使用1 g/L的葡萄糖溶液做标准曲线,用蒽酮试剂法测定[25],游离氨基酸的测定用3 mg/L的丙氨酸做标准曲线,用茚满三酮-抗坏血酸法测定[26].淀粉含量用5 g/L的淀粉溶液做标准曲线,用碘试剂法测定[27].
1.6 分析方法
使用SPSS 22软件进行统计分析,双因素方差分析时间和物种两因素对存活率、相对株高、相对生物量的效应,并使用LSD法对不同物种的组间差异进行事后多重比较,方差分析前所有数据进行正态分布和方差齐性检验,将存活率与时间进行非线性拟合分析,游离氨基酸、可溶性糖、淀粉、碳和氮含量与时间进行线性拟合分析,Pearson相关性分析相对株高、相对生物量、游离氨基酸、可溶性糖、淀粉、碳、氮含量彼此之间的相关性.使用Origin 2017软件绘图.
2 实验结果
2.1 水质
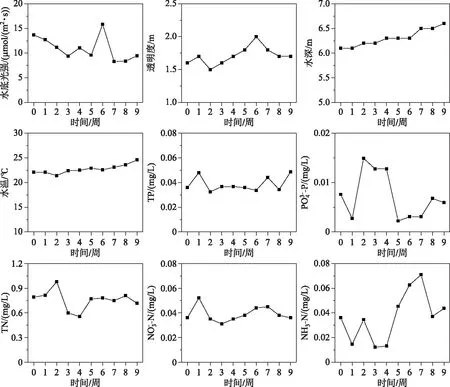
图2 实验区域的水环境特征
2.2 形态指标差异
实验开始后,4种沉水植物存活率显著下降,其中苦草的存活率在第6周后逐渐稳定,实验结束时存活率为35%;而轮叶黑藻、穗花狐尾藻和竹叶眼子菜的存活率在实验开始后持续下降,轮叶黑藻的存活率在第4周降到0;穗花狐尾藻的存活率在第6周降到0;竹叶眼子菜的存活率在实验结束时降到2%(图2).植物最终存活率在不同植物间存在显著差异,植物存活率随时间逐渐显著降低(P<0.05)(表2),将4种沉水植物的存活率进行多重比较(LSD),4种水生植物的存活率表现为:苦草 > 竹叶眼子菜 > 穗花狐尾藻 > 轮叶黑藻(P<0.05)(图3).
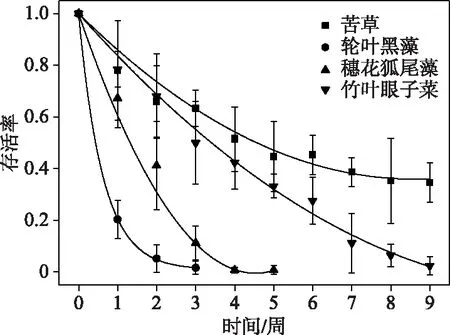
图3 4种沉水植物的存活率变化
弱光环境下,4种沉水植物生长受到抑制,单株生物量和株高都显著性下降.实验结束时,苦草生物量降低到初始值的12.2%;轮叶黑藻在第3周的相对生物量降至初始生物量的1.8%,随后轮叶黑藻全部死亡;穗花狐尾藻在第5周的相对生物量降至4.6%,随后穗花狐尾藻完全死亡;竹叶眼子菜的相对生物量在实验结束时降至4.3%(图4).双因素方差分析表明,时间和物种对相对生物量均有显著性影响(表2),4种沉水植物的相对生物量多重比较(LSD)表明,苦草和竹叶眼子菜 > 轮叶黑藻和穗花狐尾藻.实验期间,苦草相对株高降到64.2%;竹叶眼子菜相对株高从1降到10.9%;第3周,轮叶黑藻相对株高降至7.3%,随后轮叶黑藻全部死亡;第5周,穗花狐尾藻相对株高降至4.1%,随后完全死亡(图4).双因素方差分析表明,时间和物种对相对株高的影响都具有显著性,4种沉水植物的相对株高进行多重比较(LSD)表明,苦草 > 竹叶眼子菜 > 穗花狐尾藻 > 轮叶黑藻(表2).
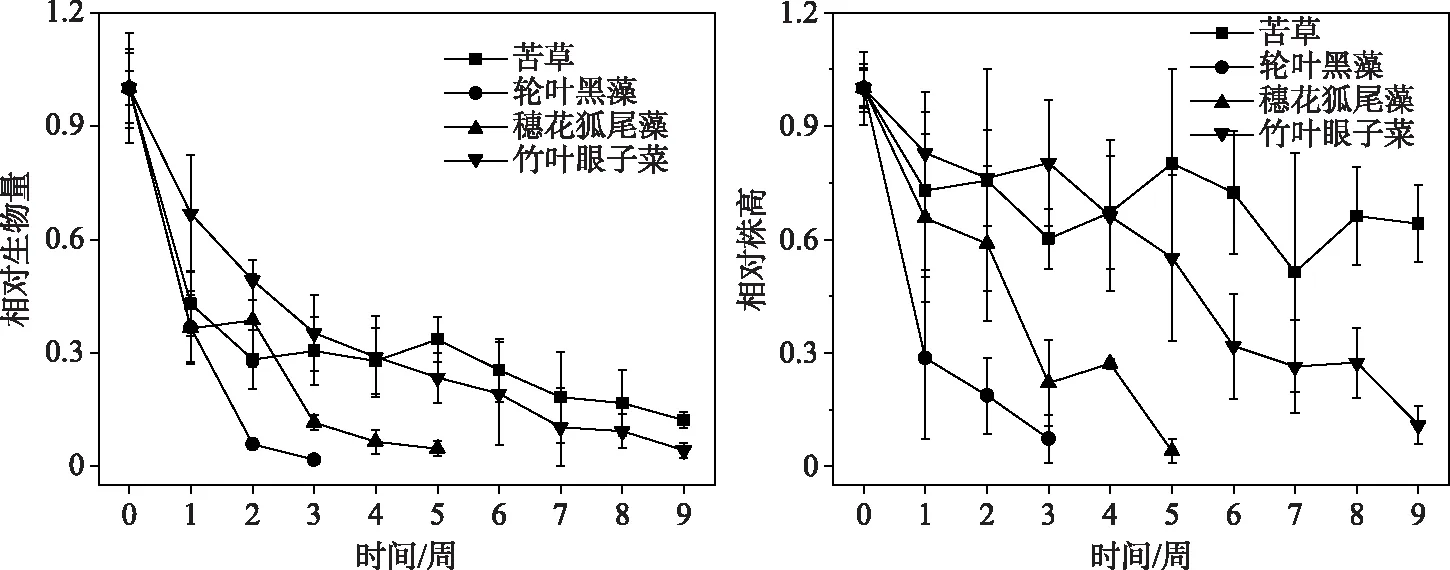
图4 4种沉水植物相对株高和单株生物量变化

表2 4种沉水植物存活率、相对生物量和相对株高双因素方差分析
2.3 生理指标差异
弱光环境下,4种沉水植物的叶绿素含量变化趋势不同,苦草叶绿素含量总体呈波动上升趋势,初始值和结束值分别为0.58和1.1 mg/g;轮叶黑藻叶绿素含量呈下降趋势,其初始值和结束值分别是1.14和0.30 mg/g;穗花狐尾藻和竹叶眼子菜叶绿素含量相对稳定(图5).
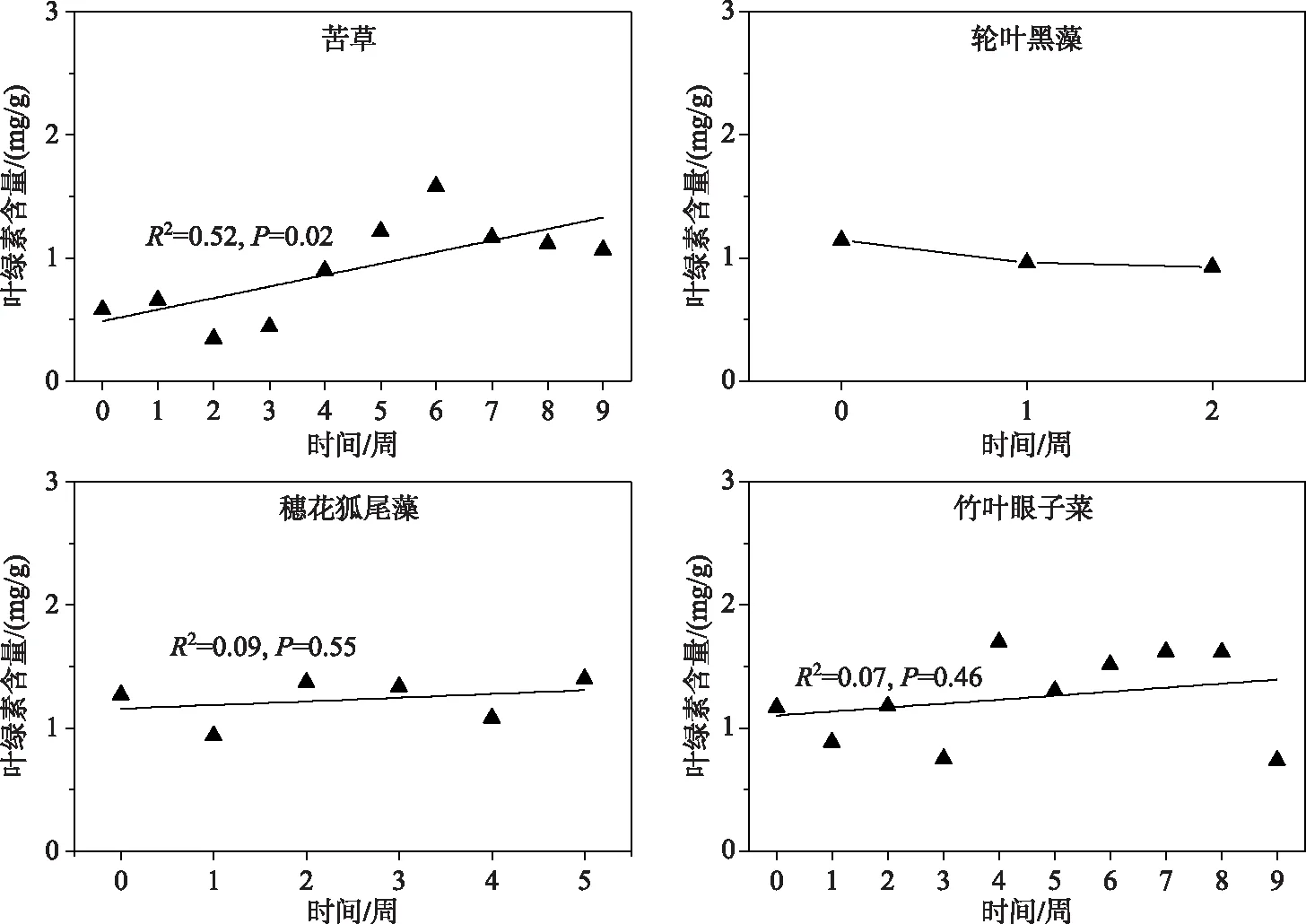
图5 4种沉水植物的叶绿素含量变化
实验开始后,苦草、穗花狐尾藻和竹叶眼子菜N含量升高,其中苦草、穗花狐尾藻和竹叶眼子菜N含量初始值是0.93%、1.39%和1.27%,实验结束时N含量分别上升到2.58%、4.01%和1.74%;而轮叶黑藻N含量初始值是3.47%,实验开始后,轮叶黑藻N含量变化不明显(图6).苦草C含量下降,由初始时的37%下降到实验结束时的31%;轮叶黑藻和穗花狐尾藻C含量升高,轮叶黑藻和穗花狐尾藻的C含量的初始值分别为32%和30%,实验结束时分别上升到36%和40%;实验前5周,竹叶眼子菜的C含量呈上升趋势,第5周到实验结束时呈下降趋势,实验开始时、第5周和实验结束时的C含量分别为38%、43%和36%(图6).苦草、穗花狐尾藻和竹叶眼子菜C∶N比降低,其初始值分别是39.6、21.9和30.3,结束时,C∶N比分别是12.2、9.9和20.7;轮叶黑藻C∶N比变化不大,其初始和结束值分别为9.3和10.7(图6).
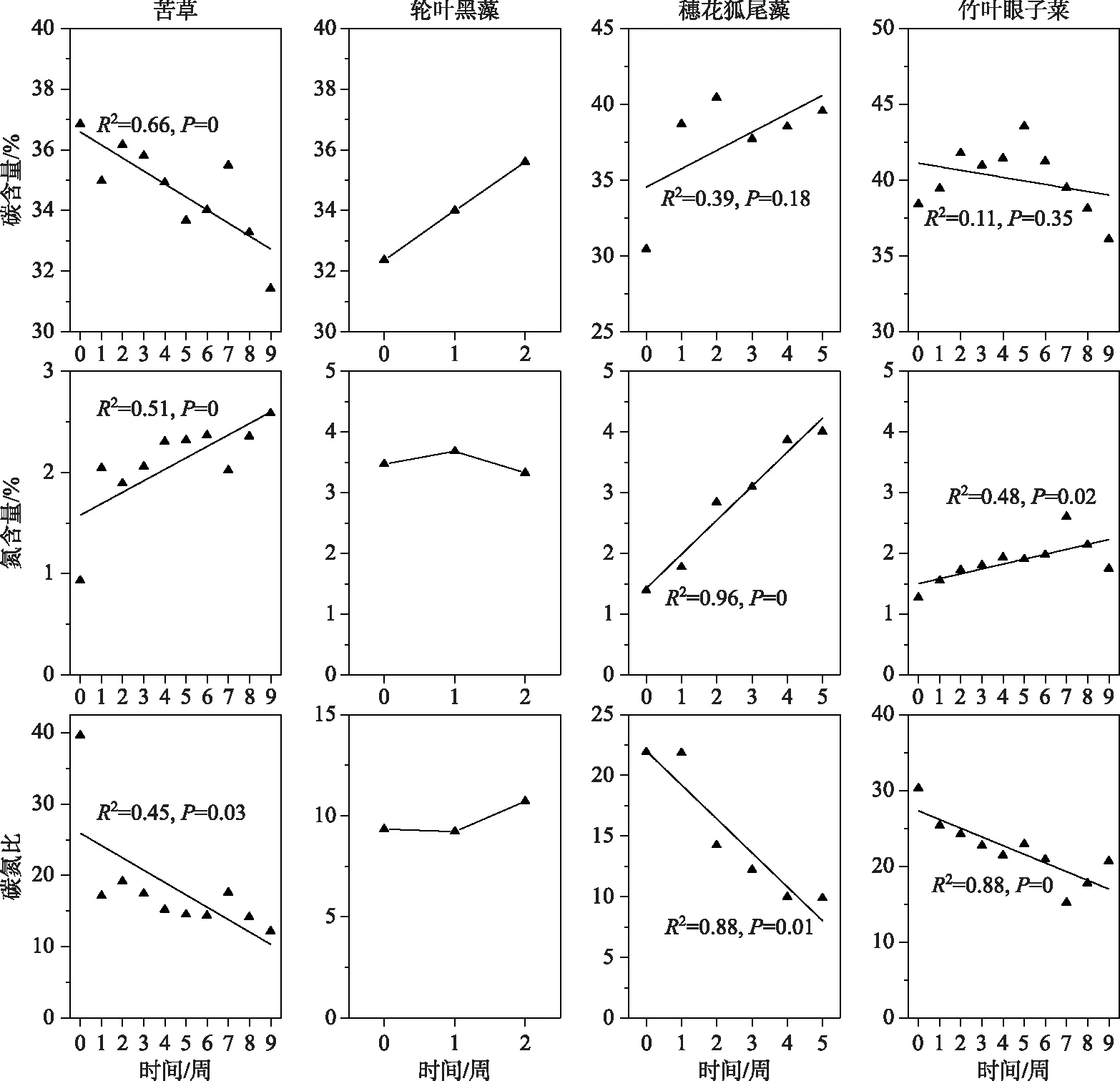
图6 4种沉水植物C、N含量以及C∶N比变化
实验期间,苦草、穗花狐尾藻和竹叶眼子菜的游离氨基酸含量随时间呈上升趋势,初始时,苦草、穗花狐尾藻和竹叶眼子菜游离氨基酸含量分别是0.25、0.84、0.49 mg/g,实验时的最大含量分别达到1.05、2.02、1.1 mg/g;而轮叶黑藻的游离氨基酸含量随时间呈下降趋势,其氨基酸含量由初始值的1.16 mg/g下降到0.61 mg/g,并且轮叶黑藻的氨基酸含量与时间呈显著负相关(图7).苦草、穗花狐尾藻和竹叶眼子菜的可溶性糖含量随时间呈下降趋势,其可溶性糖含量的初始值分别是15.37、26.67和32.97 mg/g,实验结束时可溶性糖含量分别下降到8.03、8.53和6.98 mg/g;而轮叶黑藻的可溶性糖含量随时间呈上升趋势,其可溶性糖含量由初始值的5.52 mg/g上升到16.35 mg/g(图7).苦草、穗花狐尾藻和竹叶眼子菜的淀粉含量随时间呈下降趋势,其淀粉含量的初始值分别是257、65和163 mg/g,实验结束时淀粉含量分别下降到55、11和12 mg/g;而轮叶黑藻的淀粉含量随时间变化呈上升趋势,其可溶性糖含量由初始值的2 mg/g上升到28 mg/g(图7).
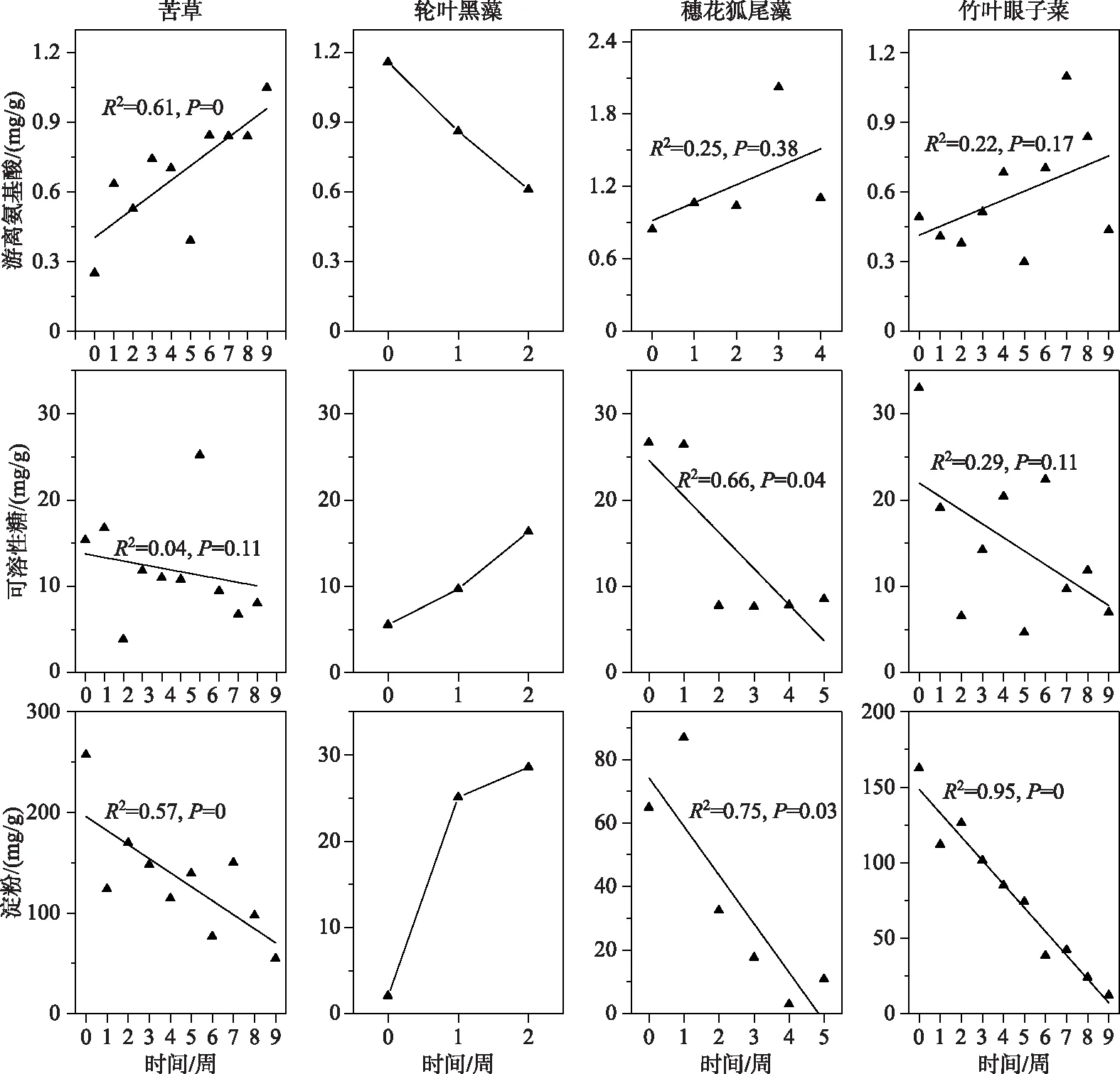
图7 4种沉水植物游离氨基酸、可溶性糖和淀粉含量变化
苦草株高、单株生物量与游离氨基酸含量均呈显著性负相关,并且株高、单株生物量与氮含量也都呈显著性负相关,而单株生物量与淀粉含量呈显著正相关.轮叶黑藻两个形态指标株高、单株生物量与5个生理指标都没有表现出显著性相关.穗花狐尾藻与可溶性糖、淀粉含量呈显著性正相关,而株高、单株生物量与氮含量都呈显著性负相关(表3).竹叶眼子菜株高、单株生物量与淀粉含量都呈显著性正相关,并且株高、单株生物量与碳含量也都呈显著性正相关,单株生物量与可溶性糖含量呈显著性正相关,而株高、单株生物量与氮含量都呈显著性负相关(表3).
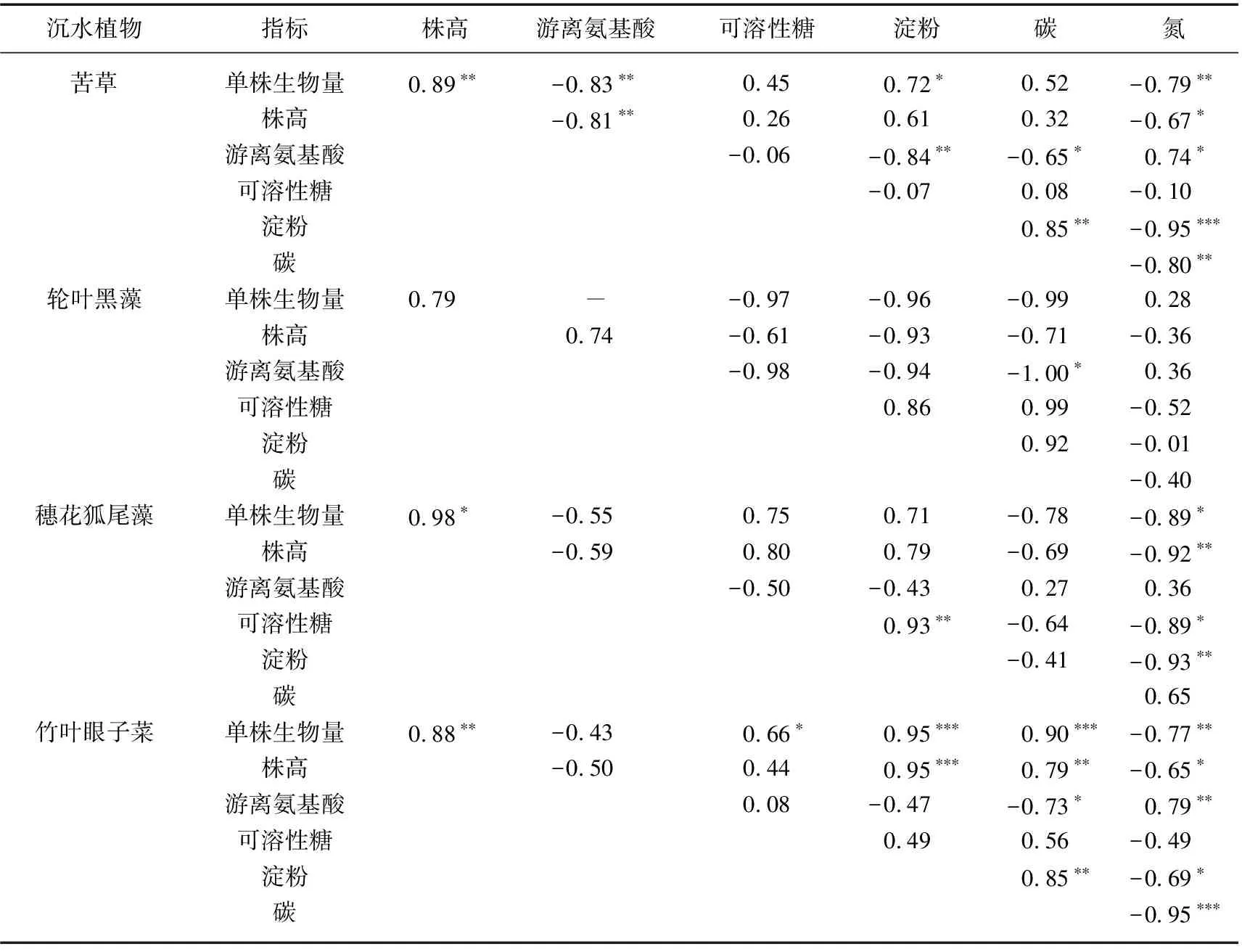
表3 4种沉水植物生长指标和生理指标的Pearson相关性分析
3 分析与讨论
沉水植物的生长、繁殖受到多种环境因素的影响,本研究水域水温、水体营养盐都在适合沉水植物生长的范围[28-29],而水下光合有效辐射都远小于相似环境下4种沉水植物的光饱和点[30-31],所以研究水域的水下光强最有可能成为影响南部湖心区域沉水植被恢复的主要限制因子.也有前人研究表明,洱海透明度下降对沉水植物造成弱光胁迫,这是导致洱海沉水植被退化的重要因素[13].
通过观测沉水植物的存活率、株高和单株生物量的变化,可以反映出其生长状况和适应能力.弱光环境下,四者存活率、株高和单株生物量均显著性下降,说明湖心区域的弱光条件抑制了沉水植物的生长,这与其他研究者报道的结果一致[32-33].四者中苦草的最终存活率最高,且其相对生物量和相对株高均高于其他3种植物,说明苦草对湖心平台弱光环境的耐受能力最强.
在弱光环境下,沉水植物通常会加快光合色素的合成,增加叶绿素的含量来获取更大的光合作用能力[34],这也体现了沉水植物对弱光的适应,4种植物中,仅苦草的叶绿素含量呈上升趋势,穗花狐尾藻和竹叶眼子菜叶绿素含量变化不大,而轮叶黑藻叶绿素含量下降,苦草叶片叶绿素含量的升高可以提升对光的获取能力,一定程度上反映了苦草对弱光环境具有相对较强的适应能力.
通常在弱光环境下植株具有较低的可溶性糖和淀粉含量以及C∶N比,而具有更高的游离氨基酸和氮含量[35-36],因此检测沉水植物的氮、碳含量和代谢物含量,有利于反映植物受胁迫的程度.N是蛋白质的重要组成元素,C是植物的结构性元素,对植物生长有重要的影响[37-38],并且生物在变化的环境中具有保持自身化学组成相对稳定的能力[39],所以研究逆境条件下沉水植物的C、N变化具有重要意义.弱光环境下,苦草、穗花狐尾藻和竹叶眼子菜的N含量均升高,C∶N比均下降,反映了这3种沉水植物在生理上的胁迫响应,实验结果与前人研究一致[35],而这3种沉水植物的C含量表现出差异性,穗花狐尾藻C含量升高,竹叶眼子菜在实验前期也有上升的趋势,这或许与二者大量叶片腐烂掉落使茎的生物量占比升高有关,因为沉水植物茎的C含量比例相对较高[40].轮叶黑藻C、N含量变化与其他3种沉水植物不同,轮叶黑藻C含量上升,而N含量和C∶N比变化不明显.
氨基酸是合成生物体内酶的物质基础,是指示环境胁迫的重要生理指标[41-42].可溶性糖是植物能直接利用的能源物质[43],在弱光胁迫下,光合作用合成糖类的量都很低,植株需要消耗淀粉转化可溶性糖以提供能量基础,所以植株储存的碳水化合物的含量与植物对不良环境的耐受能力息息相关[44].弱光环境下,4种沉水植物有不同的生理响应,苦草、穗花狐尾藻和竹叶眼子菜的代谢物含量变化的趋势一致(氨基酸含量升高,可溶性糖和淀粉含量下降),3种沉水植物都在生理特征上表现出胁迫响应,但是仅有苦草的氨基酸含量呈现持续上升的趋势,并且在实验期间,苦草淀粉含量一直保持在较高的水平,而穗花狐尾藻和竹叶眼子菜淀粉含量持续下降至极低值,这也一定程度反映了苦草对弱光环境具有相对较强的耐受能力.轮叶黑藻3种代谢物含量的变化与其他3种沉水植物完全相反,可溶性糖和淀粉含量上升,氨基酸含量下降.就轮叶黑藻生理响应异与其他3种沉水植物的问题,推测出一个可能性,轮叶黑藻在弱光胁迫下有相异于其他植物的适应方式,随着轮叶黑藻生物量和株高的下降,轮叶黑藻部分营养成分逐渐流向胁迫损伤较小的部位.
从4种沉水植物生理与生长指标之间的Pearson相关性分析来看,苦草、穗花狐尾藻和竹叶眼子菜的N含量与株高和生物量的相关性都有显著性,苦草和竹叶眼子菜的淀粉含量与生物量显著性相关,说明这3种沉水植物生长指标的下降与生理上的胁迫响应相关,其中N含量与生长指标的相关性最强,淀粉含量其次.而轮叶黑藻的生理指标与形态指标之间均没有显著性差异,或许是数据不足的原因,也可能是因为黑藻具有异于其他三者的适应弱光的方式.
当前,国内已有不少尝试恢复水生植被的案例,比如在太湖、洪湖、白洋淀、杭州西湖和武汉东湖等均有实践,弱光限制是水生植被恢复中经常遇到的问题,前辈们对此提出了不少恢复策略,比如降低水位、改善水质条件、提高透明度、选择耐弱光的物种、选择适宜的种植季节等[45-49].在水生植物物种选择和群落配置问题上,可以根据当地具体自然条件因地制宜、因时制宜,优先考虑选择少量先锋物种,先恢复生态系统的基本结构和功能,随着生境条件的不断改善,逐步引入新的物种,增加物种的多样性[50],本次实验发现,4种沉水植物中,苦草对湖心平台弱光环境的适应能力最强,可以考虑将苦草作为沉水植被恢复的先锋物种,待生境条件进一步改善后,引入其他沉水植物,加强植被群落结构的合理性.虽然本实验比较了洱海4种沉水植物的弱光适应能力,但是从适应能力最强的苦草的生长特征来看,苦草存活数量、生物量和株高下降,并且没有大量分株,持续的弱光环境也会进一步降低苦草的耐受能力,若要实现湖心平台沉水植被的恢复,还需要进一步改善湖心平台的环境条件,同时提高人工恢复的种群密度,利用集群效应提高其存活率.
4 结论
湖心平台水下的弱光环境抑制了4种沉水植物的生长,并表现出不同程度的胁迫反应.4种沉水植物的株高和生物量均显著性降低;在生理特征上,苦草、穗花狐尾藻和竹叶眼子菜均有相似的生理胁迫反应,表现为:N含量升高,游离氨基酸含量升高,C∶N比、可溶性糖和淀粉含量下降,但是仅有苦草的叶绿素含量升高,黑藻有异于其他3种植物的胁迫反应,其氨基酸含量下降,可溶性糖和淀粉含量升高.
比较4种沉水植物的存活率,表现为苦草 > 竹叶眼子菜 > 穗花狐尾藻 > 轮叶黑藻,并且苦草相对生物量和相对株高均高于其他3种沉水植物,说明苦草更能适应湖心平台区域的弱光环境,可考虑作为湖心平台水生植被恢复的目标物种.从苦草的存活量、生物量持续下降的情况来分析,若要实现湖心平台水生植被的恢复,仍需要进一步改善环境条件.
本实验初步尝试在洱海的水生植被重度退化区(湖心平台)进行植被恢复,从4个本地种中比较筛选出适应能力最强的苦草,并每隔1周采样分析其生长和生理状况,为湖心平台水生植被的恢复策略提供基础数据和参考.
致谢:感谢姚轶倩硕士在实验采样过程中的帮助,感谢文紫豪和任文静博士在数据分析过程中的帮助.

