胃癌患者手术前后血清PGⅠ、PGⅡ及二者比值变化对术后复发或转移的预测价值
张 冰 姚 威 宋 涛
胃癌具有早期诊断困难,术后恢复缓慢,发病率和死亡率高的特点,是中国最常见的恶性肿瘤之一[1]。幽门螺杆菌感染和萎缩性胃炎与胃癌发展密切相关,胃蛋白酶原(PG)在胃癌的发展过程中都会发生一系列变化[2-3]。用放射免疫法检测胃癌及其他胃病患者血清PG,具有简单、有效和经济的优点,对胃癌的早期诊断和术后复发的早期预测具有重要意义,有效提高胃癌治愈率和生存率,降低死亡率[4]。PG能反映胃粘膜不同部位的形态和分泌功能,主要进入胃腔,根据免疫原性不同可分为PGⅠ和PGⅡ两个亚组,胃粘膜中分泌细胞的分布不同,胃底腺粘膜的主要细胞和宫颈细胞主要分泌PGI和少量PGⅡ,门控腺、幽门腺和Burnner's可产生PGⅡ[5-6]。本次研究选取我院确诊的拟实施胃癌根治性手术的患者90例,探讨胃癌患者血清胃蛋白酶原Ⅰ(PGⅠ)、PGⅡ及其相互间比值(PGR)在手术前后的变化及对患者复发或转移的预测价值。
1 资料与方法
1.1 临床资料
选取我院2016年1月至2018年1月确诊的拟实施胃癌根治性手术的患者90例作为观察组、选取45例健康体检对象作为对照组。入选标准:①患者年龄范围79岁以内;②术前经胃镜检查确诊为胃癌;③TNM分期:Ⅰ期~Ⅲ期;④具有手术适应症,在我院接受同一组医护人员手术治疗;⑤术后接受随访观察;⑥复发及转移的诊断以CT、超声及病理学结果为标准;⑦本研究符合《赫尔透辛基宣言》相关医学伦理规定,经我院医学伦理委员会批准。排除标准:①转移性胃癌;②既往手术后再次复发的胃癌患者;③合并其他部位的肿瘤;④免疫系统疾病;⑤不愿接受术后随访。观察组,患者年龄39~72岁,平均(54.8±9.2)岁,男性50例、女性40例;TNM分期:Ⅰ期15例、Ⅱ期53例、Ⅲ期22例,肿瘤分化程度:高分化28例、中分化43例、低分化19例;发生淋巴结转移44例;其中实施胃大部切除62例、全胃切除28例;随访24个月,复发22例、转移20例。对照组,年龄33~75岁,平均(56.1±12.0)岁,男性24例、女性21例。两组研究对象的年龄、性别比较,差异不具有统计学意义(P>0.05)。
1.2 指标检测方法
所有受试者均在早上6点空腹抽取3 ml静脉血,高速离心分离血清,并在2 h内完成试验。患者在术前10 h禁食,所有样本检测均使用LumiStation 1800Plus型化学发光酶标仪(上海闪谱生物科技有限公司),PGⅠ、PGⅡ检测试剂盒(北京奥维亚生物技术有限公司),应用ELISA法来检测血清中术前、术后1周、术后1个月的血清PGⅠ、PGⅡ水平,计算PGR值。检测方法严格参照试剂盒内说明书进行。常参考值范围:PG I为67~200 μg/l,PGII为0~15 μg/l,PGR为≥7.5 μg/l。
术后对患者进行随访,依据24个月后是否出现复发、转移进行分组比较,绘制工作曲线(ROC)分析手术前患者的PGⅠ、PGⅡ及PGR。
1.3 统计学方法
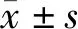
2 结果
2.1 对照组和观察组血清PGⅠ、PGⅡ及PGR测定值比较
观察组术前的血清PGⅠ、PGR测定值显著低于对照组(P<0.05),观察组患者术后1周、术后1个月的血清PGⅠ、PGR测定值均较本组术前显著升高(P<0.05),见表1。

表1 对照组和观察组的血清PGⅠ、PGⅡ及PGR测定值比较
2.2 复发或转移组与未复发或转移组患者的血清PGⅠ、PGⅡ及PGR测定值比较
复发或转移组术前的血清PGⅠ、PGR测定值显著低于未复发或转移的患者(P<0.05)。见表2。

表2 复发或转移组与未复发或转移组患者的血清PGⅠ、PGⅡ及PGR测定值比较
2.3 血清PGⅠ、PGR测定值预测患者术后复发的关系
以胃癌患者手术前的血清PGⅠ、PGR测定值绘制ROC曲线,结果显示,术前的血清PGⅠ预测胃癌术后复发或转移的灵敏度为78.17%、特异度为65.24%、ROC曲线下面积AUC值为0.730;术前的血清PGR预测胃癌术后复发或转移的灵敏度为93.35%、特异度为78.66%、ROC曲线下面积AUC值为0.861。见表3、图1。

表3 血清PGⅠPGR测定值预测术后复发的价值

图1 胃癌患者血清PGⅠPGR预测术后复发ROC曲线图
3 讨论
胃癌的发病率和死亡率一直是我国恶性肿瘤中最高的,也是我国最常见的恶性肿瘤之一,早期发现和对症治疗是胃癌疗效的关键[7]。为早期胃癌或胃癌癌前病变的大规模筛查找到1种简单、灵敏和无创的方法尤为重要。在日本、芬兰等国,用血清学方法对萎缩性胃炎和胃癌进行鉴别诊断的研究已经进行了多年[8]。胃蛋白酶原(PG)是胃蛋白的前体,没有活性,大多数食物蛋白质可以刺激PG的分泌,可在人体胃液、血清和尿液中检测到,在胃中被盐酸转化为活性胃蛋白酶[9-10]。PG可以通过反映胃粘膜的结构和分泌功能,间接反映胃粘膜的功能。基于其免疫活性,将血清PG分为两种亚型,即PGⅠ和PG Ⅱ[11]。PGⅠ主要由胃底腺细胞和粘液细胞分泌,可作为胃体的血清学标志,当胃粘膜腺体萎缩时,PG I减少;PGII是由贲门的贲门腺、胃窦的幽门腺和十二指肠附近的Burnner's产生的[12]。在正常情况下,大约1%的PG可以进入人体血液循环,而大多数PG进入胃腔并在酸性胃液的作用下转化为胃蛋白酶。当急性和慢性胃粘膜炎症发生时,炎症因子刺激导致PG I和PG II水平升高。当慢性炎症导致胃粘膜萎缩、非典型增生和癌变时,PG Ⅰ和PG Ⅱ水平的变化将导致PGR水平的变化。因此,前列腺素水平可用于筛选晚期萎缩性胃炎和早期胃癌[13]。
血清水平的变化可以直接反映胃粘膜的功能变化[13]。从本次结果来看,对照组和观察组的血清PGⅠ、PGⅡ及PGR测定值进行比较发现,观察组术前的血清PGⅠ、PGR测定值明显低于对照组,超过80%的胃癌与萎缩性胃炎相关,并且萎缩性胃炎可导致胃粘膜主要细胞的损失,这影响分泌功能并导致PGI水平降低。胃癌患者血清PGII含量变化不大,可能与胃黏膜PGII分泌细胞分布广泛有关[14]。术后胃癌患者血清PGⅠ、PGⅡ水平可以显示残胃粘膜腺体的分泌情况,对血液水平进行检测。术后1周、术后1个月观察组患者的血清PGⅠ、PGR测定值均较本组术前显著的升高;因为受正常细胞分泌的影响胃癌细胞分泌的PG,在血清中无法检测到,因此当胃完全切除时,如果PGⅠ、PGⅡ水平上升,最有可能是胃癌细胞分泌的,可能有癌症复发,应该进行进一步的胃镜检查[14-15]。对随访患者血清PGⅠ、PGⅡ及PGR测定值进行比较,复发或转移组术前的血清PGⅠ、PGR测定值显著高于未复发或转移的患者,差异具有统计学意义。说明全胃切除后血清PGⅠ、PGⅡ及PGR的显著升高为胃癌复发的临床指标之一。
以胃癌患者手术前的血清PGⅠ、PGR测定值绘制ROC曲线,灵敏度为纵坐标,(1-特异度)为横坐标。ROC曲线下面积AUC值越接近1,说明该指标对胃癌诊断的效果就越好。结果显示,术前的血清PGⅠ预测胃癌术后复发或转移的灵敏度为78.17%、特异度为65.24%、ROC曲线下面积AUC值为0.730;术前的血清PGR预测胃癌术后复发或转移的灵敏度为93.35%、特异度为78.66%、ROC曲线下面积AUC值为0.861。结果与郭会玲等[9]相比特异度及敏感度均较高,这可能与本研究中收集的小样本量有关,需要进一步扩大用于分析的样本量,找到PGⅠ、PGⅡ水平及PGR诊断胃癌的最佳界值。
过去钡餐X光透视通常用于诊断胃癌,但这种方法存在辐射暴露的风险;内窥镜检查会给患者带来更大的痛苦和更高的成本。综上所述,检测胃癌患者手术前后的血清PGⅠ、PGR水平,具有简便快捷,创伤小的优点,对于评估患者术后复发具有一定的临床价值,对于指导患者术后治疗具有一定的作用。

