FoxO1蛋白在原发性肝癌(PHC)组织中的表达及与对预后的影响
吴 蓓 高春辉 陶连元 卢 沛 陈 景
我国作为肝炎大国,原发性肝癌(PHC)的发生率一直维持在较高水平,流行病学研究证实,我国PHC的发病率可达236~472/10万人左右[1]。临床上PHC的发生能够导致患者肝功能衰竭、多器官功能障碍和病死率的上升[2]。叉头转录因子O家族1(FoxO1)是叉头转录家族的重要成员,其能够通过抑制癌细胞转录活性的激活,降低癌细胞的过度增殖风险,进而参与到早期恶性肿瘤的发生过程中[3]。FoxO1还能够提高癌细胞的分化成熟能力,降低癌细胞的异型性。部分研究者探讨了FoxO1在其他恶性肿瘤患者中的表达情况,认为FoxO1的表达缺失与卵巢或者乳腺肿瘤的临床分期的进展或者癌细胞形态的改变密切相关[4-5],但对于FoxO1与PHC的关系研究不足。为了揭示FoxO1的表达与PHC的发生关系,深入揭示PHC的发病机制,本次研究选取我院2015年1月至2017年5月收集的90例术后PHC组织标本,探讨了FoxO1的表达及其与PHC患者临床病理特征的关系,报告如下。
1 材料与方法
1.1 一般资料
选取我院2015年1月至2017年5月收集的90例术后PHC癌组织标本为PHC组,癌旁组织标本为癌旁组。PHC患者,年龄43~75岁,平均为(54.2±9.6)岁,男性53例,女性37例;病灶直径:≥5 cm 41例、<5 cm 49例;TNM分期:Ⅰ期20例、Ⅱ期28例、Ⅲ期32例、Ⅳ期10例;AFP水平:>200 ng/ml 54例、≤200 ng/ml 36例。纳入标准:①原发性肝癌患者的诊断标准参考《原发性肝癌诊疗规范2014年版》中的标准;②患者经术后病理学检查证实为原发性肝细胞性肝癌;③癌旁组为距离肿瘤病灶边缘5 cm以内的肝组织;④研究方案获得医学伦理委员会同意后实施。排除标准:①转移性肝癌;②长期使用免疫抑制剂等药物;③HIV感染患者;④手术前具有放化疗病史。
1.2 免疫组化染色方法
采用石蜡切片,脱水操作后采用3%H2O2室温条件下孵育20 min,磷酸盐缓冲液清洗3次,每次5 min,磷酸盐缓冲液稀释后的山羊血清封闭抗体5 min,倒去血清后不清洗,加入一抗(购自赛默飞世尔中国 浓度:1∶1000)5 ml,37 ℃孵育2 h,或者放置4 ℃冰箱过夜孵育,磷酸盐缓冲液清洗3次,每次5 min,加入生物素荧光标记的二抗(购自赛默飞世尔中国 浓度:1∶2000)3 ml,37 ℃孵育20~30 min,磷酸盐缓冲液清洗3次,每次5 min,加入Streptavidin/HRP辣根酶标记链霉卵白素,37 ℃孵育20~30 min,磷酸盐缓冲液清洗3次,每次5 min,增强型HRP-DAB底物显色试剂盒 (PA110)显色,自来水冲洗,复染,封片。
1.3 免疫组化染色分析的结果判定
染色分析的结果判定:FoxO1蛋白主要分布于细胞核中,FoxO1蛋白的阳性染色在显微镜下均表现为黄色、棕黄色甚至褐色。①FoxO1蛋白在细胞中的染色程度分为:未染色(0分)、仅仅淡黄色染色(1分)、棕黄色染色(2分)、染色呈褐色、黑色(3分);②根据染色的细胞占比结果:占比≤10%计分1分、占比范围11%~50%计分2分、占比范围51%~75%计分3分、占比>75%计分4分,染色程度与阳性细胞计分之乘积<3分为阴性、≥3分为阳性。
1.4 统计学方法
2 结果
2.1 PHC组与癌旁组中的FoxO1蛋白阳性率比较
PHC组织中FoxO1蛋白阳性表达率为43.33%,显著低于癌旁组织的80.00%,差异具有统计学意义(P<0.05)(表1)。
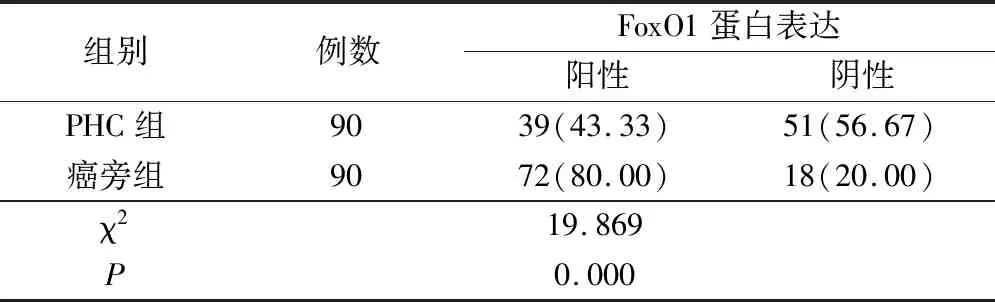
表1 两组标本中FoxO1蛋白阳性率比较(例,%)
2.2 不同病理学特征PHC组织中FoxO1蛋白阳性率比较
TNM分期(Ⅰ期、Ⅱ期)、单发病灶、病灶直径<5 cm的PHC组织中FoxO1蛋白阳性表达率显著高于TNM分期(Ⅲ期、Ⅳ期)、多发病灶、病灶直径≥5 cm的PHC组织,差异具有统计学意义(P<0.05)(表2)。
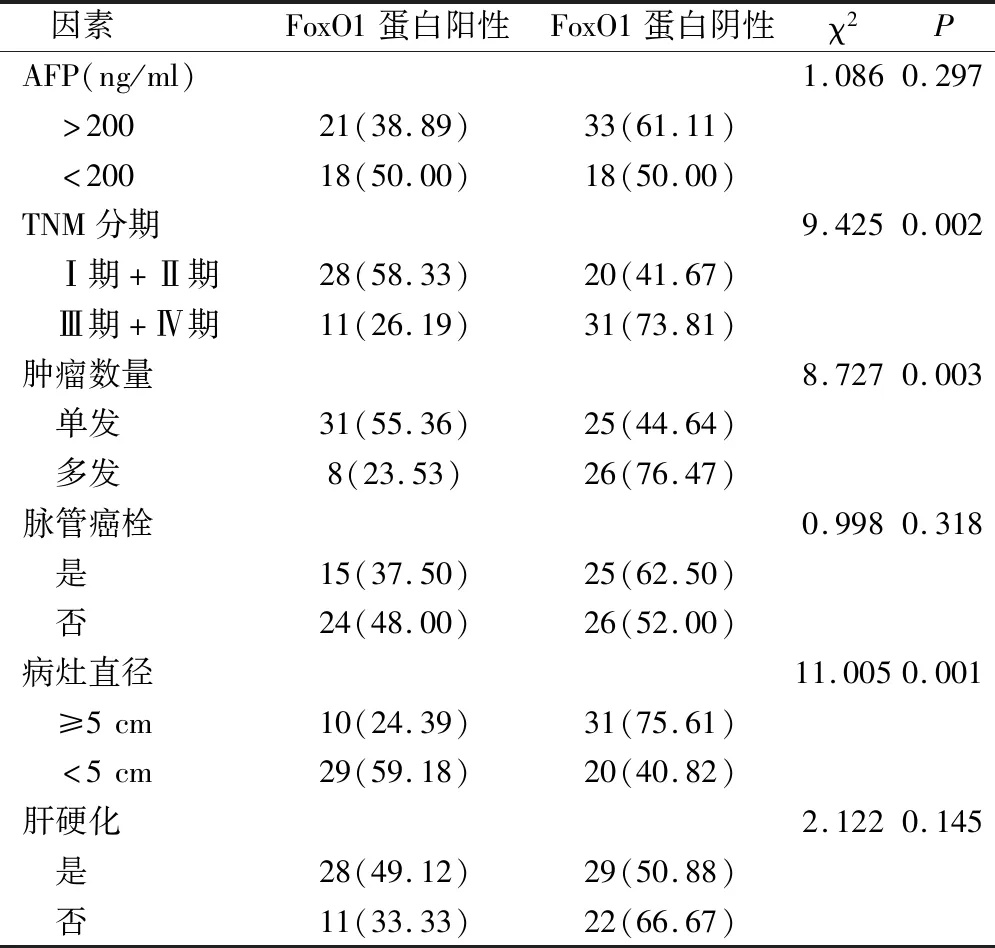
表2 不同病理学特征PHC组织中FoxO1蛋白阳性率比较(例,%)
2.3 FoxO1蛋白阳性与阴性表达PHC患者3年生存情况比较
FoxO1蛋白阳性表达PHC患者3年生存率(64.10%),高于阴性表达组的37.25%(P<0.05),见表3。

表3 FoxO1蛋白阳性与阴性表达的PHC患者3年生存情况比较(例,%)
2.4 多因素分析
采用COX比例风险回归模型分析,结果显示:TNM分期增高、发生脉管癌栓、肝硬化、FoxO1蛋白表达下调是PHC患者不良预后的独立危险因素(P<0.05),见表4。

表4 多因素分析结果
3 讨论
PHC是较为常见的消化系统恶性肿瘤,其短期内病情进展速度较快,远期复发及转移的风险较高。在长期乙肝病毒感染或者致癌因子接触的条件下,小叶上皮细胞的异常分裂过程,能够显著增加PHC的发生风险[6]。临床上PHC患者的中位生存时间或者五年生存率等生存预后指标较差,其中位生存时间不足34个月,五年生存率不足40%[7-8]。不同的临床病理因素均能够影响到PHC的病情进展,而通过对于不同临床影响因素的分析,不仅能够揭示PHC的部分发病病因,同时还能够在PHC患者出院后随访方面发挥作用。
FoxO1蛋白能够调控癌细胞细胞周期调控依赖性蛋白激活的转录及翻译,增加G0/S期比例,稳定癌细胞周期[9]。分子机制方面的研究显示,FoxO1蛋白表达浓度的改变在促进癌细胞分化成熟、降低癌细胞的粘附能力等方面同样发挥了重要的作用[10]。部分研究者已经探讨了FoxO1蛋白在肝癌患者中的表达情况,认为FoxO1蛋白的表达缺失与肝癌的早期发生密切相关[11]。
FoxO1蛋白在病例组患者中的表达明显下降,表明FoxO1蛋白的表达缺失可能影响到了PHC的早期发生过程。下列因素可能影响到了相关机制的发生和进展[12-14]:①FoxO1蛋白的表达缺失导致癌细胞的增殖调控异常,癌细胞的持续性自我增殖能力持续上升;②FoxO1蛋白的表达缺失可导致癌细胞的侵袭能力明显改变,上皮细胞突破基底膜的风险明显的增强。陈俊任等[15]研究者也在探讨PHC的发病机制过程中发现,FoxO1蛋白在PHC患者中的表达阳性率可平均下降35%以上,特别是在中晚期恶性肿瘤或者远期病死率较高的患者中,FoxO1蛋白的表达浓度可进一步的下降。对于FoxO1蛋白的表达与PHC的关系研究可见,在临床分期较早、单发病灶或者肿瘤直径较小的PHC患者中,FoxO1蛋白的表达阳性率可显著的上升,提示了FoxO1蛋白的表达对于PHC患者临床分期等病理特征的影响,这主要由于FoxO1蛋白的表达缺失能够提高癌细胞对于临近正常肝脏上皮组织的侵袭能力,导致癌细胞癌栓深度和癌栓范围的增加,提高了PHC的临床分期;而FoxO1蛋白的表达缺失对于肿瘤直径等的影响,考虑与肝脏上皮细胞增殖特性的改变有关。但本次研究中,并未发现FoxO1蛋白的表达与PHC患者脉管癌栓或者甲胎蛋白(AFP)的关系,考虑可能与本次研究的样本量限制有关。FoxO1蛋白阳性表达率PHC患者3年生存率64.10%高于阴性表达组的37.25%,提示了FoxO1蛋白的表达与PHC患者临床预后的关系,这主要由于FoxO1蛋白的表达阳性率的维持,能够稳定肿瘤细胞的生物学特征,降低肿瘤细胞复发和转移的风险,最终影响到临床预后。最后本次研究发现,TNM分期增高、发生脉管癌栓、肝硬化、FoxO1蛋白表达下调是PHC患者不良预后的独立危险因素,提示临床上对于具有相关高危临床特征表现的患者,应注意对于患者的随访,采用综合性的治疗措施,从而改善PHC的临床结局。
综上所述,在PHC患者中,FoxO1蛋白的表达明显的下降,同时FoxO1蛋白的表达缺失与PHC患者的临床病理特征和临床预后密切相关。

