贵州省刺梨中抗坏血酸含量HPLC 测定方法优化
钱志瑶,龚艳丽,梁芳瑜,罗忠圣,徐昌艳,覃容贵*
(1.贵州医科大学环境污染与疾病监控教育部重点实验室,贵州贵阳 550025;2.贵州医科大学公共卫生与健康学院,贵州贵阳 550025;3.贵州医科大学药学院,贵州贵阳 550025;4.贵州省中国科学院天然产物化学重点实验室,贵州贵阳 550014)
刺梨(Rosa roxburghiiTratt.Ros.Monogr.)属蔷薇科蔷薇属植物,为多年生落叶丛生灌木,主要分布于我国贵州、云南、四川、湖南等地区,尤其以贵州省品种最多、年产量最高[1],刺梨的营养价值较高,主要含有抗坏血酸、优质膳食纤维[2]、多糖、黄酮、超氧化物歧化酶(SOD)、刺梨甾醇(β-谷甾醇)及三萜类化合物等成分,具有促进胃肠道消化[3]、调节人体免疫功能、延缓衰老、抑制癌细胞增殖、抗氧化[4]、抗动脉粥样硬化、降低人体胆固醇、防治糖尿病[5-6]、辐射防护与抗凋亡等药理作用[7-8]。
抗坏血酸又名维生素C,是植物和大多数动物体内合成的一类已糖内酯化合物,也是人体必需的一种物质,用来维持人体的正常生长发育,具有清除自由基、抗衰老、抗氧化、调节人体机能等功效[10],由于人体内缺乏其合成的关键酶导致无法合成抗坏血酸,因此人体内抗坏血酸的获取主要来源于富含抗坏血酸的蔬菜及水果等植物[11]。
试验为探究简便快捷、测定结果准确、用于测定贵州省刺梨中抗坏血酸含量的HPLC 测定法,以GB 5009.86—2016 食品安全国家标准“食品中抗坏血酸的测定”[12]中第一法高效液相色谱法的色谱条件为基础,分别对流动相、柱温、流速进行优化,确定最佳的色谱条件,并对贵州省刺梨中抗坏血酸进行含量测定,将测定的抗坏血酸含量与GB 5009.86—2016 食品安全国家标准“食品中抗坏血酸的测定”[12]中第一法高效液相色谱法测定的结果进行比较,确定所优化方法的可行性,为贵州省刺梨中抗坏血酸的含量测定,刺梨功能性食品、膳食补充剂和药物制剂的质量评价提供更多的检测方法。
1 材料与方法
1.1 材料
1.1.1 试剂
维生素C 标准品,贵州迪大科技有限责任公司;草酸,分析纯,天津市致远化学试剂有限公司;偏磷酸、磷酸二氢钾,国药集团化学试剂有限公司;甲醇,色谱纯,默克股份两合公司;刺梨,贵州省刺梨鲜果,来源见表1。

表1 贵州省刺梨来源Table 1 Sources of Roxburgh in Guizhou province
1.1.2 仪器与设备
高效液相色谱仪,Agilent HPLC 1100 型,美国Agilent公司;色谱柱,ACE Excel 5 C18-AR 250 mm×4.6 mm,5 μm、资生堂C184.6 mm×250 mm,5 μm、XSelectR CSHTMC184.6 mm×250 mm,5 μm;高功率数控超声波清洗器,KQ-800KDV 型,昆山市超声仪器有限公司;电子天平,XSE105DU 型,METTLER TOLEDO;0.45 μm 有机滤膜,江苏绿盟科学仪器有限公司。
1.2 方法
1.2.1 样品前处理
取贵州省刺梨鲜果榨汁,加水使每毫升刺梨汁中含1 g 刺梨鲜果,过滤,得刺梨汁。
1.2.2 对照品溶液的制备
精密称取VC 标准品适量,0.05%草酸溶液稀释并定容至浓度为0.01 mg/mL,混匀,即得对照品溶液。
1.2.3 样品溶液的制备
称取刺梨汁约0.5 g,0.05%草酸溶液稀释并定容至100 mL,混匀,吸取1mL 样品稀释液于10 mL 容量瓶中,0.05%草酸溶液定容,混匀,即得浓度为0.5 mg/mL 样品溶液。
1.2.4 色谱条件
(1)流动相选择
分别以0.01%、0.05%、0.10%浓度草酸溶液为水相,100%甲醇为有机相,按水相∶有机相=98∶2 比例,取对照品溶液、样品溶液进样检测,选择最佳流动相水相。
(2)流速选择
取对照品溶液、样品溶液,分别用流速0.4、0.7、1.0、1.3 mL/min 进样检测。
(3)柱温选择
取对照品溶液、样品溶液,分别用柱温25、30、35 ℃进样检测。
1.2.5 方法学考察
(1)耐用性试验
取对照品溶液、样品溶液,分别使用ACE Excel 5 C18-AR、资生堂C18、XSelectR CSHTMC18色谱柱,进样检测。
(2)专属性试验
分别取对照品溶液、样品溶液进样检测,按照式(1)计算抗坏血酸理论塔板数,同时根据所得色谱图对刺梨中抗坏血酸色谱峰的分离情况、峰形以及有无干扰峰进行判断。
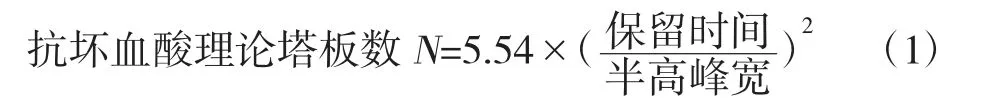
(3)线性关系
分别取浓度0.1 mg/mL 的VC 对照品溶液0、0.05、0.5、1.0、2.5、5 mL,0.05%草酸稀释并定容至10 mL,即得标准曲线工作液浓度分别为0、0.5、5.0、10、25、50 μg/mL。将其逐次进样检测,以VC 对照品溶液浓度(μg/mL)为横坐标x,相对应的峰面积为纵坐标y,绘制标准曲线。
(4)精密度试验
取同一对照品溶液于高效液相色谱仪中连续进样6次,得色谱峰面积,求其平均值、RSD。
(5)稳定性试验
取同一样品溶液于0、1、2、3 h 后分别在高效液相色谱仪中进样检测,得色谱峰面积,求其平均值、RSD。
(6)重复性试验
按照1.2.3 方法平行配制6 份样品溶液,于高效液相色谱仪中进行检测,得色谱峰面积,求其平均值、RSD。
(7)回收率试验
称取0.25 g 刺梨汁于100 mL 容量瓶中9 份,分别加入经计算后已知样品中VC 含量的80%、100%、120%的VC 对照品溶液(各平行三份),0.05%草酸溶液定容,从中吸取1 mL 溶液,置于10 mL 容量瓶中,0.05%草酸溶液稀释定容,混匀,于高效液相色谱仪中检测。根据样品中原有抗坏血酸含量、抗坏血酸加入量、样品测得抗坏血酸量,计算抗坏血酸的回收率、RSD。
1.2.6 刺梨中抗坏血酸的含量测定
取1 g/mL 刺梨汁按1.2.3 方法进行配制,使用本试验优化的方法测定各刺梨样品中抗坏血酸含量。同时使用GB 5009.86—2016 食品安全国家标准“食品中抗坏血酸的测定”[11]中第一法高效液相色谱法测定贵州省刺梨抗坏血酸含量。使用IBM SPSS Statistics 26 软件进行数据统计,采用配对样本T 检验对两种方法测定的刺梨中抗坏血酸含量进行比较,判断所测结果是否具有差异。
抗坏血酸含量的计算参考文献[13]的方法,根据公式(3)(4)计算回收率。

式中,X-样品中抗坏血酸的含量,mg/g;C样-各样品抗坏血酸浓度,μg/mL;V0-样品定容的体积,mL;m-称样量,g。

2 结果与分析
2.1 色谱条件的确定
通过对色谱条件进行优化,试验结果比较分析得,流动相以0.05%草酸-甲醇(98∶2)的配比时,刺梨中抗坏血酸的色谱峰峰形对称性较好(图1)。柱温的改变对于刺梨中抗坏血酸色谱峰的出峰时间和峰型没有明显变化,实验室的室温接近25 ℃,故选择柱温为25 ℃(图2)。流速过快,出峰的时间较早,与溶剂干扰峰比较接近,流速过慢,出峰时间过晚,影响实验效率,故确定流速为0.7 mL/min(图3)。本试验的色谱条件为流动相:0.05%草酸-甲醇(98∶2);柱温:25 ℃;流速:0.7 mL/min。
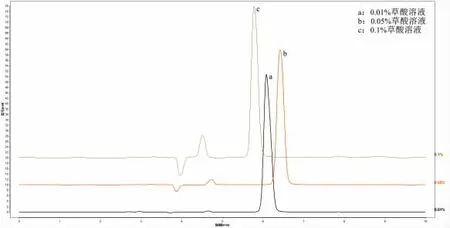
图1 不同流动相水相浓度样品色谱图Fig.1 Chromatogram of water concentration in different mobile phases
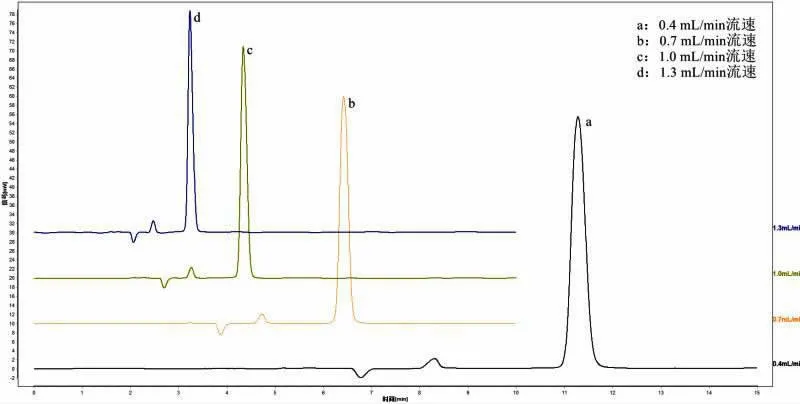
图2 不同流速样品色谱图Fig.2 Chromatogram of samples with different flow rates
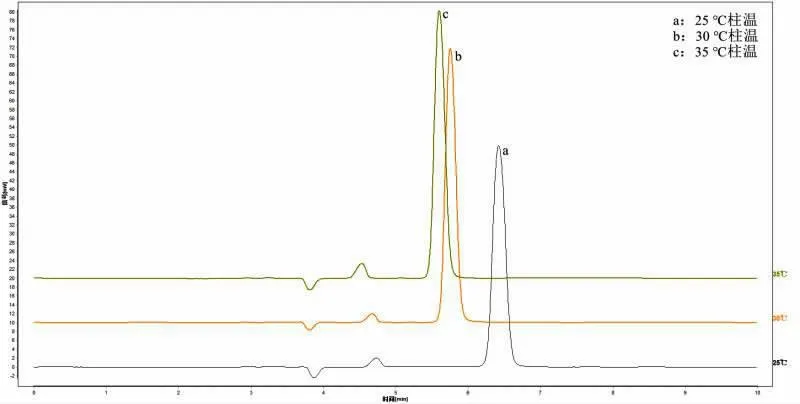
图3 不同柱温样品色谱图Fig.3 Chromatogram of samples with different column temperatures
2.2 耐用性试验
本试验所优化的刺梨抗坏血酸的测定方法在色谱柱型号发生改变后,测定出的峰面积没有受到明显的影响,表明试验优化的抗坏血酸检测方法对可变试验因素的抗干扰能力较强。
2.3 专属性试验
对照品溶液、供试品溶液的高效液相色谱中抗坏血酸理论塔板数(N)分别是24 002.7、22 208.6,供试品溶液中抗坏血酸色谱峰分离较好,峰形对称,并且阴性无干扰,如图4、5(见下页)。该方法专属性良好。
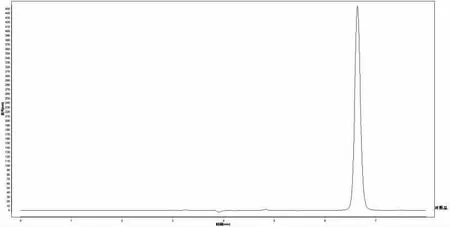
图4 对照品HPLC 色谱图Fig.4 HPLC chromatogram of reference substance
2.4 标准曲线及线性方程
刺梨抗坏血酸在0~50 μg/mL 范围内线性良好,回归方程:y=96.094x-2.958,相关系数R2=0.999 9。
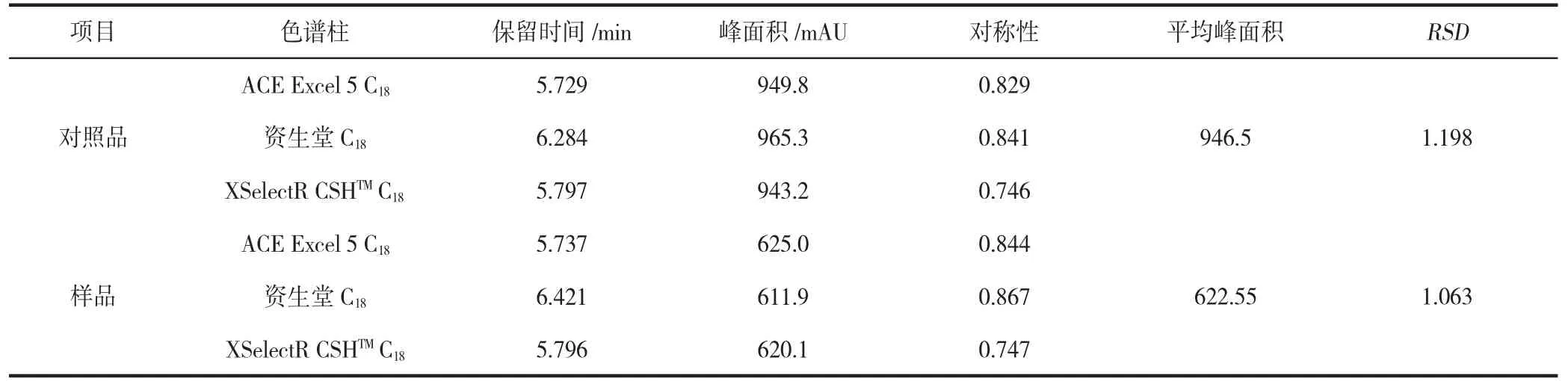
表2 耐用性试验结果Table 2 Durability test results
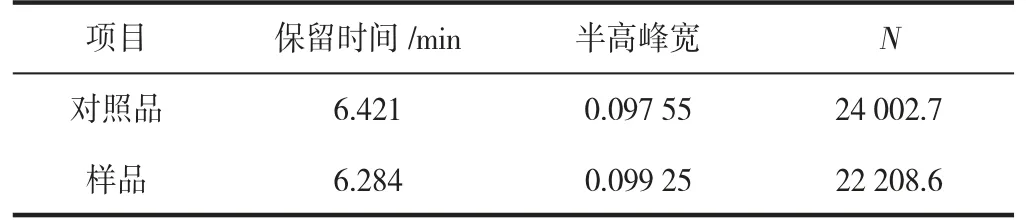
表3 对照品、供试品溶液抗坏血酸理论塔板数Table 3 Theoretical plate number of ascorbic acid solution of reference substance and test substance
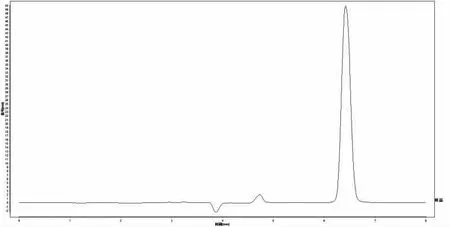
图5 样品HPLC 色谱图Fig.5 HPLC chromatogram of the sample
2.5 精密度试验
测得对照品中抗坏血酸平均峰面积为960.28,RSD为0.406%,表明该方法测定结果的精密度良好。
2.6 稳定性试验
测得供试品溶液中抗坏血酸平均峰面积为605.95,RSD为1.001%,表明供试品溶液在3 h 内测定基本稳定。
2.7 重复性试验
测得供试品溶液中抗坏血酸平均峰面积为1 217.97,RSD为0.486%,表明该方法重现性好。
2.8 回收率试验
回收率试验中,抗坏血酸添加量为已知样品中抗坏血酸含量的80%,平均回收率为101.38%,RSD为0.64%;添加量为已知样品含量的100%,平均回收率为99.44%,RSD为0.53%;添加量为已知样品含量的120%,平均回收率为99.06%,RSD值为0.21%。回收率较好。
2.9 两种方法测定贵州省刺梨中抗坏血酸含量结果比较
使用IBM SPSS Statistics 26 软件进行数据统计,配对样本T 检验分析,P>0.05,按α=0.05 水准,差异无统计学意义,可认为试验优化的测定方法刺梨中抗坏血酸的含量与GB 5009.86—2016 食品安全国家标准“食品中抗坏血酸的测定”中第一法HPLC 测定刺梨中抗坏血酸含量两者无明显差异(表4)。
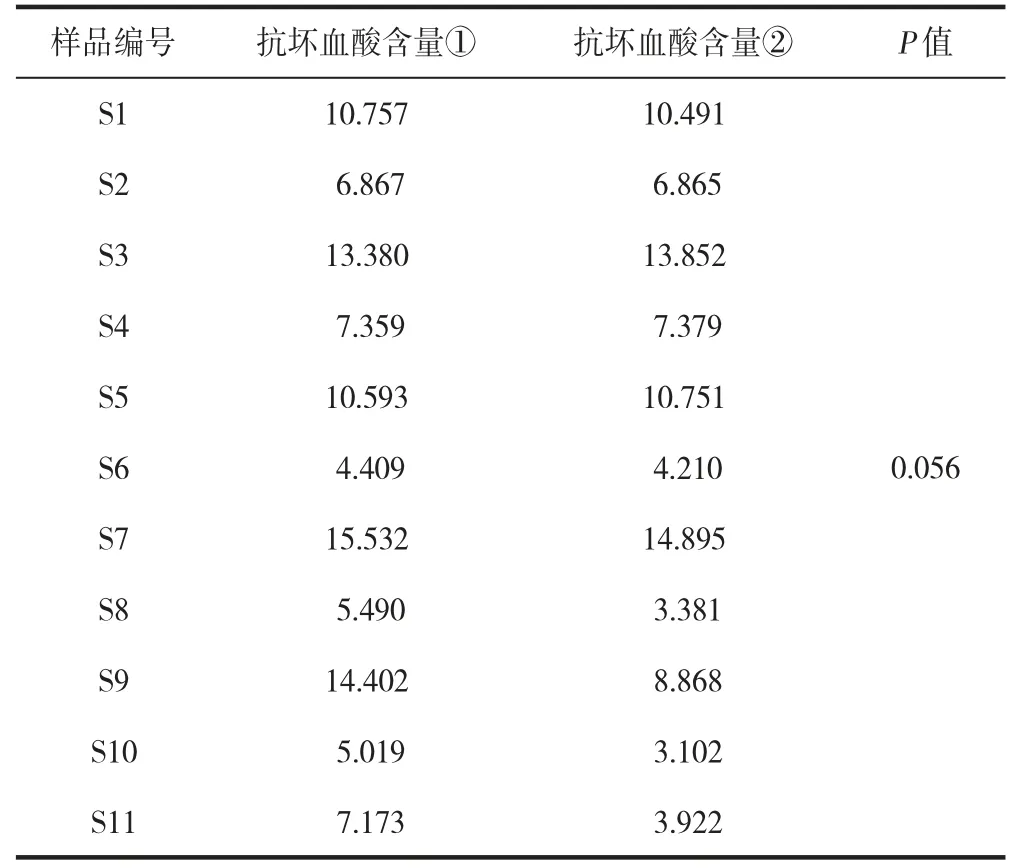
表4 两种方法测定刺梨中抗坏血酸含量结果比较Table 4 Comparison of ascorbic acid content in roxburgh determined by two methods
3 讨论
GB 5009.86—2016 食品安全国家标准“食品中抗坏血酸的测定”中记载了3 种检测抗坏血酸含量的方法,分别为高效液相色谱法、荧光法、2,6-二氯靛酚滴定法[12]。荧光法适用于蔬菜、水果及其制品中总抗坏血酸的测定,但大多数植物组织内含有一种能破坏抗坏血酸的氧化酶,需进行前处理,操作步骤复杂,试剂和样品溶液稳定性差,且某些果胶含量高的样品不易处理。操作过程中使用的活性炭,虽然可将抗坏血酸氧化为脱氢抗坏血酸,但其有吸附抗坏血酸的作用,影响抗坏血酸含量的测定,且由于影响荧光强度的因素较多,大批量检测时,测定条件很难完全再现,易造成检测结果的不准确性[13-14]。2,6-二氯靛酚滴定法成本低、方法简便,但不能直接测定样品中脱氢抗坏血酸及结合抗坏血酸的含量,易受其他还原物质的干扰。且若样品中含有大量色素类物质,致使抗坏血酸提取液颜色过深,会增大实验误差[15-16]。高效液相色谱法检测食品中抗坏血酸含量较荧光法、2,6-二氯靛酚滴定法的灵敏度高,专属性强,重复性良好,测定结果准确。而GB 5009.86—2016 食品安全国家标准“食品中抗坏血酸的测定”中第一法HPLC 测定食品中抗坏血酸含量,所使用的试剂、配制方法以及实验步骤均较复杂,如流动相水相的配制采用6.8 g 磷酸二氢钾和0.91 g 十六烷基三甲基溴化铵进行配制,标准品溶液以及供试品溶液的配制需使用20 g/L 的偏磷酸溶液进行定容,同时在试样溶液还原过程中,还需磷酸溶液调节pH 至2.5~2.8。复杂的操作步骤,可能增加试验结果的不准确,且抗坏血酸久置不稳定、易氧化,故本试验对HPLC 测定方法进行了优化,以简化试验操作过程,提高试验结果的准确度。
优化得贵州省刺梨中抗坏血酸HPLC 含量测定方法为:色谱柱:资生堂C184.6 mml.D×250 mm;柱温:25 ℃;检测波长为245 nm;流动相为0.05%草酸水溶液-甲醇(98∶2);进样量20 μL;流速:0.7 mL/min。
试验优化方法所测结果与GB 5009.86—2016 食品安全国家标准“食品中抗坏血酸的测定”中第一法高效液相色谱法检测结果无差异,即所得优化HPLC 方法用以测定贵州省刺梨中抗坏血酸含量操作简便、快捷、准确,且灵敏度高,分离度好,结果准确,重复性较好。

