核桃内种皮苦涩味品质代谢组学分析
时羽杰,邬晓勇,糜加轩,赵 倩,刘欢欢,万雪琴
(1四川农业大学 林学院,四川 成都 611130;2成都大学 a 农业农村部杂粮加工重点实验室,b 药学与生物工程学院,四川 成都610106)
核桃(JuglansregiaL.)为胡桃科核桃属落叶乔木,是世界四大干果(核桃、榛子、扁桃、腰果)之首[1],核桃仁是核桃的主要食用和产品加工部位,其富含脂肪、蛋白质、维生素E、矿物质、甾醇等营养物质[2]。核桃仁表面包裹着一层薄膜,即为核桃内种皮。大量研究表明,核桃内种皮是酚类物质的重要来源,核桃90%以上的多酚和黄酮主要集中在核桃内种皮中[3-4]。由于内种皮富含多酚和黄酮类物质会使得蛋白质沉淀,而多酚类中的单宁、儿茶素等物质会产生强烈的苦涩味,使得果实的口感受到影响[5-7]。Scharbert等[8]研究茶中51种可能影响口感的物质发现,茶汤的苦味主要来源于咖啡碱,涩味来源于黄酮醇-糖苷,还首次发现黄烷醇-3-糖苷既有涩味,又能增强咖啡碱苦味。Frydman等[9]发现,柚和酸橙中含有大量的柚皮苷,其含量占类黄酮物质总量的75%以上,是造成苦味的主要糖苷类物质。Zhang等[10]基于电子舌技术测定穿心莲苦味,发现穿心莲内酯、14-脱氧穿心莲内酯、脱水穿心莲内酯等6种物质含量与苦味呈显著正相关。李露双等[11]采用转录组学分析麻竹笋中苦涩味物质的形成发现,糖酵解途径、苯丙氨酸、酪氨酸和色氨酸合成途径与苦涩味物质合成密切相关。大多数此类研究集中在茶、中药和水果的苦涩味物质上,而有关干果类核桃内种皮苦涩味物质的组成及其合成调控机理的研究尚属空白。
代谢组学(metabolomics)是继基因组、转录组和蛋白质组学后兴起的一门系统生物学科[12]。代谢组学技术通过高通量化学分析对生物体内相对分子质量小于1 000的代谢物进行定性和定量分析[13],从中检测并筛选出具有显著差异的代谢物质,并以此为基础研究生物体的代谢过程和变化机制[14]。常被用于疾病诊断和药物鉴定[15-17]、植物代谢和抗逆响应机制研究[18-19]、家系图谱分析[20]、食品营养成分和品质研究[21-22]等方面。Narduzzi等[23]采用UHPLC-ESI-QTOF-MS技术对不同品种的葡萄进行代谢组学研究发现,涩味较重的欧亚种葡萄果皮中原花青素含量比杂交品种更高。Francini等[24]对不同品种的苹果干进行代谢组学分析发现,儿茶素、表儿茶素和绿原酸等酚类物质是区别不同品种的关键物质,且与其苦涩味密切相关。Gao等[25]利用UPLC-MRM-MS技术分析4种具代表性笋种的苦味后发现,其主要来源于L-苯丙氨酸、尿苷、L-鸟氨酸等,其中L-苯丙氨酸贡献最大。但运用代谢组学技术分析不同苦涩味核桃内种皮代谢物组分及其差异的研究也尚未见报道。
本研究以无苦涩味和重苦涩味的核桃内种皮为材料,利用超高效液相色谱和串联质谱(UPLC-MS/MS)技术和代谢组学方法,检测2种材料中的代谢组分,筛选其中差异显著的代谢物质,分析其相关的代谢通路,揭示苦涩味形成的分子机制,以期为核桃内种皮的代谢物质组成和核桃果实品质的改善研究提供理论参考。
1 材料与方法
1.1 试验材料
核桃无性系是由四川农业大学核桃课题组于2009-2010年在四川马边、峨边彝族自治州等地进行乡土核桃种质资源调查评价并收集的185个优良单株,用其穗条嫁接而成的。经过多年的核桃果实品质品鉴,筛选出内种皮口感极其苦涩的无性系CZ-301(BI)和内种皮口感无苦涩且略带甘甜的无性系CZ-64(SW)。本试验即以核桃无性系CZ-64(SW)和CZ-301(BI)的果实为材料,其栽培管理和生境一致。核桃果实成熟时从树的4个方向各采集20个青果带回实验室,去除青皮和种壳,将新鲜的核仁内种皮剥下,迅速放入10 mL冻存管中于液氮内速冻,共2组3个生物学重复,随后置于-80 ℃冰箱保存备用。
1.2 试验方法
将2组生物样本真空冷冻干燥后,于研磨仪中研磨至粉末状,称取100 mg粉末,溶解于0.6 mL体积分数70%甲醇提取液中,4 ℃冰箱过夜,其间涡旋6次。之后将样品去除,经10 000g离心10 min后,吸取上清液,用0.22 μm微孔滤膜过滤样品,并保存于进样瓶中,用于UPLC-MS/MS分析。
数据采集仪器系统主要包括超高效液相色谱(UPLC,Shim-pack UFLC SHIMADZU CBM30A)和串联质谱(MS/MS,Applied Biosystems 4500 QTRAP)。
液相条件为:采用Waters ACQUITY UPLC HSS T3 C18(1.8 μm×2.1 mm×100 mm);色谱柱;流动相中水相为超纯水加入体积分数0.04%的乙酸,有机相为乙腈加入体积分数0.04%的乙酸。洗脱梯度为:0.00 min,水/乙腈体积比95∶5;10.00 min,水/乙腈体积比5∶95维持1 min;11.10 min,水/乙腈体积比95∶5,维持14 min;流速0.35 mL/min;柱温40 ℃;进样量4 μL。
质谱条件为:电喷雾离子源(ESI)温度550 ℃,质谱电压5 500 V,帘气(CUR)30 psi,碰撞诱导电离(CAD)参数设置为高。在三重四级杆(QQQ)中,每个离子对根据优化的去簇电压(DP)和碰撞能(CE)进行扫描检测[26]。
为监测质谱分析过程中的重复性,在每10个检测分析样本中插入1个质控样本(QC),由BI和SW组的内种皮样本混合而成(mix),本试验中共插入3个。
1.3 数据处理
利用软件Analyst1.6.3处理质谱数据,基于自建数据库MVDB及代谢信息公共数据库,根据二级谱信息进行物质定性;以MultiaQuant软件进行质谱峰的积分校正;用R中的内置统计prcomp函数,设置prcomp函数参数scale=True,对数据进行unit variance scaling(UV)归一化处理,并对2组样本进行主成分(PCA)分析;利用R中的内置cor函数计算皮尔逊相关系数r,r越接近1,说明2个重复样品相关性越强;正交偏最小二乘判别分析(OPLS-DA)则是先将原数据进行log 2转换后,再进行中心化处理(Mean Centering),利用R中的Metabo-AnalystR包OPLSR.Anal函数进行分析并得到变量重要性投影值(VIP),为了避免过拟合,对其进行200个排列的测试以验证模型准确性;将差异代谢物含量数据采用UV归一化处理后,通过R中的pheatmap包绘制热图,对代谢物在不同样本间的积累模式进行聚类分析(hierarchical cluster analysis,HCA);同时将得到的差异代谢物映射到KEGG Pathway数据库,进行相关通路分析,并通过超几何检验的P值确定其显著性。
2 结果与分析
2.1 核桃内种皮涩味物质的PCA分析
通过对样本进行PCA分析,初步了解组间的整体代谢差异和组内的重复稳定性。PCA结果可以显示样本间代谢组的分离趋势,以此来了解样本间的代谢组差异大小[27]。由图1可知,各组核桃内种皮涩味物质之间分离趋势明显,说明SW和BI品系在代谢水平上有较大的差异。再通过样本间的皮尔逊相关系数r观察到,BI、SW和mix组内的r均大于0.9,说明组内的重复样本相关性极强、重复性好,可以用于后续差异代谢物分析。
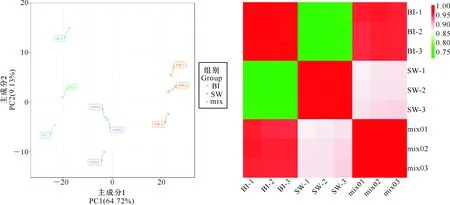
图1 核桃内种皮涩味物质的PCA得分(左)和相关性(右)Fig.1 PCA score(left) and correlation(right)of bitter walnut kernel pellicle
2.2 核桃内种皮涩味物质的OPLS-DA分析
正交偏最小二乘判别分析(OPLS-DA)能够将PCA分析中不相关的差异信息去除,然后筛选差异代谢物。由图2-a可知,BI和SW在PC1主成分上有明显的分离,所建的OPLS-DA模型对X和Y矩阵的解释率分别为0.827(R2X)和1(R2Y),模型的预测能力Q2为0.99,这3个指标越接近于1,表示模型越稳定可靠;Q2>0.9说明此模型为出色的模型,能较好地预测结果。为了避免过拟合,对OPLS-DA模型进行n=200的排列验证,结果(图2-b)显示,经过Y置换后模型的R2Y’和Q2’均小于原始模型的R2Y和Q2,说明模型有意义,可根据变量重要性投影值(VIP)分析筛选差异代谢物。

图b左上角的注释为原始模型的R2X、R2Y和Q2,横坐标为模型Y置换后和原始Y之间的相似性,纵坐标为R2Y和Q2值The annotations in the upper left corner of Figure b are R2X,R2Y and Q2 of the original model,and the abscissa is the similarity between the replacement of model Y and the original Y,and the vertical axis is R2Y and Q2 values图2 核桃内种皮涩味物质的OPLS-DA得分和验证图Fig.2 OPLS-DA score and verification of bitter walnut kernel pellicle
2.3 核桃内种皮涩味的差异代谢物筛选
基于OPLS-DA结果,从获得的多变量分析模型的变量重要性投影值(VIP)初步筛选出不同品种间差异的代谢物。如图3-a所示,越靠近右上角和左下角的代谢物差异越显著,红色为VIP≥1的代谢物。同时结合单变量分析的差异倍数值FC(fold change)来进一步筛选差异代谢物,筛选标准为FC≥2和FC≤0.5。如图3-b所示,从BI和SW 2个品系中共检测出561种代谢物,筛选出12大类263种差异代谢物。为了方便观察代谢物变化规律,将差异代谢物进行归一化处理并绘制热图,结果如图4所示。差异代谢物种类由多到少分别是酚酸类、黄酮、脂质、其他类、鞣质、氨基酸及其衍生物、核苷酸及其衍生物、有机酸、生物碱、萜类、木脂素和香豆素、醌类,其中147种上调,116种下调。再对代谢物的log2(FC)值排序,结果如表1所示。由表1可以看出,上调幅度在前10的差异代谢物分别为:2,4-双-O-二没食子酰基-1,3,6-三-O-没食子酰基-β-D-葡萄糖(2,4-Bis-O-digallic acyl-1,3,6-tri-O-gallic acyl-β-D-glucose)、2,3-O-二没食子酰基-1,4,6-三-O-没食子酰基-β-D-葡萄糖(2,3-O-Digalloyl-1,4,6- tri-O-galloyl-β-D-glucose)、3-O-没食子酰基-1,2,4,6-四-O-没食子酰基-β-D-葡萄糖(3-O-Trigalloyl-1,2,4,6-tetra-O-galloyl-β-D-glucose)、3,4-双二没食子酰基-1,2,6-三-O-没食子酰基-β-D-葡萄糖(3,4-Bisgallic acyl-1,2,6-tri-O-gallic acyl-β-D-glucose)、二-O-没食子酸甲酯(Di-O-galloyl Methyl gallate)、四没食子酸(Tetragallic Acid)、芸香柚皮苷(Isonaringin)、四-O-没食子酸甲酯(Tetra-O-galloyl Methyl gallate)、5-没食子酸(5-Galloylshikimic acid)、松脂醇-己糖(Pinoresinol-Hexose),其log2(FC)值分别为18.05,17.85,17.71,17.52,15.86,14.08,13.41,12.35,12.13,11.55,有8种酚酸类、1种黄酮、1种木脂素和香豆素。

a为OPLS-DA模型的S形图,红点表示代谢物的VIP≥1;b为火山图,红点表示上调的差异代谢物,绿点表示下调的差异代谢物,灰点为差异不显著的代谢物a is the S-plot of OPLS-DA model,and red dots indicate that VIP of metabolite is ≥ 1;b is a volcanic map,red dots represent up-regulated differential metabolites,green dots indicate down-regulated differential metabolites,and gray dots represent metabolites without significant difference图3 核桃内种皮涩味的差异代谢物筛选Fig.3 Screening of differential metabolites of bitterness taste in walnut kernel pellicle
由表1还可以看出,下调幅度在前10的差异代谢物分别为:5-羟基吲哚-3-乙醇(5-Hydroxytryptophol)、丁香酸(Syringic acid)、单酰甘油酯(酰基18∶3)异构(2MAG(18∶3)isomer2)、杨梅素-3-O-半乳糖苷(Myricetin 3-O-galactoside)、24,30-二羟基-12(13)烯羽扇豆醇(24,30-Dihydroxy-12(13)-enolupinol)、皂皮酸(Quillaic acid)、DL-泛酰醇(Pantothenol)、木犀草素-6,8-二-C-葡萄糖苷(Luteolin-6,8-di-C-glucoside)、齐墩果酸-3-O-β-D-吡喃木糖(1→3)-β-D-吡喃葡萄糖醛酸苷(Oleanolic acid-3-O-β-D-pyran xylose(1→3)-β-D-pyran glucuronide)、乙酰色氨酸(Acetyltryptophan),其log2(FC)值分别为-15.88,-13.95,-13.64,-13.39,-13.33,-13.32,-12.79,-12.58,-11.58,-10.72,有2种酚酸类、2种黄酮、2种萜类、1种脂质、1种生物碱、1种糖及糖醇、1种氨基酸及其衍生物。可见上调幅度大的差异代谢物主要为酚酸类和黄酮,而下调幅度大的差异代谢物则种类较多。
2.4 核桃内种皮涩味的差异代谢物通路分析
差异代谢物在生物体内相互作用,可将其在KEGG Pathway数据库中进行注释并富集构建相关代谢途径[28]。如图5所示,SW、BI 2种核桃品系内种皮中263种显著差异的代谢物,共注释到66条代谢通路,其中富集差异代谢物较多且显著的通路分别是类黄酮代谢、甘油酯代谢、糖基磷脂酰肌醇(GPI)锚定生物合成、抗坏血酸和aldarate代谢、苯丙烷类代谢、戊糖和葡萄糖醛酸的相互转化,富集的差异代谢物主要包括黄酮、酚酸类、脂质和有机酸等。
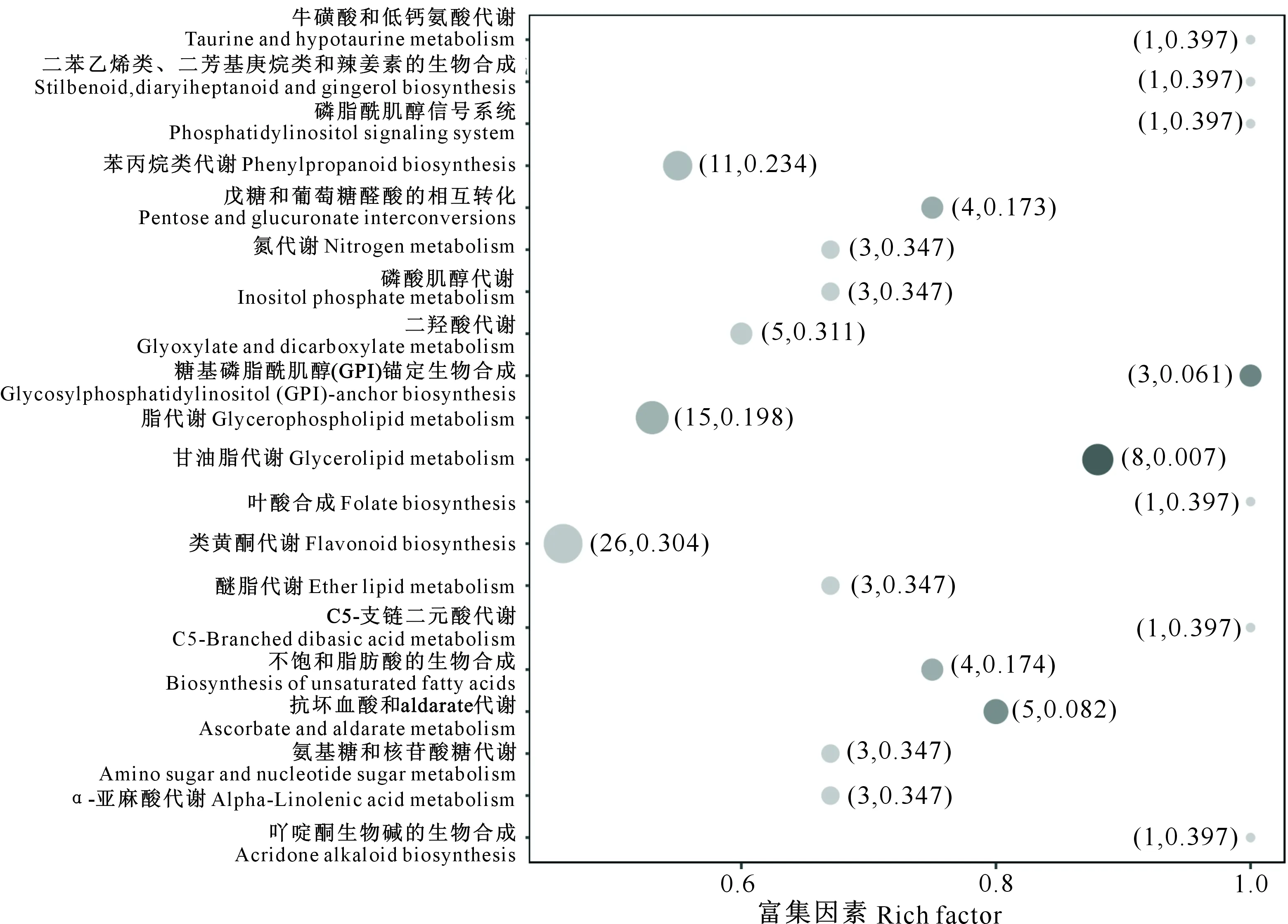
横坐标表示每个通路对应的富集因素,纵坐标为通路名称,括号中前面的数字代表富集的差异代谢物数,后面的数字代表P值,其值越小表示富集越显著 Abscissa represents enrichment factor corresponding to each pathway,the ordinate is pathway name,the number in front of brackets represents the number of enriched differential metabolites,and the number after represents P-value with smaller value indicates more significant enrichment图5 核桃内种皮涩味的差异代谢物KEGG富集结果Fig.5 KEGG enrichment of differential metabolites of bitterness taste in walnut kernel pellicle
在这些通路中,以类黄酮代谢通路富集差异代谢物最多,且黄酮类物质是植物中重要的一类代谢物,种类繁多,KEGG数据库中只包含常见的黄酮类物质,许多修饰类物质数据库中暂时没有。因此本研究通过相关文献查阅,构建了与类黄酮物质相关的代谢途径——柚皮素代谢途径,此代谢途径如图6所示。由图6可见,柚皮素、矢车菊素 3-O-葡萄糖苷、圣草酚、圣草酚 7-O-葡糖苷等检测到的差异代谢物在BI组中显著表达上调,其含量分别是SW组的30.08,17.24,4.17,2.13倍。

▲表示代谢物含量在试验组中显著上调,■表示代谢物含量在试验组中显著下调,●表示代谢物被检测到但未发生显著变化,○表示推测的相关代谢物▲ indicates that metabolite content is significantly up-regulated in experimental group,■ indicates significantly down-regulated.● indicates that metabolite was detected but without significant change, and ○ indicates presumed related metabolite图6 苦涩味核桃内种皮的柚皮素代谢途径Fig.6 Naringenin chalcone biosynthesis in kernel pellicle of bitter walnut
3 结论与讨论
本试验采用代谢组学技术,以具极苦涩味内种皮(BI)和无苦涩味内种皮(SW)核桃无性系为材料,分析两者的代谢物质差异,结果表明,BI和SW组内重复样本的相关系数均在0.90~0.99,重复性极好,且PCA分析中组间代谢物质有明显差异。从2种类型的核桃内种皮中共检测到561种代谢物,包含34小类不同物质,其中差异代谢物有29小类263种,包括147种上调代谢物和116种下调代谢物。在上调差异代谢物中有39种酚酸类(5-没食子酸、四没食子酸、绿原酸、新绿原酸、1-咖啡酰奎宁酸、3-氨基水杨酸等)、34种黄酮(柚皮素查尔酮、槲皮素、柚皮素、芸香柚皮苷、表儿茶素、圣草酚等)、17种脂质(溶血磷脂酰乙醇胺、9,10-二羟基-12-十八酸、溶血磷脂酰胆碱等)、16种鞣质(木麻黄鞣宁、小木麻黄素、水杨梅丁素等)、12种其他类(三叶豆紫檀苷、磷酸葡糖酸、D-葡萄糖醛酸等)、8种氨基酸及其衍生物(谷胱甘肽、L-亮氨酸、L-(+)-赖氨酸等)、7种有机酸((-)-莽草酸、柠檬酸、β-羟基异戊酸等)、6种核苷酸及其衍生物、5种生物碱和3种木脂素和香豆素。大量研究发现,涩味是果实重要的内在品质之一,是由果实内部的单宁类物质以及其他多酚类化合物引起的[29]。而本研究发现,BI组中多酚类物质(酚酸类、黄酮、鞣质)占总上调代谢物的61%,说明多酚类物质是引起核桃内种皮苦涩味的关键代谢物。这与前人的研究结果相似,如胡玲等[30]研究桃李果实风味物质发现,绿原酸、新绿原酸、表儿茶素和槲皮素等酚类物质与果实的苦涩味密切相关。Narukawa等[31]研究绿茶中儿茶素的口感特性发现,儿茶素、表儿茶素、表儿茶素没食子酸酯等黄酮类组分是传递苦涩味的至关重要物质。乜兰春等[32]采用HPLC研究苹果苦涩味与酚类物质含量的关系发现,果皮中的儿茶素、表儿茶素和槲皮素等酚类物质是引起苦味的主要物质。Gagne等[33]研究葡萄酒的苦涩味物质发现,葡萄皮、葡萄籽和葡萄梗中的表儿茶素、表焙儿茶素是形成葡萄单宁的主要前体物质,占总酚类物质的85%以上。本试验的BI组中未检出单宁,但检测到大量单宁前体物质,包括没食子酸、原儿茶酸、绿原酸、肉桂酸、鞣花酸和香草酸等多种酚酸,可能是由于单宁在提取过程中水解成了多元酚酸和单体酚酸[34]。
代谢物是生物体表型的基础,能直观有效地反映生物学过程及其机理[35]。本试验通过KEGG数据库对差异代谢物进行注释,共获得66条代谢通路,其中有6条通路富集的差异代谢物较多且较为显著,分别是类黄酮代谢、甘油酯代谢、糖基磷脂酰肌醇(GPI)锚定生物合成、抗坏血酸和aldarate代谢、苯丙烷类代谢、戊糖和葡萄糖醛酸的相互转化。苯丙烷类代谢是植物体内次生代谢的一条重要途径,代谢途径中会产生多种酚酸类、类黄酮、木质素等物质,为下游次生代谢物质的合成提供原料[36-38]。由莽草酸途径生成的L-苯丙氨酸是此代谢途径的起始物质,在PAL的作用下生成肉桂酸,肉桂酸在C4H作用下生成4-香豆酸,途中产生绿原酸、芥子酸、阿魏酸和咖啡酸等多种酚酸,4-香豆酸在4CL作用下与CoA合成香豆酰CoA,完成苯丙烷类代谢途径;其中苯丙氨酸解氨酶(PAL)是此代谢途径中的关键酶,它与果实中黄酮类物质的合成密切相关[39-41]。由苯丙烷类代谢形成的终产物香豆酰CoA是类黄酮代谢途径的起始底物,它在CHS作用下生成四羟基查尔酮,经过CHI催化作用生成柚皮素,柚皮素是生成类黄酮物质的关键物质,可在黄烷酮3-羧化酶、黄烷酮醇还原酶、无色花色素还原酶的作用下生成儿茶素,还可在无色花色素双加氧酶和花青素还原酶作用下生成表儿茶素。而这2种物质是引起涩味的物质,也是缩合单宁的前体物质[42]。因此,苯丙烷类代谢通路与核桃内种皮苦涩味物质形成密切相关。
类黄酮代谢途径中形成的柚皮素是生成黄酮类化合物的关键初始底物,其在BI组中的含量是SW组的30.08倍,差异极显著。但KEGG数据库中缺少修饰类黄酮物质的信息,无法对柚皮素的下游代谢途径进行注释。本试验通过查阅相关文献[43-46],构建了柚皮素的代谢途径,以柚皮素为底物在不同酶催化下形成柚皮素、圣草酚、槲皮素、花青素、槲皮苷、金圣草素、麦黄酮、圣草酚 7-O-葡糖苷、矢车菊素 3-O-葡萄糖苷等黄酮类化合物,其中柚皮素、圣草酚、圣草酚 7-O-葡糖苷、矢车菊素 3-O-葡萄糖苷上调表达最为显著,这些物质可作为核桃内种皮苦涩味形成的标志物,也可为核桃内种皮的苦涩味改良提供理论依据。

