miR-101、miR-122在妊娠期糖尿病患者血清和胎盘组织中表达及意义
陈丽霞,张秀薇,禤文婷,尹镇钊,陈松锦 (广东省东莞市人民医院内分泌科,广东东莞 523000)
妊娠期糖尿病(GDM)是妊娠期较为常见的并发症,其指妊娠起始或妊娠过程中出现葡萄糖耐量受损。目前对于GDM 发病机制尚不十分明确,既往相关研究指出孕产妇高雌激素水平与其胰岛素抵抗有关,认为胰岛素抵抗是GDM 重要的病理机制[1]。近年来,随着GDM发生机制的研究进展,越来越多的研究证实多种miRNA 直接或间接参与GDM 的生物学行为机制进程,其中miR‑101 可在转录后调节多种基因的表达,与糖脂代谢异常、炎症反应等密切相关[2];而miR‑122 也被证实其参与了胰岛素分泌、糖酵解、脂肪细胞分化等生物学过程的调控[3]。因此,笔者认为两者可能与GDM的发生与进展、胰岛素抵抗、炎症反应、胎盘滋养层细胞的迁移与侵袭等具有一定关联。因此,本研究通过分析GDM 患者血清及胎盘中miR‑101 和miR‑122 的表达水平情况,分析其与胰岛素抵抗的相关性,以明确miR‑101与miR‑122在GDM预测、治疗及预后中的作用及意义。
1 资料和方法
1.1 病例与分组
选取2018年7月至2019年12月在东莞人民医院建档产检并分娩的GDM 孕妇42 例为观察组。纳入标准:(1)符合GDM 诊断标准,即行口服葡萄糖耐量试验显示:空腹血糖≥5.1 mmol/L;1 h血糖≥10.0 mmol/L;2 h 血糖≥8.5 mmol/L,满足任意一项即可诊断为GDM;(2)妊娠>16周;(3)在本院规律产检。排除标准:(1)既往无糖尿病或糖尿病家族史;(2)妊娠期高血压、高血脂、心脏病等其他妊娠合并症;(3)双胎妊娠;(4)全身感染性疾病。本研究已通过本院医学伦理委员会批准,患者及家属知情且签署同意书。并随机选取同期健康孕妇30例作为对照组。
1.2 方法
1.2.1 样本采集 所有孕产妇均于清晨空腹时采集静脉血取血清,−20 ℃冰箱中待检。胎盘组织获取于胎儿与胎盘娩出后,生理盐水洗净,取胎盘中央母体面脐带根部组织5 mm×5 mm×5 mm 大小2~4 块组织物,约重120 mg,静置−80 ℃冰箱中保存。
1.2.2 RNA 提取 采用RNAeasy extraction Kit 试剂提取血清RNA,用Trizol 试剂提取胎盘组织中RNA,同时采用Nanodrop 2 000 紫外可见分光光度计进行两样本中RNA 浓度及纯度检测。所有步骤均按试剂盒说明操作。
1.2.3 miRNA 逆转录 采用miRNA 逆转录及特异性检测试剂盒,引物采用miR‑101 特异性RT‑PCR 引物(Forward:5'‑CATCTTACCGGACAGTGCTGGA‑3',下游为通用引物)检测miR‑101 的表达。采用miR‑122特异性引物(Forward:5'‑TGGAGTGTGACAATG‑GTGTTTG‑3’,下游为通用引物)miR‑122的表达。
1.2.4 荧光实时定量PCR 试剂盒使用TaKaRa 公司,反应参数:95 ℃预变性5 min,95 ℃变性30 s,60 ℃退火30 s,共40 个循环。熔解曲线检测从65 ℃开始,每0.5 ℃检测1 次。miRNA 表达量以2‑ΔCt 表示,其中ΔCt=CtmiRNA–CtU6。
1.3 观察指标
(1)临床参数指标:年龄,身体质量指数(BMI)。(2)胰岛素抵抗相关指标:取血清,采用全自动电化学发光分析仪空腹血糖(FPG)及空腹胰岛素(FINS),胰岛功能采用稳态模型计算HOMA 胰岛素抵抗指数(HOMA‑IR)=(FPG×FINS)/22.5,HOMA 胰岛素分泌指数(HOMA‑IS)=(20×FINS)/FPG‑3.5。(3)两组血清及胎盘中miR‑101与miR‑122表达水平差异。
1.4 统计学处理
采用SPSS 21.0 统计学软件进行数据分析,计量资料以表示,采用t检验;采用Pearson 相关性分析血清miR‑101与miR‑122水平与临床参数和胰岛素抵抗相关指标的相关性。P<0.05 为差异有统计学意义。
2 结果
2.1 临床参数和胰岛素相关指标
观察组孕产妇BMI、FBG、FINS、HOMA‑IS 及HOMA‑IR 指标均高于对照组,差异有统计学意义(P<0.05 或0.01),见表1。
表1 两组临床参数和胰岛素相关指标比较 ()

表1 两组临床参数和胰岛素相关指标比较 ()
与对照组比较:aP<0.05,bP<0.01
2.2 miR‑101 和miR‑122 在两组血清和胎盘组织中表达水平
miR‑101和miR‑122在观察组血清和胎盘组织中表达水平均明显高于对照组(P<0.01),见表2 和图1、2。
图1 miR‑101的qPCR扩增曲线图
表2 miR‑101和miR‑122在两组血清和胎盘组织中表达水平比较 ()

表2 miR‑101和miR‑122在两组血清和胎盘组织中表达水平比较 ()
与对照组比较:aP<0.01
2.3 各项指标与血清miR‑101 及miR‑122 水平的相关性分析
血清miR‑101 水平与FBG 呈正相关,与FINS、HOMA‑IS 呈负相关(P<0.05);miR‑122 水平与FBG、HOMA‑IR 呈正相关,与FINS 呈负相关(P<0.05),见表3。
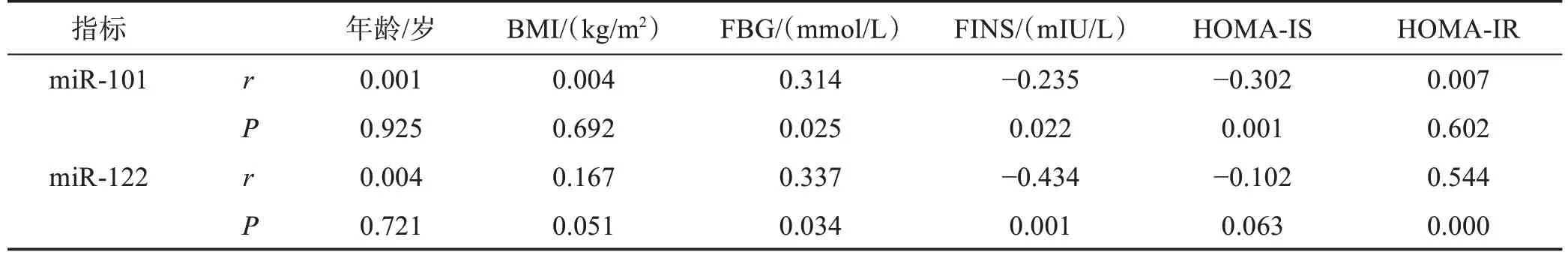
表3 各项指标与血清miR‑101及miR‑122水平的相关性分析
3 讨论
当前,随着孕妇饮食结构及生活方式的改变,GDM 发病率呈逐年上升趋势。GDM 易造成较多种不良妊娠结局,对母婴均有严重危害,甚至长远影响,早期诊断并及时治疗可提高孕妇及胎儿的预后[4]。因此,新的生物学标记物在早期诊断GDM 尤为重要。miRNA 是一类进化过程高度保守的、广泛参与多种疾病的发生与进展的小分子非编码RNA,其在代谢调控和细胞功能中起到“动态调节器”的作用[5]。而近年来miRNA与GDM 的相关研究较为新颖,同时也为本研究提供了理论支持。

图2 miR‑122的qPCR扩增曲线图
本研究结果显示,miR‑101及miR‑122水平在GDM 患者血清及胎盘组织中均呈高表达,提示两者可能直接或间接参与了GDM的发生和发展。有多项研究证实,miR‑101 可通过调控EZH2/H3K27me3 通路参与调控多种疾病的进展,其中在胚胎横纹肌肉瘤、肺癌、膀胱移行细胞癌中,其通过降低EZH2/H3K27me3 表达,从而抑制细胞增殖来影响肿瘤进展[6‑8]。胎盘形成的前提是胎盘滋养细胞对母体子宫内膜的侵入及黏附,而miR‑101 在此过程中可能通过调控EZH2/H3K27me3 通路来影响胎盘滋养细胞的功能,导致胎盘滋养细胞迁移及增殖能力降低,参与GDM 发病[9]。而针对miR‑122 而言,其是前体基因位于18q21.31位点,参与了糖酵解、脂肪细胞分化、胰岛素分泌等代谢相关的生物学过程调控[10‑11]。在胰岛素抵抗细胞模型中,miR‑122 呈高度表达,而通过转染miR‑122 模拟物,AMPK 基因表述水平下调,进而加重胰岛素抵抗程度[12]。另外,胰岛素抵抗水平是胰岛细胞功能的一个重要指标,本研究在GDM 产妇胰岛素抵抗相关指标均比正常产妇的明显增高,且在相关性分析中,GDM 产妇血清miR‑101 水平与FBG 呈正相关,与FINS、HOMA‑IS 呈负相关;miR‑122 水平与HOMA‑IR、FBG 呈正相关,与FINS 呈负相关。说明GDM 产妇在胰岛素分泌状态下,产妇血清miR‑101表达显著下调;而产妇呈胰岛素抵抗状态时,其血清miR‑122 表达显著上调,miR‑122 部分的结果与禤文婷[3]等的研究结果基本一致,但对于miR‑122 作用的靶向信号通路仍需作进一步的研究与探讨。
综上,miR‑101及miR‑122水平在GDM产妇血清及胎盘中均呈高表达状态,其可能直接或间接参与了GDM 的发生和发展。此外,miR‑101 表达与胰岛素分泌指数呈负相关;miR‑122 表达则与胰岛素抵抗指数呈正相关,因此可推断,通过干预miR‑101 及miR‑122 表达,可阻止胰岛细胞功能的抑制或分泌,或可能成为GDM诊断、治疗及预后的新靶点。

