特异标记生血内皮的诱导性多能干细胞系的构建*
洪平山,于 波▲,刘雨婷,刘高科,侯思元,陈捷凯,王金勇,兰 雨△
(1暨南大学基础医学院,广东广州510630;2中国科学院广州生物医药与健康研究院,广东广州510700;3中国人民解放军总医院第五医学中心,北京100071)
造血干细胞(hematopoietic stemcells,HSC)位于成体造血系统的最上游,具有自我更新和分化为各种谱系血液细胞的潜能,HSC的发生发育与血管生血内皮密切相关[1]。HSC起源于胚胎发育中期的定向造血阶段,主要发生于主动脉-性腺-中肾(aorta-go‐nad-mesonephros,AGM)区域的背主动脉腹侧[2-3],这些定位在动脉血管内皮并具有生血潜能的细胞群体就是生血内皮细胞(hemogenic endothelial cells,HEC),HEC经过内皮-造血转化向动脉血管管腔内出芽形成动脉内造血簇,HSC即产生于这些造血簇。由于在胚胎造血发生位点的HEC数量稀少且转瞬即逝,在体内的功能验证也存在技术瓶颈,这些因素增加了精准捕获这群具有HSC重建潜能的HEC的困难。为此,我们前期构建了全新的基因敲入Neurl3-EGFP荧光报告小鼠,实现了对“具有HSC命运的HEC(HSC-primed HEC)”的高效识别与分离[4]。为了更好地利用造血发育理论指导体外造血再生,我们借鉴Takahashi等[5]通过逆转录病毒导入4个经典转录因子的细胞重编程方案,其中选取Oct4、Sox2和Klf43个转录因子驱动已分化的Neurl3-EGFP小鼠胚胎成纤维细胞(mouse embryonic fibroblasts,MEF),简称为NE-MEF,转分化为具有胚胎干细胞(embry‐onic stem cells,ESC)形态与功能的诱导性多能干细胞(induced pluripotent stem cells,iPSC),简称为NEiPSC,通过各项多能性验证,完成了可高效指示造血发育的功能细胞系的构建,为后续的体外定向诱导血液再生提供一种重要的报告工具。
材料和方法
1 实验动物
本课题组利用无特定病原体(specific pathogen free,SPF)级的C57BL/6N品系小鼠(合格证号:111021300011679;购自北京百奥赛图生物技术有限公司),通过CRISPR/Cas9技术介导的基因敲入策略构建的全新报告基因Neurl3-EGFP小鼠,毛发纯黑色,8~10周龄,体重在18~20 g之间,取3只雌鼠与1只雄鼠合笼并做好标记。由于其可在生血内皮细胞与造血干/祖细胞阶段特异性启动EGFP高表达,故适用于特异性,标记造血发育中内皮-生血转化等重要事件。
2 主要试剂和材料
质粒(pMXs-Oct4,pMXs-Sox2和pMXs-Klf4)购自Addgene;Plat-E细胞购自Cell Biolabs;转染试剂Lipo6000和BCIP/NBT碱性磷酸酯酶显色试剂盒购自上海碧云天生物技术有限公司;Anti-NANOGanti‐body购自Bethyl;Anti-OCT3/4山羊抗兔IgG购自San‐ta Cruz;Alexa Fluor 568标记的山羊抗兔IgG和Al‐exa Fluor488山羊抗兔IgG和驴抗小鼠IgG购自Ab‐cam;Trizol Reagent购自Invitrogen;ReverTra Ace qP‐CR RT Master Mix with gDNA Remover购自TOYO‐BO;Hieff qPCR SYBR Green Master Mix购自上海翊圣生物技术有限公司;TIANamp Genomic DNA Kit购自北京天根公司;胎牛血清(fetal bovine serum,FBS)、高糖DMEM培养基、N-2添加剂(N-2)、B-27添加剂(B-27)、Trypsin-EDTA(0.05%和0.25%)、双抗(1×105U/L青霉素+100 mg/L链霉素)、非必需氨基酸(non-essential amino acid,NEAA)、丙酮酸钠、L-谷氨酰胺(1%GlutaMAX)、β-巯基乙醇、重组人碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)和DPBS均购自Gibco;DAPI、polybrene、维生素C和氯化锂均购自Sigma-Aldrich;白血病抑制因子(leuke‐mia inhibitory factor,LIF)购自Millipore;CHIR99021和PD0325901购自Selleck。
3 主要方法
3.1 细胞培养液 Plat-E细胞培养液:高糖DMEM培养基/10%FBS。MEF细胞培养液:高糖DMEM培养基/10%FBS,含1%NEAA与1%双抗。iCD1无血清培养液:高糖DMEM培养基/N-2(0.5×)/B-27(0.5×)混合,添加双抗、1%GlutaMAX、1%丙酮酸钠、1%NEAA、100µmol/Lβ巯基乙醇、50 mg/L维生素C、10µg/L bFGF、5 mmol/L氯化锂、1×106U/L LIF、CHIR99021(GSK3β抑制剂,2 000×)和PD0325901(MEK抑制剂,2 000×),此培养液可提高重编程效率。小鼠多能干细胞维持培养液:含15%FBS的高糖DMEM培养基,加入双抗、1%GlutaMAX、1%丙酮酸钠、1%NEAA、100µmol/Lβ-巯基乙醇1×106U/L LIF、CHIR99021(2 000×)和PD0325901(2 000×)。
3.2NE-MEF的分离与培养 性成熟雌鼠与雄鼠合笼后,次日上午观察雌鼠阴道口有乳白色胶冻状阴道栓即可确定受孕,记为胚胎第0.5天;在胚胎第12.5~15.5天将孕鼠脱臼安乐死后浸泡于75%乙醇中消毒20 min,在无菌条件下剖腹取出妊娠子宫,剪开宫腔夹出妊娠囊,去除胚胎头部、四肢和内脏,仅留取躯干部分,PBS洗3次;转至无菌不锈钢筛网中用0.25%Trypsin-EDTA浸泡,用灭菌注射器内芯研磨成细胞悬液转入离心管;室温下消化5 min后加入3倍体积培养液终止消化。以1个胚胎对应1个T75培养瓶的比例进行原代细胞培养,置于37℃,5%CO2培养箱培养,次天更换新鲜培养液,传代后即为P1代。
3.3NE-MEF重编程为NE-iPSC 待10 cm培养皿中Plat-E细胞覆盖约90%即用0.25%胰酶消化并计数,按每个10 cm培养皿接种8×106个细胞量的比例将其分盘,每盘对应转染pMXs-Oct4/Sox2/Klf4各个质粒,次日即可转染质粒;按试剂盒说明书将含有相应体积质粒的750µL Opti-MEM培养基与含有30µL脂质体Lipo6000的Opti-MEM培养基750µL相混合,室温静置5 min后转入含Plat-E细胞的培养皿;转染后6 h更换新鲜培养液;36 h后第1次收取病毒上清液,过滤备用;隔24 h第2次收上清;提前两天将NE-MEF复苏接种于6 cm培养皿,待其80%融合即可消化计数,以每孔2×104的细胞量接种于包被0.1%gelatin的12孔板;将病毒上清液与基础培养液按1∶1比例混合,添加polybrene(1 000×)后感染NEMEF;24 h后重复第2次感染;隔18 h换成iCD1无血清培养液启动重编程;24 h后换液即为Day1,一般Day6前后可见iPSC克隆,用玻璃管针挑出克隆接种至已铺好饲养层细胞的24孔板中,换成小鼠多能干细胞维持培养液;隔日可将已贴壁的克隆消化成单细胞传至12孔板。
3.4NE-iPSC的鉴定
3.4.1 BCIP/NBT碱性磷酸酯酶显色 使用4%多聚甲醛将NE-iPSC原盘细胞固定30 min,PBS洗3次,每次5 min,取3.3µL BCIP与6.7µL NBT加入1 mL AP底物溶液,混匀后转入6孔板培养皿的1个孔中,室温避光染色30 min,ddH2O洗两次终止染色反应,拍照记录。
3.4.2NE-iPSC多能性基因表达水平的分析 消化收集NE-iPSC后用Trizol Reagent裂解法提取RNA并检测RNA浓度与纯度。使用ReverTra Ace qPCR RT Master Mix with gDNA Remover试剂盒将RNA反转录为cDNA。cDNA稀释后用Hieff qPCR SYBR Green Master Mix试剂盒进行RT-qPCR。同时设置NE-MEF和小鼠ESC作为对照,管家基因Gapdh作为内参照,每次均进行不少于3次的独立分析验证。数据经2−ΔΔCt法计算相对基因表达水平。RT-qPCR程序:95℃预变性3 min;95℃变性10 s,60 s退火30 s,72℃延伸20 s,40个循环。所用引物序列见表1。
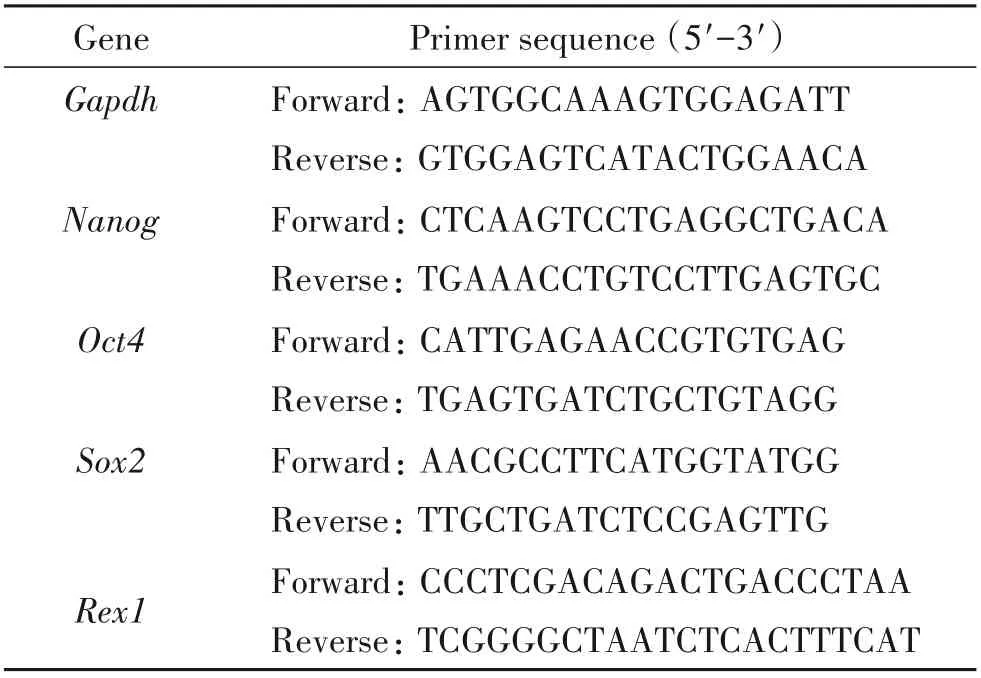
表1 RT-qPCR所用引物序列Table 1.Sequences of the primers for RT-qPCR
3.4.3 移植NE-iPSC产生畸胎瘤 消化收集NEiPSC后用PBS洗1遍,4℃、250×g离心5 min,计数,用含2%FBS的DPBS重悬细胞,在小鼠腹部与大腿连接处作皮下注射,每个部位的移植细胞量为(1~2)×106,1个月后可观察到肿瘤包块生长,颈椎脱臼处死小鼠后分离出完整肿瘤,DPBS洗1遍,4%多聚甲醛固定,石蜡包埋切片,HE染色后观察来自三个胚层的不同组织细胞的病理变化并记录。
3.4.4 核型鉴定 待无饲养层细胞的NE-iPSC生长密度达80%,更换新鲜培养液,加秋水仙素使终浓度达0.2 mg/L,置于37℃培养箱60 min;吸弃培养液用DPBS清洗,0.25%胰酶消化收集细胞,250×g离心5 min;加37℃预热的0.075 mol/L氯化钾溶液7 mL重悬,37℃水浴20 min;用固定液(甲醇与冰醋酸按3∶1配制)预固定3 min,150×g离心5 min后弃上清,加7 mL固定液37℃水浴40 min;150×g离心5 min,保留适量固定液重悬细胞;在预冷的载玻片上滴片,转入75℃烘箱烘3 h;0.05%胰酶消化8 s后转入生理盐水终止消化;用Giemsa染液染色10 min,用水轻轻冲洗后晾干,油镜下观察分裂相。
3.4.5 免疫荧光染色 将NE-iPSC种到已包被0.1%gelatin并铺有小圆盖玻片的6孔板内,待克隆长到合适大小即吸弃培养液,DPBS洗2遍,加4%多聚甲醛1 mL室温固定30 min;DPBS洗2次,加入1 mL封闭通透液(3%BSA与0.2%Triton X-100按1∶1混合),室温静置1 h;DPBS清洗3次,按抗体最佳使用浓度用3%BSA稀释各种Ⅰ抗,夹出圆玻片,细胞面朝上,用巴氏滴管轻轻滴加适量Ⅰ抗,4℃孵育过夜;玻片放回培养皿用DPBS洗4遍,按照类似Ⅰ抗的步骤染Ⅱ抗,室温下避光孵育1 h;DPBS洗5次,DAPI染色孵育1 min,DPBS洗3次;在载玻片上滴加5µL抗荧光猝灭封片液,玻片细胞面朝下轻轻压下完成封片,镜下观察荧光并记录。
3.4.6NE-iPSC拟胚体形成实验与测序比对验证
将25µL细胞悬液滴于培养皿盖的内侧,培养皿悬滴法培养2.5 d,收集后在镜下观察拟胚体形态并记录;应用TIANamp Genomic DNA Kit试剂盒提取NEiPSC基因组,对PCR扩增所得序列进行测序并与EGFP基因序列相比对。PCR所用引物序列见表2。

表2 PCR扩增EGFP基因所用引物序列Table 2.Sequences of the primers of EGFP gene used in PCR amplification
4 统计学处理
采用GraphPad Prism 8.0.1统计软件对实验数据进行统计学分析,数据均采用均数±标准差(mean±SD)表示,组间比较采用t检验。以P<0.05为差异有统计学意义。
结 果
1 NE-MEF的分离与培养
Neurl3-EGFP荧光报告小鼠在胚胎第12.5~15.5天,安乐死孕鼠后取出胚胎,分离并培养胚胎成纤维细胞,选取代数在P3以内的成纤维细胞通过共感染三因子启动重编程,结合iCD1高效诱导体系确立NE-iPSC重编程方案。实验流程示意图见图1。

Figure 1.Schematic representation of NE-iPSCgeneration protocol.图1 NE-iPSC重编程示意图
2 NE-MEF重编程为NE-iPSC
感染逆转录病毒前NE-MEF在镜下呈长梭型网状交织,经2 d的病毒感染后换为iCD1去血清培养液,感染后第3天左右即可观察到NE-MEF逐渐呈向心性汇聚成团,第6天左右在镜下可见鸟巢样NE-iP‐SC克隆,克隆轮廓清楚,克隆内细胞间结合紧密,细胞核偏大。挑取单个克隆接种于饲养层细胞上很快贴壁,2~3 d后克隆增大,形态圆且边缘整齐,类似小鼠ESC,亮度稍高。将单个克隆消化成单细胞传代于饲养层细胞上,3 d左右即可形成较多稍隆起的大小均匀的类圆形细胞克隆。见图2。
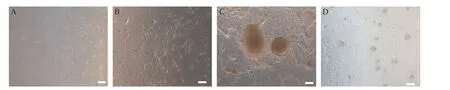
Figure 2.Reprogramming process of NE-MEF.The scale bar=200µm.A:the morphology of NE-MEFs before infection;B:day 3 after infection,the morphology of NE-MEFs were dramatically changed in iCD1 medium;C:day 6 after infection,NEMEFs formed ESC-like colonies;D:cultured day 2 on the feeder,single NE-iPSC clone was trypsinized into single-cell suspensions and replanted into fresh feeder.图2 NE-MEF的重编程过程
3 NE-iPSC细胞系的多能性检测
经重编程诱导产生的NE-iPSC具有典型的胚胎干细胞形态,呈碱性磷酸酶(alkaline phosphatase,AP)染色阳性,见图3。RT-qPCR结果说明NE-MEF来源的NE-iPSC克隆表达的多能性基因与ESC相当,包括Oct4、Sox2、Nanog和Rex1;多能性基因的表达水平较未重编程的NE-MEF明显增高(P<0.01),见图4。将NE-iPSC移植到重度联合免疫缺陷(se‐vere combined immunodeficiency,SCID)小鼠体内进行多能性验证,历时一个月可在注射部位观察到较大体积的畸胎瘤,取出肿瘤组织经固定、包埋、切片及HE染色,在光镜下观察到三个胚层来源的不同组织细胞,其中以腺体样细胞、肠腔黏膜上皮细胞、肌细胞与神经细胞等较为典型,见图5,在同期移植了ESC的对照小鼠也观察到同样的现象。核型鉴定结果表明,NE-iPSC克隆具有正常的20对染色体,见图6,基本排除重编程过程产生的核型异常。免疫荧光染色实验结果显示Nanog和Oct4表达增加,见图7。NE-iPSC悬滴法培养2.5 d即可演绎为拟胚体,克隆直径在150~300µm之间,呈类圆形,边缘整齐光滑,见图8,与同期悬滴培养的ESC表现基本一致。
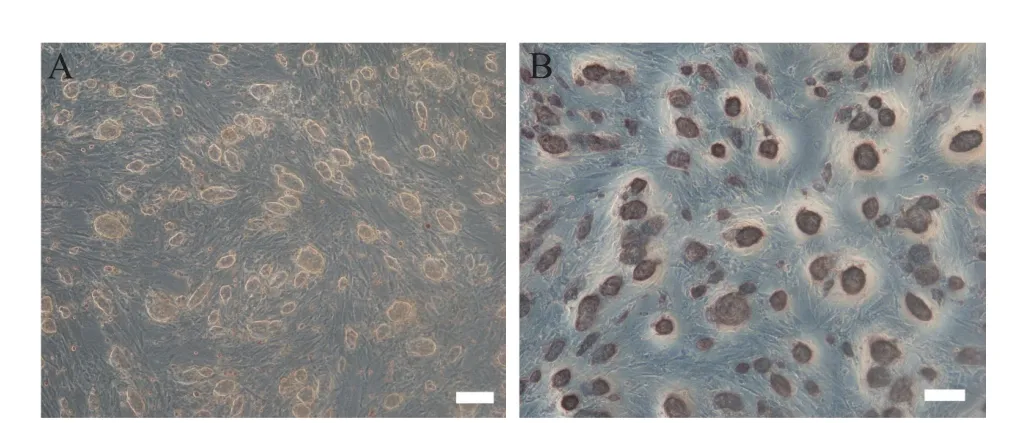
Figure 3.Morphological change of established NE-iPSCs and alka‐line phosphatase(AP)staining(scale bar=200µm).A:phase micrographs of NE-iPSCs were shown,which were morphologically indistinguishable from ESC;B:NE-iPSCsexpressed APpositive as well as ESC.图3 NE-iPSC呈碱性磷酸酶染色阳性
4 EGFP的测序验证
对NE-iPSC基因组DNA的PCR扩增序列进行测序,与EGFP片段进行比对,显示其序列完全一致,见图9,与Neurl3-EGFP荧光报告小鼠的打靶策略示意图相符,见图10,证实NE-iPSC的Neurl3-EGFP在重编程过程中碱基序列并未发生突变。
讨 论
特异识别生血内皮的标志基因对于造血发育与再生的研究具有重大意义,不仅可以明确不同细胞谱系的来源,而且可以提高体外定向诱导产生造血干/祖细胞的效率。近几年,关于生血内皮标志基因的研究层出不穷。Swiers等[6]用Runx1 23GFP+报告基因标识内皮细胞,但未能诱导产生具有造血和内皮双潜能的细胞群;Robin团队通过转基因报告小鼠Gfi1-Tomato揭示内皮-造血转化事件,却因为HEC与非HEC在转录组水平高度相似,入选的细胞群体被认为不具有典型代表性[7]。为了筛选特异性更强的内皮标志基因,结合此前在人胚胎造血干祖细胞发育过程中密切相关的生血内皮细胞表面标志的发现[8],通过单细胞转录组学测序非偏颇地鉴定HSCprimed生血内皮细胞,选取在HSC-primed HEC特异标记基因中表达最显著的Neurl3,利用CRISPR-Cas9技术构建Neurl3-EGFP基因敲入荧光报告小鼠[4],基因打靶策略示意图见图10。
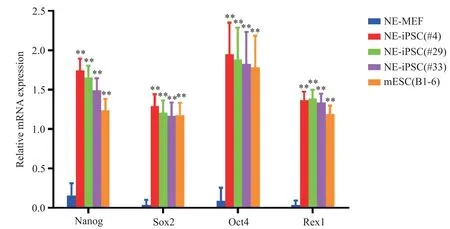
Figure 4.RT-qPCR was used to analysis the expression of pluripotent genes in NE-iPSC.mESC:mouse embryonic stem cells.The expression of pluripotent markers in NE-iPSCwas significantly increased compared with NE-MEF(control).Mean±SD.n=3.**P<0.01 vs NE-MEFgroup.图4 RT-qPCR对NE-iPSC克隆多能性基因的表达分析
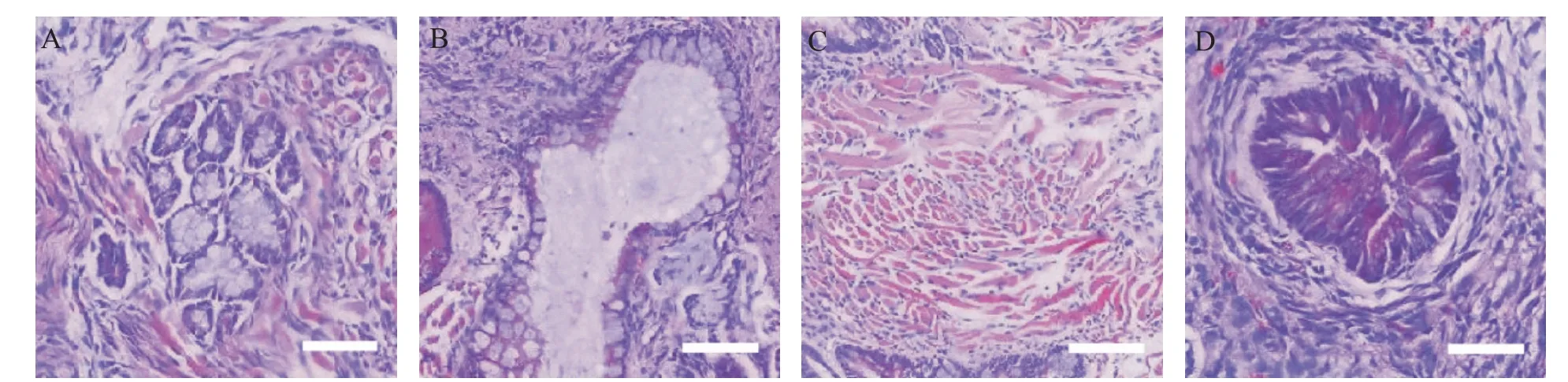
Figure 5.Paraffin sections of teratoma formed by NE-iPSC(HE staining).The scale bar=100µm.A:glandular cells;B:gut-like epithelium;C:muscle cells;D:neural cells.图5 移植NE-iPSC可形成畸胎瘤
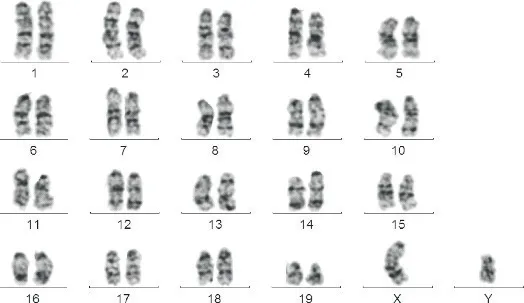
Figure 6.Karyotype identification for NE-iPSC.图6 核型鉴定
在此之前,Neurl3并未在血液领域有相关的研究报道。在小鼠胚胎造血发育过程中,仅有主动脉内皮层特异表达Neurl3,这些表达Neurl3的细胞几乎都共表达Runx1与CD44,虽然在胚胎第10天的主动脉下间质也有部分细胞表达Runx1,但是Neurl3仅在主动脉内皮层与Runx1共表达[4]。由此可对位于AGM区主动脉腹侧的HEC和非HEC进行甄别。可见,Neurl3-EGFP不仅可以精确定位HEC,而且可以高效富集HSC-primed HEC。
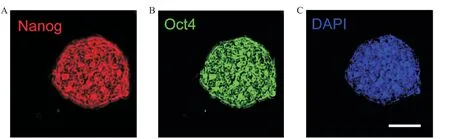
Figure 7.Results of immunofluorescence staining for NE-iPSC.The scale bar=100µm.A:red-Nanog stood for cell nucleus in NE-iPSC;B:green-Oct4 stood for cell nucleus in NE-iPSC;C:blue-DAPIstood for cell nucleus in NE-iPSC.图7 NE-iPSC免疫荧光染色
由于临床治疗和生物医药工程等领域对血液细胞,尤其是HSC的需求日益增加。学者们不断对体外血液再生提出改良方案,包括了用人ESC来源的HEC移植到小鼠体内使其分化为造血干祖细胞[9],以及直接将小鼠成体血管内皮细胞诱导为HSC[10]。这些诱导策略都基于对造血发育事件的正确认识[11],但是存在着诱导效率与可重复性等问题。为了建立更高效的诱导体系,Guo等[12]用双因子驱动多能干细胞实现了造血祖细胞的转化,但该体系在诱导产生造血祖细胞效率方面仍有待提高。在本研究中,我们把Neurl3-EGFP报告基因小鼠体细胞重编程为NE-iPSC并进行多能性验证。NE-iPSC作为体外诱导分化体系的起始细胞,Neurl3的引入可在体外再生造血干祖细胞过程中实现对HSC-primed HEC的实时监测,在提高造血干祖细胞再生效率的同时,也有助于指导体外诱导体系的进一步优化。
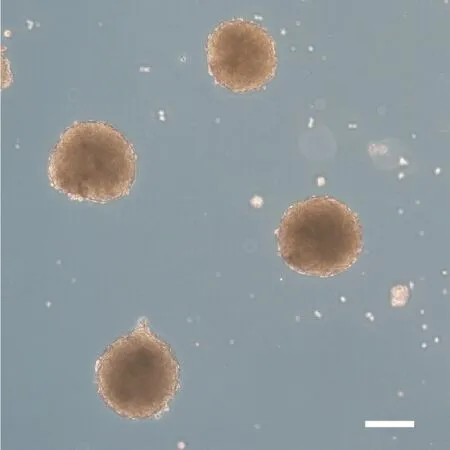
Figure 8.Embryoid body of NE-iPSC.The scale bar=100µm.图8 NE-iPSC拟胚体形成实验
由于ESC细胞系的构建存在一定技术瓶颈,而且iPSC重编程技术相对成熟且高效,同时规避了免疫排斥与道德伦理等问题[13],故确定构建NE-iPSC。考虑到Yamanaka经典四因子的c-Myc是癌基因,四因子重编程方案可能出现阻碍重编程进度的中间状态pre-iPSC[14]。同时,过表达c-Myc可能引起细胞癌变,细胞生长速度过快容易造成密度过大,在早期可因接触性抑制影响重编程的进度[15]。本研究利用iCD1去血清培养液[16],高效重编程得到在形态、多能性和稳定性等方面均不亚于ESC的NE-iPSC。NEiPSC作为精准识别HSC-primed HEC强特异性的生物学工具,在未来的单克隆、无损、高通量的体外诱导体系的评估中具有广阔的应用前景,有望为人类临床治疗级别的造血干祖细胞在体外高产量再生提供技术参考。
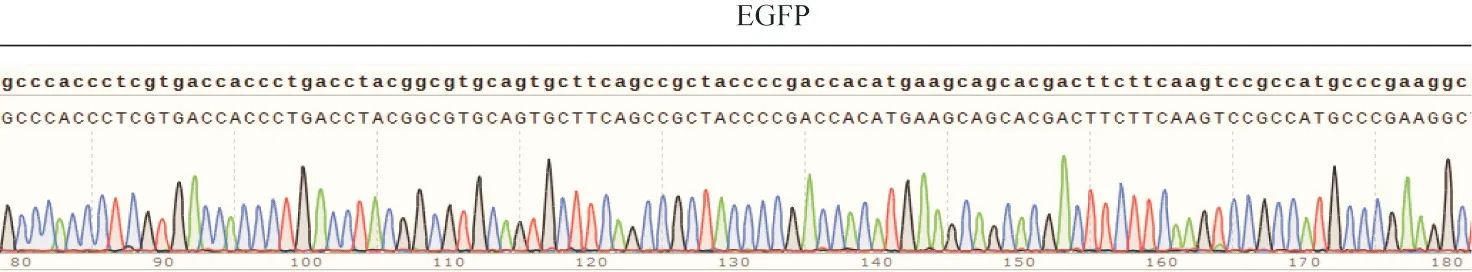
Figure 9.NE-iPSCDNA sequencing of EGFP and comparison analysis.图9 比对NE-iPSC EGFP序列的测序结果
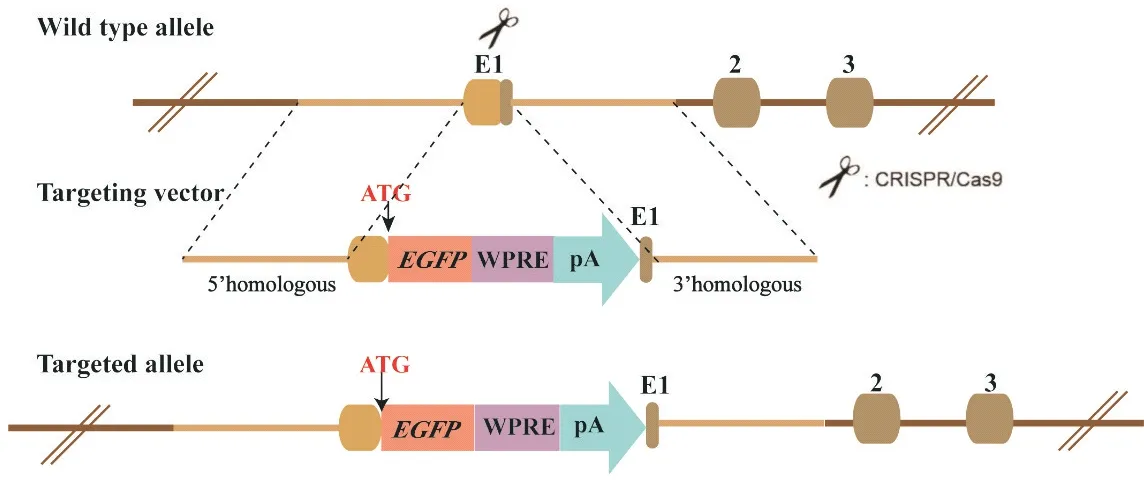
Figure 10.Schematic image of targeting strategy.图10 Neurl3-EGFP基因敲入小鼠打靶策略模式图

