联合用药对湿疹的疗效观察
张 伟,杜军波
(1浚县人民医院,河南 鹤壁456250;2濮阳市安阳地区医院,河南 安阳 455000)
湿疹是由多种因素引发的一种具有显著渗出倾向的炎性皮肤病,在疾病急性期常以丘疱疹为主,慢性期以苔藓样变为特点。湿疹是一种迟发性变态反应,外部因素包括吸入物、食物、生活环境、各种化学物质;内在因素包括内分泌及代谢异常变化、血液循环障碍、慢性感染病灶、遗传等因素[1]。目前治疗该疾病常用药物涂抹治疗,丁酸氢化可的松乳膏是一种糖皮质激素类药物,可抑制局部炎症反应,减轻临床症状,但单独使用皮损程度仍较高;透明质酸凝胶可提高皮损部位的水吸收能力,生成保护膜,有助于皮肤黏膜修复[2]。本文旨在观察丁酸氢化可的松乳膏联合透明质酸凝胶对湿疹患儿的疗效。现报道如下。
1 资料与方法
1.1 一般资料 选取我院2018年7月—2020年7月收治的105例小儿湿疹患儿,根据随机数字表法分为对照组和观察组。对照组52例,男28例,女24例;年龄2个月~2岁,平均(1.09±0.05)岁;病程2~30 d,平均(16.01±5.48)d;发病部位:全身10例,手足22例,四肢20例。观察组53例,男27例,女26例;年龄3个月~2岁,平均(1.13±0.08)岁;病程2~29 d,平均(15.50±5.50)d;发病部位:全身12例,手足23例,四肢18例。两组患儿一般资料比较,差异无统计学意义(P>0.05)。本研究经医院伦理委员会批准。
纳入标准:所有患儿均符合湿疹诊断标准[3],皮肤患处呈暗红色并伴有色素沉着,皮损面积小于体表面积的15%;所有患儿及家属知情并签订知情同意书。排除标准:合并心肝肾功能不全、自身免疫性疾病;伴有真菌、病毒感;湿疹分布于眼周、唇周、肛周者;近期接受过抗阻药物治疗;对本研究药物过敏者。
1.2 方法 对照组给予丁酸氢化可的松乳膏(生产厂家:天津金耀药业有限公司,国药准字:H1094005)均匀涂抹于皮肤患处,2次/d。观察组在此基础上给予透明质酸凝胶(生产厂家:南京天纵益康生物科技有限公司,国药准字:苏械注准20172641818)涂抹于患处并轻柔按摩,3次/d。两组患儿均持续治疗两个月。
1.3 观察指标(1)瘙痒程度及皮损程度:治疗前后采用Dirk Kuypers法评估患儿瘙痒程度,包含瘙痒范围、瘙痒程度、发作频率、睡眠干扰4个方面,总分为26分,分数越高表示瘙痒程度越严重。采用湿疹面积及严重度指数(EASI)评估,EASI=体征指标评分×受累面积评分。湿疹严重程度包含浸润、肥厚、苔藓化、红斑等体征,分为无、轻度、中度、重度(0~3分);受累面积无为0分,面积小于5%为1分,面积5%~10%为2分;EASI评分越高表示皮损程度越严重。(2)炎症因子水平:治疗前后抽取患儿空腹静脉血,采用酶联免疫吸附法检测白细胞介素-2(IL-2)、白细胞介素-18(IL-18)、γ-干扰素(IFN-γ)水平。(3)皮肤生理功能:治疗前后采用英国Biox公司生产的AF200型皮肤水分流失测定仪检测经表皮水分流失(TEWL);选用CM825-MDD皮肤水分测试仪检测角质层含水量(WCSC),采用德国CK公司生产的SM815-MPA型皮肤油脂测试仪检测皮肤油脂(SC)。(4)临床疗效:根据EASI评分进行评估,痊愈为EASI评分改善程度>90%;显效为EASI评分改善程度60%~90%;有效为20%≤EASI改善程度<60%;无效为EASI改善程度<20%。总有效率=(痊愈+显效+有效)/总例数×100%。(5)不良反应:观察并记录两组患儿发生患处疼痛、局部皮肤萎缩、内分泌紊乱不良反应的发生率。
1.4 统计学处理 采用SSPS 20.0统计软件,计数资料用n(%)表示,采用用χ2检验;计量资料用±s表示,采用t检验。以P<0.05表示有统计学意义。
2 结果
2.1 两组患儿治疗前后炎症因子水平比较 治疗前,两组患儿IL-2、IL-18、IFN-γ水平比较,差异无统计学意义(P>0.05);治疗后观察组IL-2、IL-18、IFN-γ低于对照组,差异有统计学意义(P<0.05)。见表1。
2.2两组患儿治疗前后皮肤生理功能比较 治疗前两组患儿TEWL、WCSC及SC比较,差异无统计学意义(P>0.05);治疗后观察组TEWL低于对照组,WCSC、SC高于对照组,差异有统计学意义(P<0.05)。见表2。
2.3 两组瘙痒程度及皮损程度比较 治疗前,两组患儿瘙痒程度及EASI评分比较,差异无统计学意义(P>0.05);治疗后,观察组患儿瘙痒程度及EASI评分低于对照组,差异有统计学意义(P<0.05)。见表3。
2.4两组患儿临床疗效比较 治疗后观察组痊愈26例,显效16例,有效8例,无效3例;对照组痊愈9例,显效20例,有效12例,无效11例。两组比较,差异有统计学意义(P<0.05)。
2.5 两组患儿不良反应发生情况比较 观察组52例,发生患处疼痛2例,不良反应发生率为3.77%;对照组53例,发生患处疼痛4例,局部皮肤萎缩3例,内分泌紊乱1例,不良反应发生率为15.38%。两组比较,差异有统计学意义(P<0.05)。
表1两组患儿治疗前后炎症因子水平比较(±s,ng/mL)
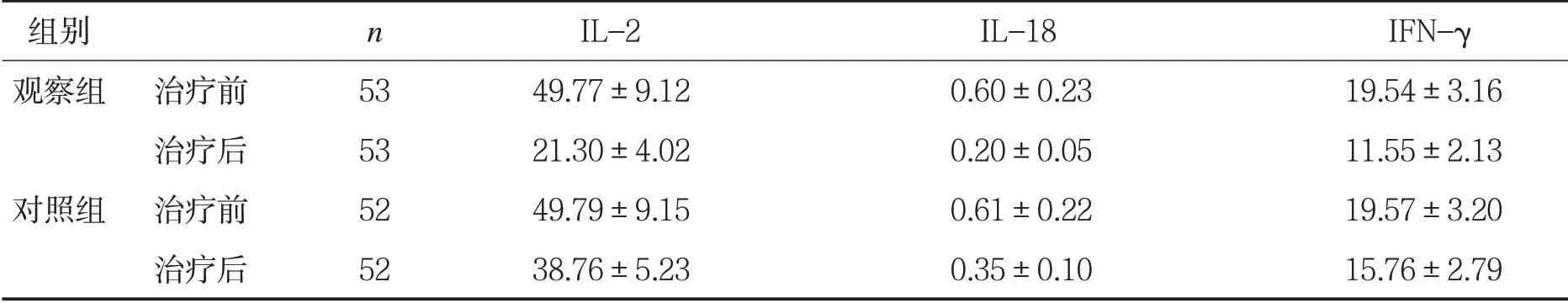
表1两组患儿治疗前后炎症因子水平比较(±s,ng/mL)
组别 n IL-2 IL-18 IFN-γ观察组 治疗前 53 49.77±9.12 0.60±0.23 19.54±3.16治疗后 53 21.30±4.02 0.20±0.05 11.55±2.13对照组 治疗前 52 49.79±9.15 0.61±0.22 19.57±3.20治疗后 52 38.76±5.23 0.35±0.10 15.76±2.79
表2两组患儿治疗前后皮肤生理功能比较(±s)
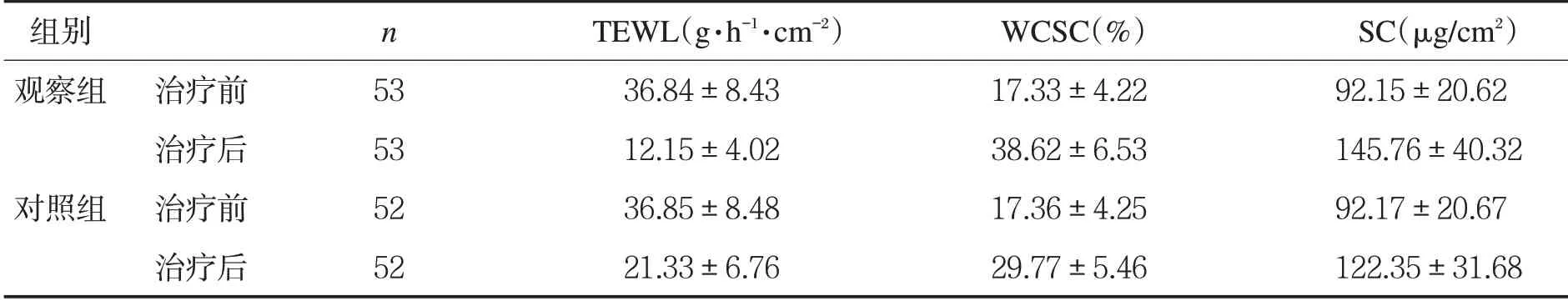
表2两组患儿治疗前后皮肤生理功能比较(±s)
组别 n TEWL(g·h-1·cm-2) WCSC(%) SC(μg/cm2)观察组 治疗前 53 36.84±8.43 17.33±4.22 92.15±20.62治疗后 53 12.15±4.02 38.62±6.53 145.76±40.32对照组 治疗前 52 36.85±8.48 17.36±4.25 92.17±20.67治疗后 52 21.33±6.76 29.77±5.46 122.35±31.68
表3两组治疗前后皮损程度比较(±s,分)
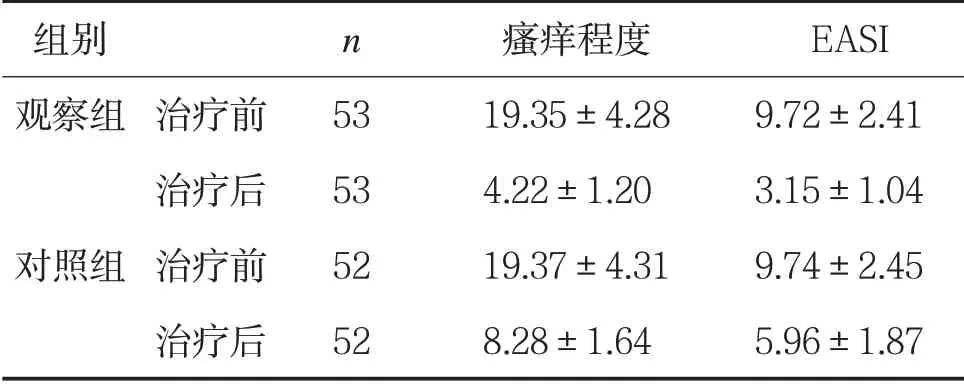
表3两组治疗前后皮损程度比较(±s,分)
组别 n 瘙痒程度 EASI观察组 治疗前 53 19.35±4.28 9.72±2.41治疗后 53 4.22±1.20 3.15±1.04对照组 治疗前 52 19.37±4.31 9.74±2.45治疗后 52 8.28±1.64 5.96±1.87
3 讨论
小儿皮疹常发生于面颊、额部、眉间及头部,还可累及至四肢和躯干,甚至全身出现;由于小儿心智发育尚不完全,病情反复发作、迁延不愈,易出现抓破湿疹表皮等情况,如无法得到有效治疗,皮肤患处可能会发生感染、糜烂,进而严重影响患儿生长发育。丁酸氢化可的松乳膏是以氢化可的松为主要母体,对甾体母核无干扰,对其结构内的极性基团加以掩盖,亲脂性增加,提升药物成分透皮吸收能力,有助于皮肤患处抗炎活性的增强,进而发挥抗炎、止痒、减少渗出的作用,其治疗小儿湿疹见效快,但长时间使用可出现减少表皮角质细胞层、脂质双子层结构被破坏、皮肤发生萎缩等现象,使角质层糜蛋白酶大量生成,角化桥粒细胞崩解,从而导致皮肤屏障功能和皮肤角质层完整性受损,并出现毛细血管扩张、色素沉着、患处疼痛等不良反应[5]。
本研究显示,观察组瘙痒程度、EASI、IL-2、IL-18、IFN-γ、TEWL、WCSC、SC均优于对照组,提示经丁酸氢化可的松乳膏和透明质酸凝胶联合治疗,可有效降低患儿皮损程度和炎症反应,改善皮肤生理功能。透明质酸凝胶包含大分子透明质酸和小分子透明质酸成分,大分子透明质酸具有较强的交联作用,可在皮损部位生成一层保护性屏障,充分保留水分,并减低病毒、紫外线等物质的浸润和损伤,进而提高皮肤黏膜修复能力;小分子透明质酸成分可顺利渗透至皮肤黏膜下层,促进皮损部位新生血管扩张,提高血氧和血流灌注,有助于毒素的代谢和营养物质的吸收,进而提高角质细胞的新生,减低患儿皮损程度[6]。TEWL是反映皮肤表面水分子蒸发量,评估皮肤功能障碍的重要指标;皮肤含水量下降、经皮肤水分丢失增加和SC减低是皮肤功能衰退的重要指标,同时也是小儿湿疹病情变化和发病环节的主要指标。透明质酸凝胶通过在皮损患处形成保护膜,可恢复皮肤黏膜屏障功能,使皮肤的耐受性提高,抵御外部过敏源和细菌对局部的损害,进而降低患儿皮肤水分的丢失和改善皮肤生理功能[7]。本结果显示,观察组总有效率高于对照组,经丁酸氢化可的松乳膏联合透明质酸凝胶涂抹于患处,可调节蛋白活性和胶原蛋白的合成,更好发挥保水作用同时减少油脂的分泌,使皮损程度得以改善,降低皮肤萎缩、内分泌紊乱等不良反应,提高临床疗效[8]。
综上所述,丁酸氢化可的松乳膏联合透明质酸凝胶对湿疹患儿治疗,可显著降低炎症因子水平、皮损程度及不良反应发生率,提高皮肤生理功能,提高临床疗效,安全性高。

