低共熔溶剂在生物转化中的应用*
王艳玲,陈小燕,余 强,张庆华,王忠铭,袁振宏
低共熔溶剂在生物转化中的应用*
王艳玲1,2,3,4,陈小燕2,3,4,余 强2,3,4†,张庆华1†,王忠铭2,3,4,袁振宏2,3,4
(1. 江西农业大学 生物科学与工程学院,江西省农业微生物资源开发与利用工程实验室,南昌 330045;2. 中国科学院广州能源研究所,广州 510640;3. 中国科学院可再生能源重点实验室,广州 510640;4. 广东省新能源和可再生能源研究开发与应用重点实验室,广州 510640)
低共熔溶剂(DES)已被证明是传统有机溶剂以及离子液体的良好替代溶剂,具有低熔点、低挥发性、合成简单、易回收、成本低等特点。本文介绍了DES的生物毒性和生物降解性,综述了DES在生物催化和微生物转化方面的研究进展,简单讨论了DES在酶促反应中的作用机理,为新型DES的设计提供参考,并对DES在生物转化方面的工作做出了展望。
低共熔溶剂;生物催化;微生物转化
0 引 言
绿色化学的宗旨之一是减少生化工艺过程中产生的环境毒性,传统的有机溶剂不可避免存在着高挥发性、易燃性、不可回收以及对生物催化反应的抑制作用[1]。因此,寻找安全环保的替代溶剂受到了越来越多的关注[2]。离子液体因其蒸汽压低没有挥发性而被作为传统溶剂的替代溶剂[3],但由于离子液体价格昂贵、合成复杂、对环境污染性大以及许多成分(例如四烷基铵和二烷基咪唑)的生物降解性差[4],不利于社会的可持续性发展。
近年来,类离子液体——低共熔溶剂(deep eutectic solvent, DES),因其具有与离子液体相近的特性,包括蒸气压低、生物降解性好、合成简单、理化性质可调等优点,被广泛应用于生物、化学等各种领域[5]。DES是由氢键供体(hydrogen bond donor, HBD)和氢键受体(hydrogen bond receptor, HBA)以一定摩尔比混合加热形成的均相透明溶液。研究发现,DES与许多生物材料(如核酸、酶和药物)具有生物相容性,且在有机催化、生物转化和分子提取方面均发现有促进作用[6-9]。针对以上特点,本文简述了DES的生物毒性和生物降解性,重点综述了DES在生物催化与转化方面的应用与作用机制,并对其在生物转化领域的工作进行了展望。
1 DES的生物学特性
1.1 细胞毒性
DES由两种或两种以上物质组成,且大多数是由环境友好的天然成分构成(例如胆碱,是B族维生素中的一员)。因此,DES一般被认为是无毒的、具有生物相容性的绿色溶剂,但在参与一些微生物生化转化反应时,DES的细胞毒性往往是不可忽略的,表1列举了近年来报道的DES的生物毒性研究情况。
2013年HAYYAN等[10]提出DES是否具有毒性的问题,并研究了以氯化胆碱(choline chloride, ChCl)为氢键受体,甘油、乙二醇、三甘醇和尿素为氢键供体的四种DES分别对金黄色葡萄球菌()、枯草芽孢杆菌()、大肠杆菌()、铜绿假单胞菌()以及卤虫藻()有无毒性作用进行研究。实验结果表明,四种ChCl型DES对所研究的细菌均无毒性,而仅对卤虫藻有一定毒性且毒性因DES的氢键影响了化合物的结构而远高于其单个成分。WEN等[11]在2015年的相关实验中,发现DES的这种抑制作用与细菌细胞壁结构有关。此外,有文献报道一些含有有机酸的DES(如ChCl/柠檬酸)比氨基、醇基和糖基的DES对细菌的抑制作用更强[12]。RADOŠEVIĆ等[13]研究了三种ChCl类DES对鱼及人细胞系细胞内的毒性作用,发现ChCl/甘油具有较低的细胞毒性(对两种细胞均为EC50>10 mmol/L),而ChCl/草酸则表现出中度的细胞毒性。
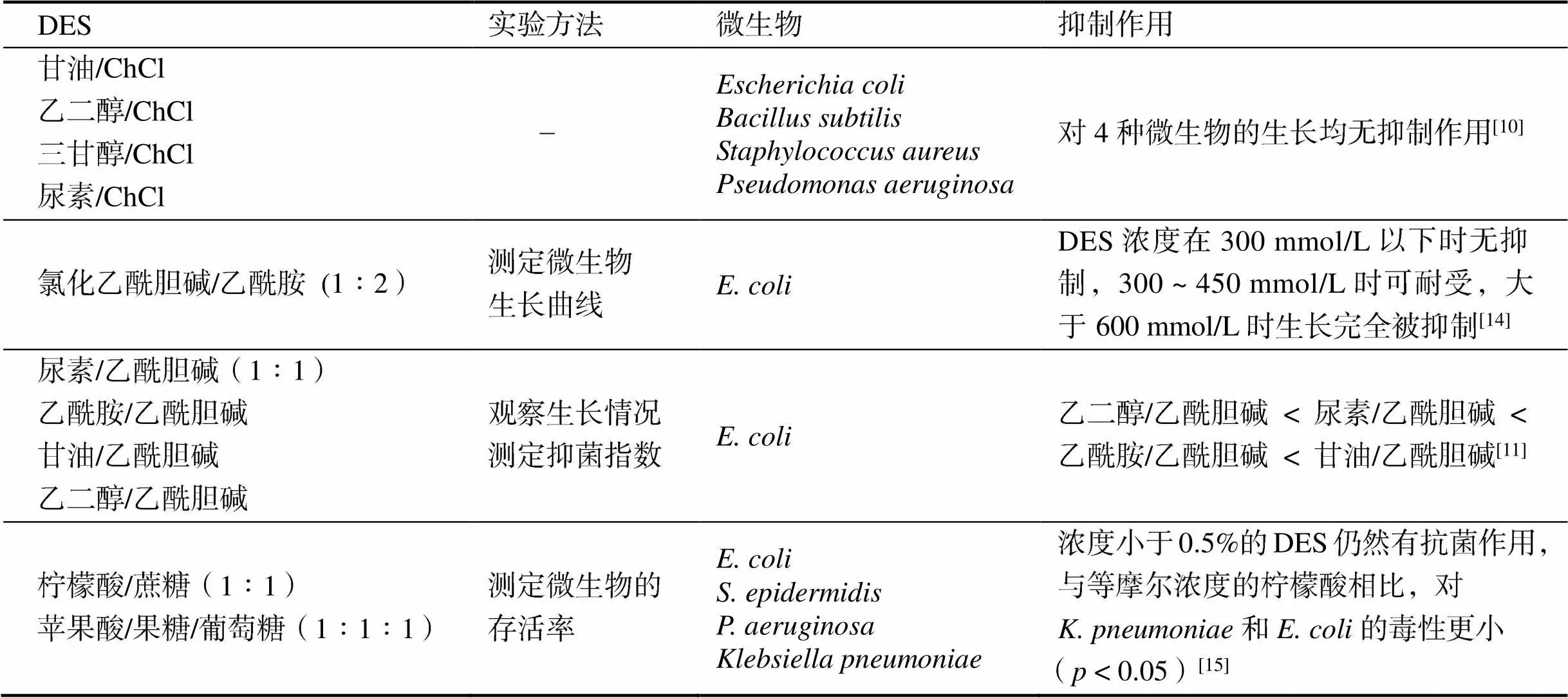
表1 不同DES对微生物细胞生长繁殖的影响
综上所述,DES的组成影响着溶剂的性质和溶剂的利用领域,因此,可根据DES组成成分的物理化学特性合成具有特殊性质的新型DES溶剂。研究表明,一些DES在一定程度上存在细胞毒性,但是由于所测试的生物体与在生物催化过程中使用的有所不同,这些研究具有一定的局限性,然而,对于一个典型的反应,可以在前人研究的指导下估算所使用的DES对反应中生物催化剂的影响[1]。因此,研究者可以在前人基础上更加充分地了解以及利用DES的特性,对其参与的微生物转化以及生物催化反应进行优化。
1.2 DES的生物降解性
被称为“绿色溶剂”的 DES,大多数都是可生物降解的。目前,关于DES生物可降解性的数据较少,确定其生物降解潜力是非常必要的。RADOŠEVIĆ等[13]采用密闭瓶法测试了以葡萄糖(glucose, Glu)、甘油(glycerin, Gly)和草酸(oxalic acid, OA)为氢键供体的三种ChCl类DES的生物降解性。实验表明生物降解程度为ChCl/Glu > ChCl/Gly > ChCl/OA,其中ChCl/Glu的生物降解率最高,为96%;ChCl/OA最低,为68%。
通常生物可降解化合物首先以各种方式通过细胞壁,如自由扩散、易化扩散或主动转运,然后通过酶的氧化作用,中间产物被代谢成水和二氧化碳或转化为细胞的组成物质,这是氨基DES和糖基DES具有良好生物降解性的主要原因,其次,细菌细胞膜上也含有胆碱盐阴离子运输的专属载体。此外,DES的羟基、羧基和氨基是酶催化反应的潜在位点,也可能会提高其生物降解能力[12]。但是一些具有短烷基侧链的DES拥有较差的生物降解性[16]。
2 DES在酶催化反应中的应用
酶催化反应通常在条件较为温和的水溶液中进行,一般不需要常规化学有机合成中所需的官能团活化和保护以及去保护的步骤,使得产物的合成时间更短,选择性更高,能提供更高纯度的产品,在能源和原材料制备方面更有效,比传统方法产生的废物更少[17]。但如果有机底物仅微溶于水,不利于酶催化反应的进行,则有必要开发新的酶催化反应介质,使得非水相酶催化反应成为可能。目前许多DES被用于代替离子液体作为酶催化反应的溶剂。与离子液体相比,DES更有利于环境保护以及节约经济成本。在生物催化方面,已经报道了几种以DES为溶剂的酶催化过程,例如脂肪酶催化(反式)酯化和氨解反应[18-19]。
除了作为酶催化反应的溶剂外,DES也可以作为酶的激活剂,例如LEHMANN等[20]利用DES作为水溶液中的助溶剂来评估纤维素酶的活性和稳定性。有研究发现DES中不同的氢键供体与氢键受体组成以及其摩尔比均会影响酶活性,通过选择具有最佳化学性质的DES,酶可以高度稳定并被激活,例如HUANG等[7]的研究证明了醋酸胆碱/甘油(1∶2)可以作为稳定剂而显著提高脂肪酶的活性。表2列出了不同DES在一些酶催化中的应用。

表2 DES在各种酶生物催化作用中的应用
2.1 脂肪酶
脂肪酶(甘油三酯脂肪酶)是能够催化水解油脂生成游离脂肪酸、甘油二酯、单甘酯和甘油的一类酶[29]。脂肪酶在工业生产中有广泛的应用,例如生物柴油的制备,表面活性剂的合成[30-31]。大多数脂肪酶在有机溶剂中能够保持良好的活性。ZHAO等[12]研究发现廉价、无毒的甘油/ChCl与脂肪酶有良好的生物相容性,可以作为大豆油制备柴油的酶促反应介质,并使产物转化率达到了88%,而且反应结束后回收的诺维信435脂肪酶仍可继续使用至少4次。因此,这种新型DES可以很好地替代传统有毒易挥发的有机溶剂。此外,研究表明脂肪酶在DES中的活性取决于酶和底物的类型。ELGHARBAWY等[32]揭示了DES在脂肪酶催化的水解反应中作为助溶剂和主溶剂的潜在作用。他们利用ChCl与甘油和丙二酸以及糖(葡萄糖、果糖和蔗糖)等组合,试验了6种不同脂肪酶,包括猪胰腺脂肪酶、玫瑰假丝酵母脂肪酶、洋葱伯克霍尔德氏菌脂肪酶、尼氏根霉脂肪酶、丙烯酸树脂南极假丝酵母脂肪酶、固定珠150上的南极假丝酵母脂肪酶B(lipase B, CALB),对对硝基苯棕榈酸酯的水解作用。结果表明,由ChCl/蔗糖制备的DES效果最好,可使CALB和猪胰腺脂肪酶的活性分别提高到355%和345%;并且,动力学研究证实脂肪酶在含有40%的DES中具有更高的催化效率(cat/m)。以上研究说明天然的DES可以作为脂肪酶催化反应的溶剂来取代水反应体系。
在ChCl或氯化乙胺与酰胺、羟基或酸等氢键供体配对的DES中,固定化的CALB具有较强活性[17]。然而,部分DES也会限制脂肪酶的活性。在DURAND等[18]的研究中,利用固定化的CALB为催化剂,进行月桂酸乙烯酯的酯交换反应,使用不同链长的醇评估DES对底物极性的影响,结果发现,DES(ChCl/丙二酸、ChCl/乙二酸、ChCl/乙二醇)的组分在醇解过程中与底物发生竞争反应,而且发现基于二羧酸或乙二醇的DES出现了副反应,导致这些DES的使用受到一些限制。尽管如此,在大多数情况下,DES组分之间的氢键可以显著降低其反应活性。此外,ChCl/尿素和ChCl/甘油等DES具有较高的活性和选择性,是脂肪酶催化反应的理想溶剂,相对于传统有机溶剂,在DES中固定化CALB受醇链长度的影响较小,对蛋白质结构的破坏最小。
2.2 纤维素酶
木质纤维素作为一种常见生物质主要是由复杂的碳水化合物组成,可转化为糖而用于生产生物燃料[33]。DES是最近出现的新一代用于木质纤维素预处理的类离子液体。然而,DES含有的盐成分在后续的糖化过程中会使纤维素酶失活,从而降低整个系统的应用性。因此,有必要评估DES−纤维素酶系统的适用性以改善这一问题。GUNNY等[22]研究了纤维素酶在特定DES存在下的稳定性,进行了葡萄糖生产、能量消耗和动力学性能的适用性评估。研究发现,在体积分数为10%的甘油基DES和乙二醇基DES存在下,纤维素酶能够保留90%以上的活性。而在5%的丙二酸基DES中,酶活性仅剩原有的38%,浓度为10%时无酶活性,这可能是因为丙二酸作为阳离子与酶相互作用,导致构象变化和酶的失活。此外,与稀碱预处理体系相比,两种DES体系均表现出较高的葡萄糖转化率和较低的能耗,且乙二醇基DES有较好的动力学性能。GUNNY等[33]也阐明了DES对生物质消化的稳定性和协同作用,发现30℃时,工业纤维素酶在体积分数为10%的DES中作用1 h后,其相对活性保持在90%以上,且预处理温度越高,米糠制取单糖的效率越高。
2.3 其他类型酶
除了脂肪酶与纤维素酶两种常用的酶,DES也会对一些其他酶的酶促反应产生影响。例如胰凝乳蛋白酶,在ChCl/甘油混合物中对肽的合成具有很高的活性[23]。ChCl型DES经生物催化有望成为合成多肽的新溶剂。DES对绿豆环氧化物酶水解环氧苯乙烯的不对称反应也有影响[25],添加10%的ChCl/三聚乙二醇可以使产物的对映体(-苯基乙二醇)纯度从 (83.2±1.3)%提高到 (87.9±0.3)%。当DES添加量从10%增加到30%,对映体纯度从87.9%增加到94%,但是产物的产量呈下降趋势,且10% ~ 30%的添加量不利于酶活性的恢复。
3 在DES中的微生物转化
3.1 酵母菌
在一些微生物参与的生物转化反应中,添加DES的双水相溶剂比单纯水溶剂有更好的效果。当底物在水中的溶解度过低时,需要在有机溶剂中进行。这种利用微生物全细胞进行的生物催化与直接使用分离酶相比,细胞为酶提供了一个自然的环境,允许辅因子再生,并防止酶在严苛条件下(例如在非水相等非常规的反应介质中)发生变性和失活[34]。表3总结了一些DES在微生物转化中的应用情况。红酵母菌()属于真菌界[35],通常能够还原低分子量酮(苯乙酮的衍生物)[36]以及酮酯[37]。BUBALO等[38]评价了胆碱类DES作为酵母菌将3-氧丁酸乙酯还原为3-羟基丁酸乙酯的反应溶剂,发现此酿酒酵母菌与DES有良好的生物相容性,此外,氢键供体的类型和DES中的含水量对反应产率有较大影响,当水的质量百分数为50%时,糖和醇类DES是还原反应的最佳溶剂,其产率与磷酸盐缓冲液相似(<93.0%),而在酸或酰胺类DES中,无论水含量如何,产率都很低(<49.3%)。
3.2 大肠杆菌
直接利用微生物进行生物催化反应能够避免酶的分离等一系列复杂程序,但是由于全细胞细胞壁及细胞膜的存在,底物和酶的接触并不充分,并且生物转化产物无法快速流出,容易造成底物抑制[44],降低目标产物的收率。为了解决这一问题,增强细胞内酶与底物之间的结合,ZHANG等[45]使用离子液体和DES处理了大肠杆菌BL21-pET21a-rhaB1细胞进行生物转化,利用芦丁来生产异槲皮苷。研究发现,6%的ChCl/尿素处理后的大肠杆菌催化活性最高,且用此DES处理后细胞的稳定性更强,这是由于处理后细胞的最佳pH接近中性且有耐高温性,在最佳条件下,异槲皮苷的收率最高可达(93.05±1.3)%。此研究表明,利用ChCl/尿素处理大肠杆菌细胞可以提高细胞膜的通透性,从而提高细胞的生物转化能力。
4 结论与展望
DES作为一种可生物降解溶剂,在生物质酶的催化作用中可充当溶剂和助溶剂以及酶的激活剂,DES可以增强酶的稳定性,也可以使一些非水相酶的酶活性保持及应用得以实现。DES在蛋白酶、脂肪酶、纤维素酶的生物质催化方面都有很好的协同作用。当DES应用于微生物的生物转化过程中,DES能够增强细胞膜的通透性,加强底物与胞内酶的接触,减少底物抑制,缩短催化反应的时间,提高产物的收率。DES在生物转化方面的应用为一些生物产品的回收提供了有效的途径。然而,在DES对微生物活性的影响方面仍需做很多研究。例如在DES中所有使用脂肪酶的生物转化都是在与溶剂亲和力差的底物中进行的,而在大多数情况下这种底物是惰性的,因此下一步可能会进行在DES中对酶修饰的应用。另外,在DES中进行反应的酶的固定化作用也需进一步探讨。其次,在选择DES时,要尽量避免一些有害离子,而且一些酶的反应中可能会产生副产物,导致反应体系黏度增大,使得搅拌和回收变得困难,这也是一项需要继续深入研究和解决的问题。
[1] XU P, ZHENG GW, ZONG MH, et al. Recent progress on deep eutectic solvents in biocatalysis[J]. Bioresources and bioprocessing, 2017, 4(1): 34. DOI: 10.1186/s40643- 017-0165-5.
[2] YANG Z, PAN W B. Ionic liquids: green solvents for nonaqueous biocatalysis[J]. Enzyme and microbial technology,2005, 37(1): 19-28. DOI: 10.1016/j.enzmictec.2005.02.014.
[3] CAPELLO C, FISCHER U, HUNGERBÜHLER K. What is a green solvent? A comprehensive framework for the environmental assessment of solvents[J]. Green chemistry, 2007, 9(9): 927-934. DOI:10.1039/B617536H.
[4] COLEMAN D, GATHERGOOD N. Biodegradation studies of ionic liquids[J]. Chemical society reviews, 2010, 39(2): 600-637. DOI:10.1039/B817717C.
[5] TANG X, ZUO M, LI Z, et al. Green processing of lignocellulosic biomass and its derivatives in deep eutectic solvents[J]. ChemSusChem, 2017, 10(13): 2696-2706. DOI: 10.1002/cssc.201700457.
[6] DE MARÍA P D, MAUGERI Z. Ionic liquids in biotransformations: from proof-of-concept to emerging deep-eutectic-solvents[J]. Current opinion in chemical biology, 2011, 15(2): 220-225. DOI: 10.1016/j.cbpa. 2010.11.008.
[7] HUANG ZL, WU BP, WEN Q, et al. Deep eutectic solvents can be viable enzyme activators and stabilizers[J]. Journal of chemical technology and biotechnology, 2014, 89(12): 1975-1981. DOI: 10.1002/jctb.4285.
[8] PAIVA A, CRAVEIRO R, AROSO I, et al. Natural deep eutectic solvents - solvents for the 21st century[J]. ACS sustainable chemistry & engineering, 2014, 2(5): 1063- 1071. DOI: 10.1021/sc500096j.
[9] SMITH E L, ABBOTT A P, RYDER K S. Deep eutectic solvents (DESs) and their applications[J]. Chemical reviews, 2014, 114(21): 11060-11082. DOI: 10.1021/cr300162p.
[10] HAYYAN M, HASHIM M A, HAYYAN A, et al. Are deep eutectic solvents benign or toxic?[J]. Chemosphere, 2013, 90(7): 2193-2195. DOI: 10.1016/j.chemosphere. 2012.11.004.
[11] WEN Q, CHEN JX, TANG YL, et al. Assessing the toxicity and biodegradability of deep eutectic solvents[J]. Chemosphere, 2015, 132: 63-69. DOI: 10.1016/j. chemosphere.2015.02.061.
[12] ZHAO BY, XU P, YANG FX, et al. Biocompatible deep eutectic solvents based on choline chloride: characterization and application to the extraction of rutin from[J]. ACS sustainable chemistry & engineering, 2015,3(11): 2746-2755. DOI: 10.1021/acssuschemeng.5b00619.
[13] RADOŠEVIĆK, BUBALO M C, SRČEK V G, et al. Evaluation of toxicity and biodegradability of choline chloride based deep eutectic solvents[J]. Ecotoxicology and environmental safety, 2015, 112: 46-53. DOI: 10.1016/j.ecoenv.2014.09.034.
[14] TORREGROSA-CRESPO J, MARSET X, GUILLENA G, et al. New guidelines for testing “Deep eutectic solvents” toxicity and their effects on the environment and living beings[J]. Science of the total environment, 2020, 704: 135382. DOI: 10.1016/j.scitotenv.2019.135382.
[15] WIKENE K O, RUKKE H V, BRUZELL E, et al. Investigation of the antimicrobial effect of natural deep eutectic solvents (NADES) as solvents in antimicrobial photodynamic therapy[J]. Journal of photochemistry and photobiology B: biology, 2017, 171: 27-33. DOI: 10.1016/j.jphotobiol.2017.04.030.
[16] BUBALO M C, RADOŠEVIĆ K, REDOVNIKOVIĆ I R, et al. A brief overview of the potential environmental hazards of ionic liquids[J]. Ecotoxicology and environmentalsafety, 2014, 99: 1-12. DOI: 10.1016/j.ecoenv.2013.10.019.
[17] SHELDON R A. Biocatalysis and biomass conversion in alternative reaction media[J]. Chemistry-A European journal,2016, 22(37): 12984-12999. DOI: 10.1002/chem.201601940.
[18] DURAND E, LECOMTE J, BARÉA B, et al. Evaluation of deep eutectic solvents as new media forB lipase catalyzed reactions[J]. Process biochemistry, 2012, 47(12): 2081-2089. DOI: 10.1016/j. procbio.2012. 07.027.
[19] ZHAO H, BAKER G A, HOLMES S. New eutectic ionic liquids for lipaseactivation and enzymatic preparation of biodiesel[J]. Organic & biomolecular chemistry, 2011, 9(6): 1908-1916. DOI: 10.1039/C0OB01011A.
[20] LEHMANN C, SIBILLA F, MAUGERI Z, et al. Reengineering CelA2 cellulase for hydrolysis in aqueous solutions of deep eutectic solvents and concentrated seawater[J]. Green chemistry, 2012, 14(10): 2719-2726. DOI: 10.1039/C2GC35790A.
[21] ZHAO KH, CAI YZ, LIN XS, et al. Enzymatic synthesis of glucose-based fatty acid esters in bisolvent systems containing ionic liquids or deep eutectic solvents[J]. Molecules, 2016, 21(10): 1294. DOI: 10.3390/molecules21101294.
[22] GUNNY A A N, ARBAIN D, NASHEF E M, et al. Applicability evaluation of Deep Eutectic Solvents-Cellulase system for lignocellulose hydrolysis[J]. Bioresource technology, 2015, 181: 297-302. DOI: 10.1016/j.biortech. 2015.01.057.
[23] MAUGERI Z, LEITNER W, DE MARÍA P D. Chymotrypsin-catalyzed peptide synthesis in deep eutectic solvents[J]. EurJOC, 2013, 2013(20): 4223-4228. DOI: 10.1002/ejoc.201300448.
[24] WU B P, WEN Q, XU H, et al. Insights into the impact of deep eutectic solvents on horseradish peroxidase: activity, stability and structure[J]. Journal of molecular catalysis B: enzymatic, 2014, 101: 101-107. DOI: 10.1016/j.molcatb.2014.01.001.
[25] PENG F, ZHAO Y, LI F Z, et al. The effect of deep eutectic solvents on the asymmetric hydrolysis of styrene oxide by mung bean epoxide hydrolases[J]. Bioresources and bioprocessing, 2018, 5(1): 5. DOI:10.1186/s40643- 018-0191-y.
[26] NIAN B B, CAO C, LIU Y F. Howlipase B can be activated in natural deep eutectic solvents: experimental and molecular dynamics studies[J]. Journal of chemical technology and biotechnology, 2020, 95(1): 86-93. DOI: 10.1002/jctb.6209.
[27] ZHAO H, ZHANG C, CRITTLE T D. Choline-based deep eutectic solvents for enzymatic preparation of biodiesel from soybean oil[J]. Journal of molecular catalysis B: enzymatic, 2013, 85-86: 243-247. DOI: 10.1016/j.molcatb.2012.09.003.
[28] ZOHRA F, HASSANI I M, LAVANDERA I, et al. Stabilizing effects of deep eutectic solvents on alcohol dehydrogenase mediated systems[J]. World Academy of Science, Engineering and Technology International Journal of Bioengineering and Life Sciences, 2016, 10(12): 829-834. DOI: 10.5281/zenodo.1127930.
[29] JAEGER K E, DIJKSTRA B W, REETZ M T. Bacterial biocatalysts: molecular biology, three-dimensional structures, and biotechnological applications of lipases[J]. Annual review of microbiology, 1999, 53: 315-351. DOI: 10.1146/annurev.micro.53.1.315.
[30] GOG A, ROMAN M, TOŞA M, et al. Biodiesel production using enzymatic transesterification - Current state and perspectives[J]. Renewable energy, 2012, 39(1): 10-16. DOI: 10.1016/j.renene.2011.08.007.
[31] TARAHOMJOO S, ALEMZADEH I. Surfactant production by an enzymatic method[J]. Enzyme and microbial technology, 2003, 33(1): 33-37. DOI: 10.1016/S0141- 0229(03)00085-1.
[32] ELGHARBAWY A A, HAYYAN A, HAYYAN M, et al. Shedding light on lipase stability in natural deep eutectic solvents[J]. Chemical and biochemical engineering quarterly, 2018, 32(3): 359-370. DOI: 10.15255/CABEQ.2018.1335.
[33] GUNNY A A N, ARBAIN D, DAUD M Z M, et al. Synergistic action of deep eutectic solvents and cellulases for lignocellulosic biomass hydrolysis[J]. Materials research innovations, 2014, 18(S6): S6-65-S6-67. DOI: 10.1179/1432891714Z.000000000933.
[34] DE CARVALHO C C C R. Enzymatic and whole cell catalysis: finding new strategies for old processes[J]. Biotechnology advances, 2011, 29(1): 75-83. DOI: 10.1016/j.biotechadv.2010.09.001.
[35] KOT A M, BŁAŻEJAK S, KURCZ A, et al.-potential source of lipids, carotenoids, and enzymes for use in industries[J]. Applied microbiology and biotechnology, 2016, 100(14): 6103-6117. DOI: 10.1007/s00253-016-7611-8.
[36] FARDELONE L C, RODRIGUES J A R, MORAN P J S. Bioreduction of 2-azido-1-arylethanones mediated byand[J]. Journal of molecular catalysis B: enzymatic, 2006, 39(1/4): 9-12. DOI:10.1016/j.molcatb.2006.01.015.
[37] DE SOUZA RAMOS A, RIBEIRO J B, DE OLIVEIRA LOPES R, et al. Whole cells in enantioselective reduction of-butyl acetoacetate[J]. Synthetic communications, 2013,43(12): 1611-1618. DOI: 10.1080/00397911.2012.655685.
[38] BUBALO M C, MAZUR M, RADOŠEVIĆ K, et al. Baker's yeast-mediated asymmetric reduction of ethyl 3-oxobutanoate in deep eutectic solvents[J]. Process biochemistry, 2015, 50(11): 1788-1792. DOI: 10.1016/ j.procbio.2015.07.015.
[39] MAO S H, LI K, HOU Y L, et al. Synergistic effects of components in deep eutectic solvents relieve toxicity and improve the performance of steroid biotransformation catalyzed by[J]. Journal of chemical technology and biotechnology, 2018, 93(9): 2729-2736. DOI: 10.1002/jctb.5629.
[40] MĄCZKA W, WIŃSKA K, GRABARCZYK M, et al. Biotransformation of α-acetylbutyrolactone instrains[J]. International journal of molecular sciences, 2018, 19(7): 2106. DOI: 10.3390/ijms19072106.
[41] YANG TX, ZHAO LQ, WANG J, et al. Improving whole-cell biocatalysis by addition of deep eutectic solvents and natural deep eutectic solvents[J]. ACS sustainable chemistry & engineering, 2017, 5(7): 5713-5722. DOI: 10.1021/acssuschemeng.7b00285.
[42] XU P, XU Y, LI XF, et al. Enhancing asymmetric reduction of 3-chloropropiophenone with immobilizedsp. CCTCC M209061 cells by using deep eutectic solvents as cosolvents[J]. ACS sustainable chemistry & engineering, 2015, 3(4): 718-724. DOI: 10.1021/acssuschemeng.5b00025.
[43] XU P, CHENG J, LOU WY, et al. Using deep eutectic solvents to improve the resolution of racemic 1-(4-methoxyphenyl)ethanol throughsp. CCTCC M209061 cell-mediated asymmetric oxidation[J]. RSC advances, 2015, 5(9): 6357-6364. DOI: 10.1039/ C4RA12905A.
[44] NI Y, CHEN R R. Lipoprotein mutation accelerates substrate permeability-limited toluene dioxygenase-catalyzedreaction[J]. Biotechnology progress, 2005, 21(3): 799-805. DOI: 10.1021/bp049575g.
[45] ZHANG F, ZHU CT, PENG QM, et al. Enhanced permeability of recombinantcells with deep eutectic solvent for transformation of rutin[J]. Journal of chemical technology and biotechnology, 2020, 95(2): 384-393. DOI: 10.1002/jctb.5949.
Applications of Deep Eutectic Solvent in Biotransformation
WANG Yan-ling1,2,3,4, CHEN Xiao-yan2,3,4, YU Qiang2,3,4, ZHANG Qing-hua1, WANG Zhong-ming2,3,4, YUAN Zhen-hong2,3,4
(1. Jiangxi Engineering Laboratory for the Development and Utilization of Agricultural Microbial Resources, College of Bioscience and Bioengineering, Jiangxi Agricultural University, Nanchang 330045, China;2. Guangzhou Institute of Energy Conversion, Chinese Academy of Sciences,Guangzhou 510640, China; 3. CAS Key Laboratory of Renewable Energy, Guangzhou 510640, China; 4. Guangdong Provincial Key Laboratory of New and Renewable Energy Research and Development, Guangzhou 510640, China)
Deep eutectic solvent (DES) have been proved to be good alternatives for conventional organic solvents and ionic liquids. It has the characteristics of low melting point, low volatility, simple synthesis, easy recovery, and low preparation cost. In this review, the biotoxicity and biodegradability of DES was introduced, and the research progress of DES in biocatalysis and microbial transformation was summarized. Then, the mechanism of DES in enzymatic reaction was briefly discussed, which was helpful for the design of new DES. Finally, the prospect was presented on the future roles of DES in biotransformation.
deep eutectic solvents; biocatalysis; microbial transformation
TK6;Q50
A
10.3969/j.issn.2095-560X.2021.03.005
2095-560X(2021)03-0211-07
2021-03-08
2021-04-16
国家自然科学基金项目(51876206);广东省自然科学基金项目(2018A030313012);广州市重点研发项目(202103000011);广东省特支计划科技创新青年拔尖人才项目(2016TQ03N647)
余 强,E-mail:yuqiang@ms.giec.ac.cn;张庆华,E-mail:zqh_net@163.com
王艳玲(1996-),女,硕士研究生,主要从事木质素的解聚与微生物转化研究。
余 强(1983-),男,博士,研究员,主要从事生物质解聚及转化研究。
张庆华(1979-),男,博士,副教授,主要从事生物资源与环境工程研究。

