小球藻病毒PBCV-1编码的Cu,Zn-SOD 酶学稳定性
刘建荣贾红玉陈慧慧刘晓飞康明
(1.河北大学 生物工程技术创新中心,河北 保定 071002;2.河北大学 生命科学学院,河北 保定 071002)
活性氧(reactive oxygen species,ROS)既可以由有氧生物在正常代谢活动中产生,又可以在胁迫条件下产生.生理浓度的ROS有益于生物体本身,并参与信号通路活动以及保护生物免于病原体侵染;但高浓度ROS会破坏生物大分子及细胞结构[1-3],但细胞能利用超氧化物歧化酶(superoxide dismutases,SODs)降解ROS来降低其造成的破坏[4-5].作为金属蛋白,SODs能将超氧阴离子转化成较低毒性的过氧化氢和分子态氧从而保护生物有机体免受有毒活性氧破坏[6].根据与酶蛋白结合的用于超氧离子淬灭的金属辅基的不同,SODs被分成铜锌-超氧化物歧化酶 (Cu,Zn-SOD),铁-超氧化物歧化酶 (Fe-SOD),锰-超氧化物歧化酶(Mn-SOD),以及镍-超氧化物歧化酶 (Ni-SOD).哺乳动物细胞中Cu,Zn-SOD 位于细胞质中 (SOD1) 或位于胞外空间 (SOD3),Mn-SOD 位于线粒体 (SOD2)[7];高等植物通常具有位于线粒体的Mn-SOD、叶绿体的Fe-SOD、细胞质及细胞分室中的多种类型的Cu,Zn-SOD[8];真核藻类和原生动物细胞通常具有Mn-SOD和Fe-SOD,缺乏Cu,Zn-SOD;原核生物具有Mn-SOD 和/或Fe-SOD,但很多革兰氏阴性细菌具有Cu,Zn-SOD[9-10].Ni-SOD 只存在于数种链霉菌中[11].病毒极少编码SODs,但几类大型DNA 病毒如痘病毒 (poxviruses)、杆状病毒 (baculoviruses)、拟菌病毒 (mimiviruses) 以及藻类DNA 病毒 (phycodnaviruses)却编码Cu,Zn-SOD 状基因.除了藻类DNA 病毒和一种昆虫痘病毒外,其他病毒编码的SODs并未检测到活性[12-13].藻类DNA 病毒科的模式病毒株paramecium bursaria chlorella virus 1(PBCV-1)及多数小球藻病毒属 (chloroviruses) 同属病毒株都编码Cu,Zn-SOD 基因;PBCV-1编码的铜锌-超氧化物歧化酶 (chlorovirus Cu,Zn-SOD,cvSOD)以及其截短PBCV-1突变体truncated chlorovirus SOD(以下简称tcvSOD) 均具有SOD 活性,其基因的表达有可能帮助病毒淬灭宿主产生的ROS,有利于病毒的感染与复制[13].由于SODs能降低ROS水平,减少氧自由基对生物有机体的伤害,具有抗肿瘤、抗炎及提高免疫力的作用,使得其在食品、医药和日化领域的应用受到越来越多的关注[14].本文试图通过测定小球藻病毒株PBCV-1 编码的Cu,Zn-SOD 截短突变体tcvSOD 在不同温度、p H 值、蛋白变性剂胁迫条件下的酶活性及酶学稳定性,并进一步评估其应用潜力.tcvSOD 是cvSOD 截短了其N-端的第1个内部甲硫氨酸前面的21个氨基酸残基后形成的截短突变体,此突变体与野生型相比在大肠杆菌中具有较高的表达量并具有较强的酶活性[13],因此本研究以重组tcvSOD 为材料.
1 材料与方法
1.1 实验材料
大肠杆菌克隆宿主DH5α和表达宿主BL21 Rosetta(DE3)(Novagen产品)均为本实验室保存,表达质粒p ET23a(+)(Novagen产品)为本实验室保存.除特殊标明的以外,本实验所有试剂均购自国药集团.
1.2 tcvSOD基因克隆与表达载体构建
根据GenBank的PBCV-1的cvSOD 序列,从N-端第1个内部甲硫氨酸密码子开始设计5’端引物.1对扩增引物序列设计为a245r NdeIFrw:CCGCATATGACCAAGAACACATCTTCATTG,a245r XhoIRev:GACCTCGAGACAAA AGTTTTCTTTGGCATA.上述引物由奥科鼎盛生物科技有限公司合成.tcvSOD PCR 产物利用Phanta Super-Fidelity D NA 聚合酶 (Vazyme) 获得,扩增条件如下:模板95℃预变性30 s,95℃变性15 s,59.3℃退火15 s,72℃延伸60 s,30个循环,补齐延伸10 min.PCR 产物经质量分数为1%的琼脂糖凝胶电泳分离,Biomiga胶回收试剂盒纯化,Takara Q.cut 限制性内切酶NdeI与XhoI消化,再与同样经NdeI与XhoI消化的大肠杆菌表达载体p ET23a(+)连接;连接产物转化大肠杆菌克隆宿主DH5α,经扩增、酶切验证、测序分析,确定tcvSOD 基因插入到表达载体而获得重组质粒p ET23a(+)-tcvsod.
1.3 tcvSOD的表达与纯化
重组质粒p ET23a(+)-tcvsod导入蛋白表达宿主BL21 Rosetta(DE3),以不含质粒的宿主菌为对照,经0.4 mmol/L的IPTG 诱导、细胞破碎、Ni-NTA resin (Novagen产品) 吸附,结合/裂解缓冲液 (50 mmol/L Na H2PO4,300 mmol/L NaCl,10 mmol/L imidazole,p H 8.0)、洗涤缓冲液 (50 mmol/L Na H2PO4,300 mmol/L NaCl,20 mmol/L imidazole,p H 8.0)、洗脱缓冲液 (50 mmol/L Na H2PO4,300 mmol/L NaCl,250 mmol/L imidazole,p H 8.0) 纯化,最终将tcvSOD 收集于含体积分数50%甘油的洗脱缓冲液中.用分离胶质量分数12%的SDS-PAGE检测tcvSOD 的表达与纯化结果.
1.4 tcvSOD活性检测
参照Marklund的邻苯三酚自氧化法并加以修改[14-15].
1.4.1 邻苯三酚自氧化速率测定
将999μL 50 mmol/L Tris-HCl缓冲液,1 mmol/L二乙三胺五乙酸,p H 8.2,25℃下平衡20 min后迅速加入1μL 45 mmol/L邻苯三酚溶液(用10 mmol/L HCl配制),邻苯三酚终浓度为0.045 mmol/L,在320 nm 处进行3 min的时间扫描.通过计算斜率ΔA/Δt得到自氧化速率R,单位为ΔA320/min,其中A为吸光度,t为扫描时间.此方法得到R=0.022/min,落在Marklund建议的用于间接测定SOD 活性的邻苯三酚自氧化速率0.015~0.025/min内[15].
1.4.2 tcvSOD 活性测定与邻苯三酚自氧化抑制曲线绘制
在总体积为1 m L反应体系中混合50 mmol/L Tris-HCl缓冲液 (含1 mmol/L的二乙三胺五乙酸,p H 8.2) 和不同质量浓度的tcvSOD 蛋白,25℃平衡20 min 后,加入1μL的45 mmol/L 邻苯三酚溶液,320 nm 处扫描3 min以获取R值,并通过调整tcvSOD 加入量达到对邻苯三酚自氧化速率的最大抑制.在此条件下,SOD 对邻苯三酚自氧化速率达到最大抑制水平的50%作为SOD 的1个活性单位,也可同时计算SOD 的比活性[16].
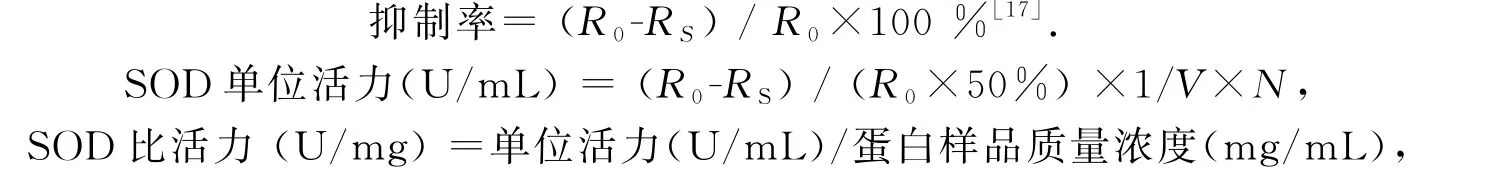
式中R0为320 nm 处邻苯三酚自氧化速率;RS为添加样品SOD 后邻苯三酚自氧化速率;V为加样体积(单位为m L);N是样品稀释倍数.
1.5 酶学稳定性实验
将纯化的tcvSOD 适当稀释,测试在各种胁迫条件下反应体系中tcvSOD 质量浓度分别为0.05、0.1、1μg/m L时的相对酶活性.
温度:在总体积为1 m L反应体系中混合50 mmol/L Tris-HCl缓冲液 (含1 mmol/L的二乙三胺五乙酸,p H 8.2),适量的tcvSOD蛋白,调整酶蛋白终质量浓度为0.05、0.1、1μg/m L,分别在4、25、37、42、55、65、75、90℃条件下保温30 min,加入1μL 45 mmol/L邻苯三酚溶液,320 nm 处扫描3 min进行相对酶活测定.
p H 值:在总体积为1 m L反应体系中分别混合50 mmol/L 柠檬酸盐缓冲液(p H 4,p H 6)、Tris-HCl缓冲液 (p H 8) 和甘氨酸-NaOH 缓冲液 (p H 10),均含有1 mmol/L的二乙三胺五乙酸,均加入适量的tcv-SOD 蛋白,调整酶蛋白终质量浓度为0.05、0.1、1μg/m L,25℃保温30 min,以不加酶的反应体系为对照,加入1μL的45 mmol/L邻苯三酚溶液,与1.4.2相同条件下测定酶活.
变性剂:在总体积为1 m L反应体系中将50 mmol/L Tris-HCl缓冲液(含1 mmol/L的二乙三胺五乙酸,p H 8.2),分别与相应的变性剂(质量分数2%,4%,6%,8%,10%的SDS;2、4、6、8、10 mol/L的尿素;1、2、3、4 mol/L的盐酸胍) 混合,加入适量的tcvSOD蛋白,调整酶蛋白终质量浓度为0.05、0.1、1μg/m L,25℃保温30 min,以不加酶的反应体系为对照,加入1μL的45 mmol/L邻苯三酚溶液,与1.4.2相同条件下测定酶活.
2 结果与分析
2.1 tcvSOD的大肠杆菌异源表达
与人(GenBank 登录号NP_000445.1,下同)、牛(NP_777040.1)及黑腹果蝇(CAA35210.1) 的Cu,Zn-SOD 相比,以小球藻病毒PBCV-1编码的Cu,Zn-SOD具有32个N-端冗余氨基酸残基,功能不详,其中第22位是甲硫氨酸.以PBCV-1基因组DNA 为模板,以其编码的Cu,Zn-SOD N-端22位甲硫氨酸作为起始密码子设计引物进行截短的SOD 突变体tcvSOD 基因扩增,得到1条约500 bp DNA 条带,与预期的489 bp产物相符 (图1a).将tcvSOD 的PCR 产物与载体p ET23a(+)同时用NdeI和XhoI酶切处理、连接、转化大肠杆菌克隆宿主DH5α,挑取单菌落培养并用Biomiga质粒提取试剂盒提取质粒DNA,经酶切鉴定确定tcvSOD 片段插入到了载体合适位点 (图1b),最终对tcvSOD 阳性克隆测序确定了插入片段的正确性.经测序验证的p ET23a(+)-tcvsod转化大肠杆菌外源蛋白表达载体BL21 Rosetta(DE3),用终浓度为0.4 mmol/L的IPTG 诱导tcvSOD 蛋白表达,并以BL21 Rosetta(DE3)空菌作为阴性对照.对诱导后的菌体细胞进行破碎离心、重组蛋白Ni-NTA 凝胶纯化和SDS-PAGE 鉴定,发现重组tcvSOD 蛋白主要存在于细胞的可溶性组分中,经Ni-NTA 凝胶结合、洗涤、洗脱得到大小约18 ku 的6×His-tcvSOD 重组蛋白(图1c).经BCA 蛋白浓度测定试剂盒(Solarbio产品)测定重组蛋白浓度,用洗脱液将重组蛋白稀释到适当浓度并掺入终体积分数为50%的甘油备用.
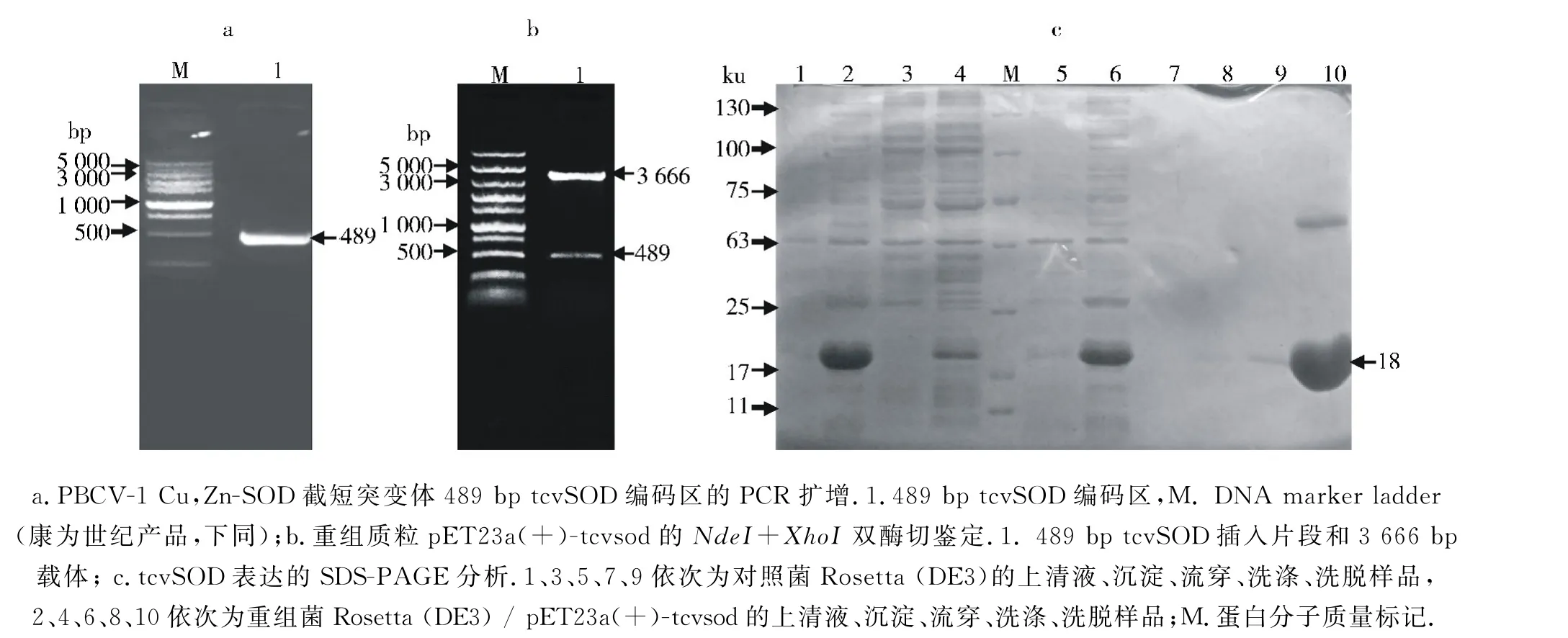
图1 PBCV-1编码的tcvSOD基因的克隆与大肠杆菌异源表达Fig.1 Cloning and heterologous over-expression of tcvSOD encoded by Chlorovirus PBCV-1 in Escherichia coli
2.2 tcvSOD对邻苯三酚自氧化的抑制
采用Marklund[15]的抑制邻苯三酚自氧化间接测定SOD 活性的方法检测tcvSOD 酶活性.此方法的原理是邻苯三酚在碱性条件下发生自氧化,产生多种具不同吸收峰的中间产物且有超氧阴离子的参与,中间产物产量与邻苯三酚自氧化速率呈正相关.SOD 通过降解超氧阴离子抑制邻苯三酚自氧化,因此监测中间产物吸光度的改变来表示SOD 对邻苯三酚自氧化的抑制,最终间接推测出SOD 的酶活性.用320 nm 处吸光度检测邻苯三酚自氧化产生的中间产物[14,18],具体见实验方法1.4.2.tcvSOD对邻苯三酚自氧化有明显的抑制作用 (图2),抑制率最高可达97%;在tcv-SOD质量浓度为0.2μg/m L时达到最大抑制.按前述SOD酶活力单位定义计算得到tcvSOD比活力为16 050 U/mg.
2.3 tcvSOD热稳定性和酸碱稳定性
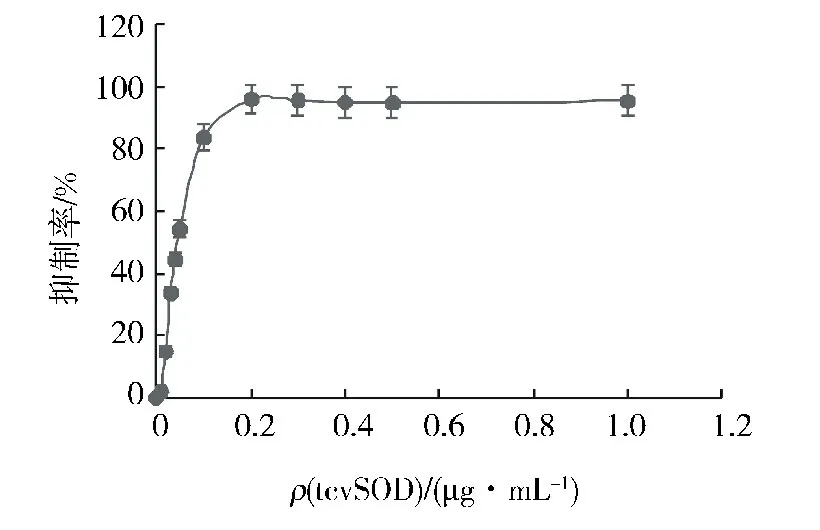
图2 tcvSOD对邻苯三酚自氧化反应的抑制曲线Fig.2 Inhibition curve generated by tcvSOD toward the auto-oxidation of pyrogallol
将反应体系中的tcvSOD 质量浓度分别调整到0.05、0.1、1μg/m L,在4、25、37、42、55、65、75 及90℃下保温30 min后测定SOD 活性,结果表明,当反应体系中tcvSOD质量浓度为1μg/m L时,酶活性从4~75℃保持恒定,在90℃处理30 min后略有下降;而酶质量浓度为0.1和0.05μg/m L时,酶活性从42℃开始下降,到90℃时几乎完全失活(图3a).推测温度较高时低质量浓度tcvSOD 更容易丢失螯合的Cu2+和Zn2+从而迅速丧失活性,但这一推断有待实验证明.上述结果证明,在合适的质量浓度下tcvSOD 具有相当高的热稳定性.变换p H 值从4~12,质量浓度1μg/m L 与0.1μg/m L时tcvSOD 活性维持不变,质量浓度0.05μg/m L样品只是在p H 12时活性略有降低,表明tcvSOD 在较大p H值范围内具有稳定性(图3b).
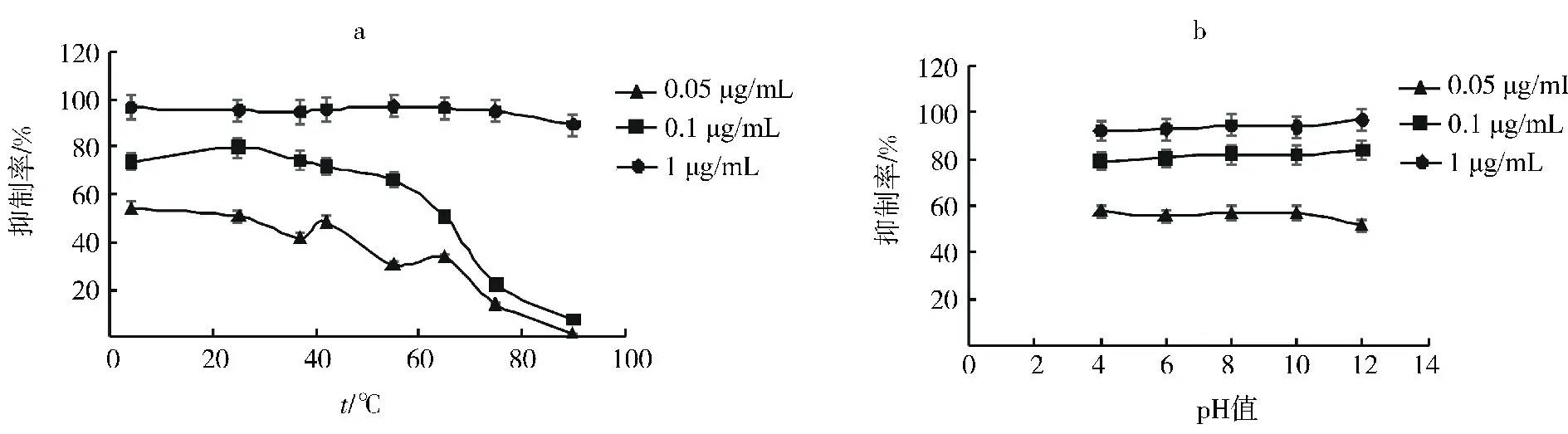
图3 tcvSOD的热稳定性(a)与酸碱稳定性(b)Fig.3 Thermo-stability(a)and p H-stability(b)of tcvSOD
2.4 不同蛋白变性剂对tcvSOD活性的影响
鉴于SOD 在医药和食品等领域有广泛的应用前景,体外检测SOD 在各种变性剂胁迫下的酶活稳定性就显得十分必要.在本文实验条件下,终质量浓度1μg/m L的tcvSOD,其活性在质量分数2%~8%SDS作用下维持稳定,质量分数10%SDS导致酶活性的轻微丧失;酶质量浓度0.1μg/m L 和0.05μg/m L 时对SDS处理非常敏感,残留酶活性降到20%以下;质量分数10%SDS处理下酶活性几乎完全丧失(图4a).与SDS处理相反,3种不同质量浓度的tcvSOD 对2~10 mol/L尿素 (图4b) 与1~4 mol/L盐酸胍 (图4c)处理不敏感,无论是质量浓度0.05μg/m L还是1μg/m L的酶蛋白,在实验条件下均维持活力不变.表明小球藻病毒株PBCV-1编码的Cu,Zn-SOD 截短突变体tcvSOD 重组蛋白可抵抗较高浓度的蛋白变性剂尿素(10 mol/L)和盐酸胍 (4 mol/L) 胁迫;当酶质量浓度达到1μg/m L 时也能抵抗较高质量分数的SDS(10%)胁迫.
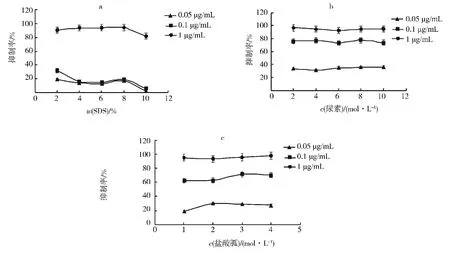
图4 变性剂对tcvSOD酶活性的影响Fig.4 Effects of protein denaturants on the enzymatic activity of tcvSOD
3 讨论
包括PBCV-1在内的小球藻病毒是大型DNA 病毒如痘病毒、杆状病毒、拟菌病毒和藻类DNA 病毒中极少数编码有活性SOD 的病毒;PBCV-1的Cu,Zn-SOD 基因表达可能有助于病毒降解宿主产生的ROS,利于病毒的感染与复制.其截短突变型tcvSOD 基因克隆到表达载体p GEX-2T 上,并利用大肠杆菌BL21表达出的可溶性重组蛋白具有典型的Cu,Zn-SOD 特征,例如活性受KCN 强烈抑制[14].p GEX 系列以28 ku的谷胱甘肽S转移酶 (GST) 作为标签蛋白,为了免除去标签蛋白步骤,方便进一步进行tcvSOD 酶学性质研究,本文重新构建了p ET23a(+)-tcvsod重组表达载体,成功表达纯化了带有6×His标签的可溶性重组tcvSOD.该蛋白对邻苯三酚自氧化有明显的抑制作用,抑制率最高可达97%,表现出典型的SOD 酶活特征,并且在质量浓度为0.2μg/m L时达到最大抑制.重组tcvSOD 活性对环境因素胁迫的反应与酶浓度有一定关系,例如终质量浓度为1μg/m L时90℃处理30 min,tcvSOD 相对酶活性仍可达到90%;而酶质量浓度0.1和0.05μg/m L时,42℃下酶活开始下降,90℃时几乎完全丧失;同样质量浓度1μg/m L的tcvSOD 在质量分数2%~10%SDS胁迫下活性相对稳定,而质量浓度为0.1和0.05μg/m L 时对SDS胁迫非常敏感.与上述情况相反,3种质量浓度的tcvSOD 在p H 4~10内均基本保持稳定的活性,表明它有较宽泛的p H 稳定性;同样,各种质量浓度的tcvSOD 其活性不受2~10 mol/L 尿素和1~4 mol/L 盐酸胍胁迫的影响.上述结果均表明,tcvSOD 具有进一步开发应用的潜能.鉴于SOD 在医药、食品、化妆品以及农业领域有广阔的应用潜力,而在化妆品行业已经有了广泛的应用[19-22],开发挖掘具有高活性、耐热耐酸碱、对变性剂及酶解有强抵抗力的SOD 就显得十分必要.无论是纯化自天然的组织细胞中的SODs(如沙丁鱼[23]、山羊[24]、克鲁维酵母[25]),还是用微生物表达的重组SOD(如南极毛草[26]),小球藻病毒PBCV-1编码的tcv-SOD 与它们相比,在稳定性和对胁迫的抗性方面都显得比较突出,因此具有进一步开发利用的价值.
致谢:对河北大学生物工程技术创新中心的杜建芳副研究员在该论文研究中给予的帮助表示感谢.

