芒果苷通过作用于NLRP3炎症小体发挥抗抑郁和神经保护作用
张蕾赵国发李楠乔晓强贾友超
(1.河北大学附属医院 肿瘤内科 河北省肿瘤放化疗机制与规程研究重点实验室,河北 保定 071002;2.河北大学 医学院,河北 保定 071000;3.河北大学 药学院 河北省药物质量分析控制重点实验室,河北 保定 071002)
抑郁症是一种常见的情绪和精神疾病,其主要的临床表现包括身体症状和精神症状,身体症状主要出现疲劳、失眠、食欲不振和性欲下降等,后者的主要表现为情绪低落、兴趣消沉、思维缓慢和记忆力减退等[1].根据世界卫生组织的调查,抑郁症已成为全球第四大常见疾病,全世界至少有4亿人患有该疾病[2].
抑郁症的发生和发展与炎症小体的异常升高密切相关,尤其是血清和脑中炎症小体的升高[3].免疫系统激活和炎性细胞因子在抑郁症的发展形成过程中起重要作用.促炎细胞因子可以诱发动物的病态行为,类似于抑郁症的症状.例如,向动物使用LPS或IL-1β可诱导抑郁症样行为[2].炎症小体是炎症反应的重要组成部分,研究发现NLRP3炎症小体相关蛋白NLRP3、Caspase-1和ASC在抑郁症大鼠模型的血清和大脑海马区中显著性升高[4].
芒果苷(mangiferin,1,3,6,7-四羟基黄酮-C2-β-D-葡萄糖苷,化学分子式为C19H18011,相对分子质量为422)是从芒果的叶子、树皮、果皮和根中提取的天然多酚化合物.现代药理学研究已经发现芒果苷具有多种药理学作用,主要包括抗氧化、抗衰老、抗肿瘤、抗菌、抗病毒、免疫调节、止痛、肝脏保护、抗糖尿病等多种药理学活性[5].有研究表明芒果苷能够发挥神经保护性抗炎作用[6],但它对抑郁症的作用尚不清楚.本研究选择健康的雄性sprague dawley(SD)大鼠建立了慢性不可预测的轻度应激(CUMS)模型,研究芒果苷的抗抑郁和神经保护作用.
1 材料与方法
1.1 药品、试剂与仪器
芒果苷(MGF)购自Alatin公司(中国上海);Bax和Bcl-2的一抗抗体购自Cell Signaling Technology Inc.(美国马萨诸塞州);NLRP1、Caspase-1、IL-1β、IL-6和TNF-α的一抗抗体和氟西汀(Flu)购自Abcam(美国加利福尼亚州旧金山);Caspase-3、ASC和IL-18的一抗购自Santa Cruz Biotechnology(美国加利福尼亚州圣克鲁斯);FITC标记山羊抗兔IgG,中杉金桥,批号:122319A.免疫组化染色试剂盒,中杉金桥,批号:13152A06.SABC 免疫组化试剂盒,武汉博士德生物工程有限公司,批号:06L13BJ.
1.2 慢性不可预见性动物应激模型(CUMS)的建立及分组给药
按照文献[7]报道的方法对健康SD 大鼠进行CUMS干预刺激,刺激方式包括(不仅限于这些方法):1)禁食(24 h);2)禁水(24 h);3)夜间照明;4)笼具倾斜(45°);5)弄脏笼具(按照200 g木屑垫料加水500 m L比例) ;6)明/暗反转;7)夹尾(距离尾巴起点1 cm 持续1 min),刺激时间为每天19:00.对照组动物不受干扰.具体操作见表1,持续作用6周.

表1 6周内给予大鼠慢性不可预测性刺激具体操作Tab.1 Rats were given chronic unpredictability stimulation within 6 weeks
雄性清洁级(SPF)大鼠,模型组分为单纯模型组(Control)、受试药溶剂组(Vehicle)、受试药低中高剂量组(MGF20、MGF40、MGF80)、氟西汀阳性对照组(Flu10).采用灌胃给药(intragastric administration)方式进行药物干预.芒果苷低中高剂量组(mangiferin,MGF,20、40、80 mg/kg),氟西汀阳性对照组采用灌胃给药(10 mg/kg),每次给予大鼠刺激前1 h给药,连续给药2周.
1.3 蔗糖偏爱测试(SPT)
在第0周、第4周和第6周结束时进行蔗糖偏爱测试.大鼠被剥夺水和食物(24 h).每只大鼠被关在一个单独的笼子里,可以自由进入2个装有100 m L蔗糖溶液1 g/m L和100 m L 纯水的瓶子.6 h后,记录蔗糖溶液和水的消耗质量.蔗糖偏爱值由以下公式确定:
蔗糖偏爱值=蔗糖摄入量(g)/[蔗糖摄入量(g)+水分摄入量(g)]×100%.
1.4 自发活动测试(SAT)
在第0周、第4周和第6周,通过自主活动程序(中国医学科学院)测试大鼠自主神经活动,测量大鼠的自发活动计数.程序访问后,将大鼠放入自发活动框,计算机自动记录该大鼠的活动,使大鼠适应3 min,然后记录活动5 min.
1.5 旷场测试(OFT)
测试用于评估小鼠的运动能力(交叉水平运动得分反映运动范围).将大鼠单独放置在一个开阔的野外设备中间的木箱中(80 cm×80 cm×50 cm),将竞技场的地面分成12个相等的正方形.经过2 min的适应后,在3 min的时间里计算了穿越间隔的次数.每次实验后,使用酒精清洁设备.
1.6 强制游泳测试(FST)
在第0周、第4周和第6周CUMS程序结束时进行强制游泳测试.将每只大鼠单独放在一个开放的圆柱形玻璃容器中(高度40 cm,直径20 cm),控制水温在(25±0.5)℃,水面高度为15 cm.统计大鼠在水中5 min内保持静止状态的时间.静止状态的定义是大鼠漂浮在水中只需要很小的动作就可以使头部保持在水上而没有其他多余运动.
1.7 实时定量PCR(qRT-PCR)分析
在所有行为实验之后,通过断头处死大鼠.快速取出海马并保存在-80℃待测.使用Trizol试剂从海马组织中分离总RNA.使用EasyScript First-Strand cDNA Synthesis Super Mix Kit(thermo scientific)合成cDNA,使用TransStart Green qPCR Super Mix UDG 试剂盒(Sangon Biotech)以20μL 进行qRT-PCR,并使用CFX Connect仪器(Bio-Rad)进行分析.表2中显示了该实验中使用的引物序列.每个循环结束时检测到荧光信号.熔解曲线分析用于确认产物的特异性.每组定量PCR 分析重复3次.

表2 RT-PCR 序列Tab.2 RT-PCR sequence
1.8 免疫印迹分析
从海马中获取蛋白质样品,通过BCA 检测蛋白质浓度,各组等蛋白质量上样.一抗采用1∶800体积比稀释的抗NLRP3、抗Caspase-1、抗IL-1β、抗IL-6和抗TNF-α;抗-Bax和抗-Bcl2采用1∶500体积比例稀释;抗Caspase-3、抗ASC 和抗IL-18采用1∶200体积比例稀释.按照标准流程进行聚丙烯酰胺凝胶电泳.通过使用Image-Pro Plus(IPP 6.0)软件的光密度测定法测定目的蛋白的条带与对应内参的条带的比值.
1.9 组织学分析
最后一次刺激24 h后,将大鼠麻醉并快速取出大脑,然后将其固定在4 g/m L多聚甲醛中,将脑包埋在石蜡中,并用切片机切成5μm 的切片.按标准操作对石蜡切片进行染色,观察海马CA1和CA3的形态.
1.10 统计学处理
2 结果
2.1 芒果苷在CUMS抑郁模型中具有抗抑郁作用
在实验开始时(第0周)测得的蔗糖消耗量在各组之间无统计学差异.在CUMS处理4周后,应激组的蔗糖消耗量显著低于对照组.当CUMS处理6周后,CUMS组的蔗糖摄入量显著低于对照组.与溶剂组相比,口服芒果苷(20、40、80 mg/kg)或氟西汀(10 mg/kg)治疗2周的大鼠蔗糖消耗量显著增加(图1a).当CUMS刺激未开始时(第0周),每组大鼠的活动对于自发运动评估几乎没有差异.实验4周后,CUMS组大鼠的自发活动明显降低.口服芒果苷(20、40、80 mg/kg)或氟西汀(10 mg/kg)处理2周的大鼠的自发活动明显增加(图1b).在OFT实验中,实验开始时(第0周)每组的数据无明显差异.口服芒果苷(20、40、80 mg/kg)或氟西汀(10 mg/kg)2周后,模型组的穿线次数明显减少(图1c).在FST 实验中,开始时(第0周)各组静止时间无显著差异.CUMS处理4周后,CUMS各组与对照组相比,大鼠静止时间显著升高,结果具有明显差异,口服芒果苷(20、40、80 mg/kg)或氟西汀(10 mg/kg)2周后,各给药组大鼠水中静止时间显著降低,与对照组相比具有显著性差异(图1d).
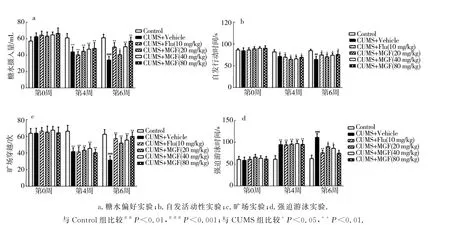
图1 芒果苷和氟西汀对CUMS处理大鼠行为学的影响Fig.1 Effects of mangiferin and fluoxetine on the behavior of CUMS-treated rats
2.2芒果苷阻断CUMS大鼠的海马区损伤
根据结果所示(图2),模型组的CA1和CA3区与对照组相比显示出明显的损伤.阳性对照药物氟西汀可减轻大鼠海马损伤.用免疫印迹法检测海马中的凋亡相关蛋白Caspase-3,Bax和Bcl-2.与对照组相比,模型组的Caspase-3和Bax蛋白水平显著升高,而Bcl-2蛋白水平显著降低,Bax/Bcl-2比值也是如此.口服芒果苷或氟西汀可显著逆转Caspase-3,Bax和Bcl-2蛋白的水平(图3).这些结果表明:芒果苷可阻断海马区的损伤.
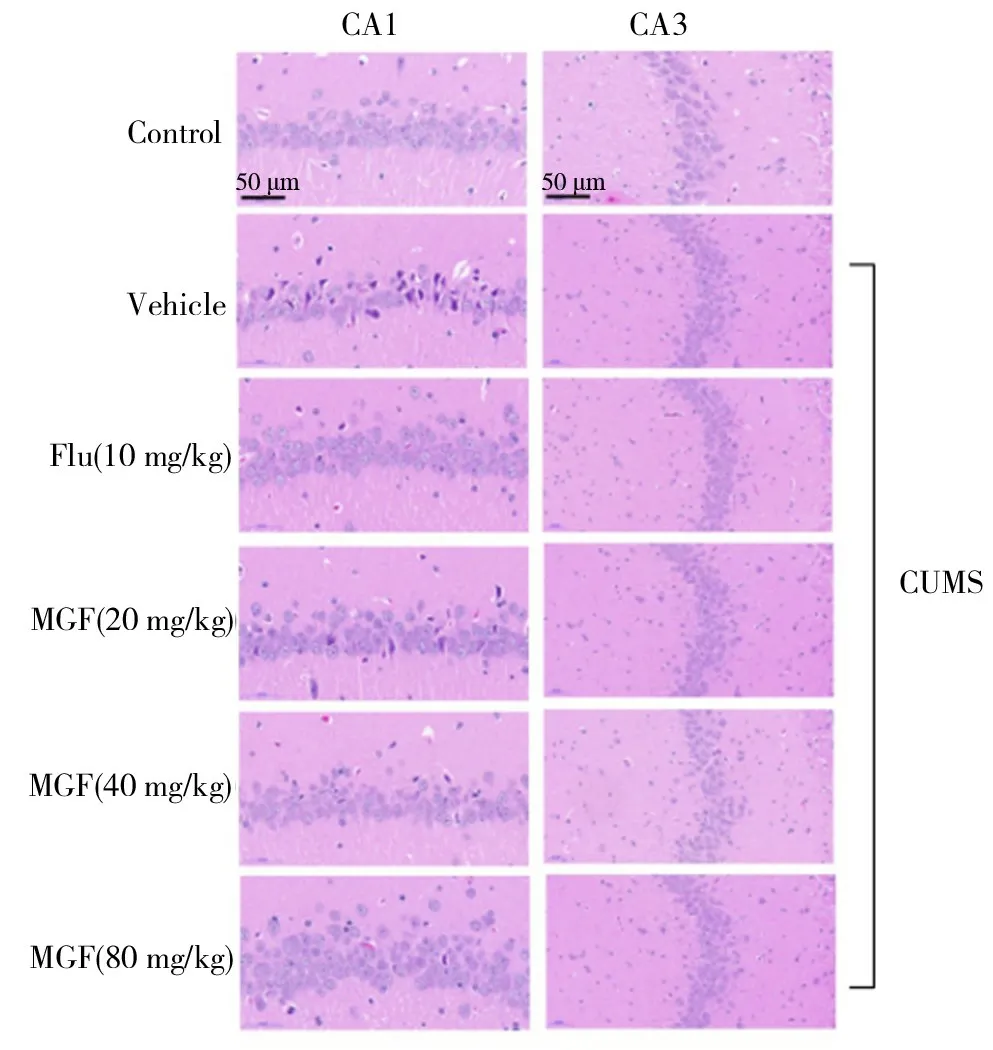
图2 芒果苷对CUMS诱导抑郁症大鼠海马区的保护作用Fig.2 Protective effects of mangiferin on hippocampus of rats with depression induced by CUMS
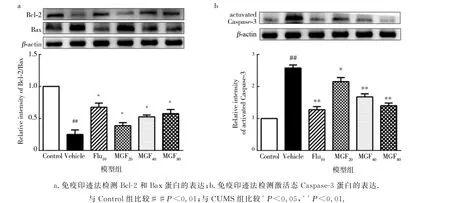
图3 芒果苷对CUMS诱导大鼠海马区凋亡蛋白的影响Fig.3 Effect of mangiferin on apoptosis protein in hippocampus of rats induced by CUMS
2.3 芒果苷抑制CUMS大鼠模型中NLRP3炎症小体的活化
研究表明,抑郁症患者的NLRP3被激活.在蛋白质和mRNA 水平上检查了每组大鼠海马区中的NLRP3炎症小体复合物(图4).与对照组相比,在CUMS处理的大鼠海马区中NLRP3表达水平显著增加.根据实验结果,氟西汀会降低NLRP3蛋白的水平.高剂量的芒果苷(40和80 mg/kg)也抑制ASC和Caspase-1的蛋白水平.此外,在CUMS处理的大鼠中,NLRP1 m RNA、ASC m RNA、Caspase-1 m RNA 的水平明显高于对照组.芒果苷和氟西汀能够抑制由于CUMS模型诱导ASC mRNA、Caspase-1 mRNA、NLRP3 m RNA 的升高.根据实验结果,在该CUMS模型中,芒果苷可以抑制NLRP3炎症小体的活化.
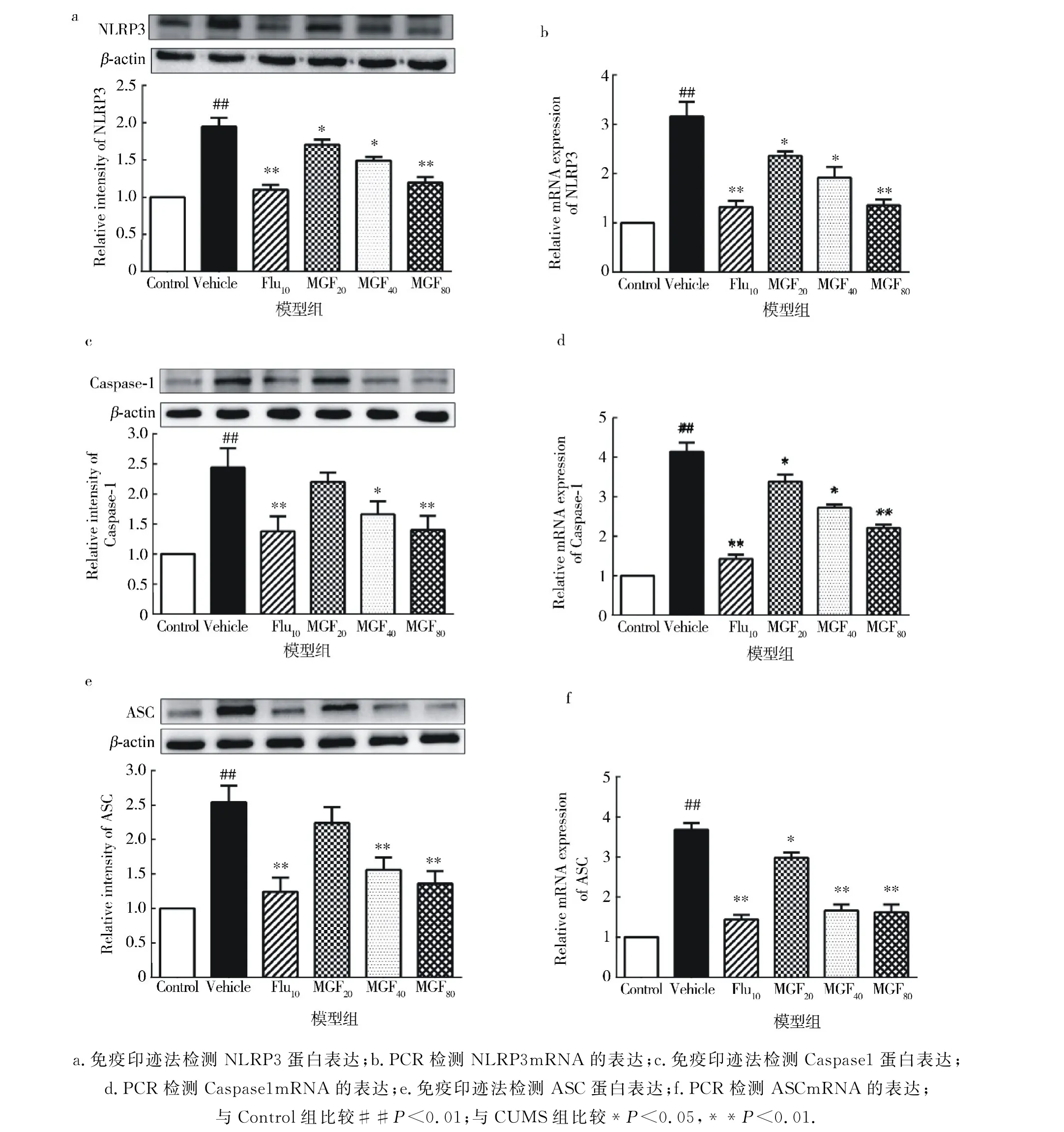
图4 芒果苷对CUMS诱导的大鼠海马区NLRP3炎症小体表达的影响Fig.4 Effect of mangiferin on the expression of NLRP3 inflammasome in the hippocampus of rats induced by CUMS
2.4 芒果苷抑制大鼠CUMS模型中海马区炎性因子的表达
作为先天免疫和炎性反应的关键调节剂,炎症小体可以直接或间接促进炎性细胞因子(例如1L-1β,IL-6,IL-18和TNF-α)的分泌.作者通过免疫印迹法检测了大鼠海马区中1L-1β、IL-6、IL-18、TNF-α的蛋白水平(图5),结果显示芒果苷降低1L-1β和TNF-α蛋白的表达水平;高浓度的芒果苷(40,80 mg/kg)抑制了IL-6和IL-18的水平.这些结果表明:MGF可以抑制CUMS模型中NLRP3的激活.
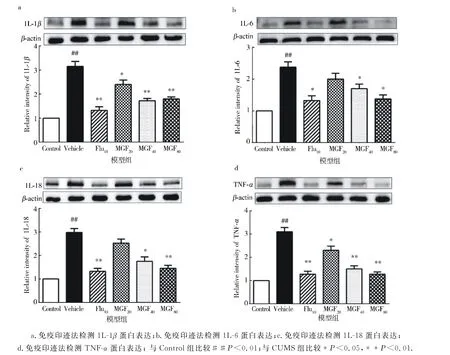
图5 芒果苷对CUMS诱导的大鼠海马区炎症因子表达的影响Fig.5 Effects of mangiferin on the expression of inflammatory factors in the hippocampus of rats induced by CUMS
3 讨论
抑郁症是一种广泛的神经精神疾病,具有高发病率和高复发率.抑郁症是一种复杂的疾病,现有的治疗方法存在较多的不良影响.炎症被认为是抑郁产生的重要原因之一,在抑郁症患者中常伴随着神经炎症反应[8].但神经炎症如何导致抑郁,目前尚不清楚.患有严重抑郁症的患者通常表现出炎症症状,具体表现为外周血和脑脊液中炎症因子水平的升高.慢性应激诱发的抑郁症(CUMS)模型是研究抑郁症的有效方法,被广泛用于探索疾病和抗抑郁药筛选的病理学基础.CUMS模型模拟了抑郁症的核心症状,包括摄入蔗糖、运动和穿线次数行为的减少以及在水中静息时间的增加[9].非甾体抗炎药(NSADs)和细胞因子抑制剂已被用作重度抑郁症(MDD)患者的抗抑郁治疗.环氧合酶(COX)是花生四烯酸代谢为前列腺素的限速酶.COX具有2种主要的亚型,即COX-1和COX-2,在患有慢性不可预测压力的个体的皮质和海马中,COX的表达增加.此外,在抑郁症患者中,促炎性前列腺素E2(PG-E2)水平显著增加[10].建立CUMS模型,通过实验表明,CUMS治疗6周后,大鼠表现出明显的抑郁症状,而MGF 可以明显改善抑郁症状.通过评估糖水偏爱测试(SPT)、自发活动测试(SAT)、旷场实验(OFT)和强迫游泳测试(FST),显示芒果苷改善了大鼠的抑郁症行为(图1).
在抑郁症的动物模型中,外部压力刺激会减少成年海马体内的神经元再生,而抗抑郁药可以阻止这种作用[11].抑郁症患者的多个脑区域通常都有病理变化.海马区经常被发现具有明显的萎缩,萎缩的程度与抑郁症的严重程度相关[12].抑制海马神经元再生是抑郁症的关键病理生理机制之一.抗抑郁药可以促进海马神经元的再生,IL-1β可以通过抑制海马神经元的再生来介导CUMS诱导的抑郁行为[13].芒果苷以剂量依赖性方式减少CUMS治疗后大鼠海马CA1和CA3 区的萎缩(图2).此外,芒果苷以剂量依赖性方式抑制Caspase-3的表达,并增加Bcl-2的表达(图3).这些结果表明,芒果苷可以抑制抑郁症大鼠的海马损伤.
炎症是一种自我保护机制,可限制有害刺激和对身体的损害.神经炎症是许多中枢神经系统病理过程的组成部分,例如自身免疫性疾病,神经退行性疾病,癫痫和抑郁症.炎性小体蛋白复合物首次发现于2002年,当被激活时会释放多种炎性因子,包括IL-1β、IL-6、IL-18和TNF-α.炎性小体介导的途径可产生中枢神经系统损害并诱发动物行为改变[14].最近的研究表明抑郁症患者的NLRP3和Caspase-1水平升高.笔者已经证明了MGF在大鼠模型CUMS中具有抗抑郁和神经保护作用.为了进一步研究MGF的神经保护作用,评估了MGF对NLRP3途径激活的作用.与以前的报道相似,大鼠CUMS模型在m RNA 和蛋白质水平上增加了NLRP3、Caspase-1和ASC的表达.在本实验研究中,笔者证明了芒果苷以剂量依赖性的方式抑制其表达.芒果苷对NLRP3炎性小体的具体作用机制尚不清楚,需要进一步研究.

