食管癌分子分型的遗传学基础
李利艳,敬 佩,李荣耀,李恩民
1999年美国国立癌症研究所提出肿瘤分子分型的概念,即通过综合的分子分析技术进行肿瘤的分类,由以形态学为基础转变为以分子特征为基础的新的肿瘤分类系统。这一观点的提出,推动了以DNA、RNA和蛋白分子在肿瘤中差异表达为基础的分子分型研究的广泛开展。近年来,由于食管癌的遗传学研究不断深入,高通量测序技术不断完善,食管癌的分子分型研究同样发展迅速。大量文献报道了食管癌基因组测序及食管癌遗传异常的研究成果,进一步推进了食管癌变的分子机制研究,为食管癌的分子分型奠定了理论基础。
1 食管癌相关基因突变
利用全基因组测序(whole genome sequencing,WGS)或全基因组外显子测序(whole exome sequencing,WES)等方法,揭示食管癌相关遗传基因的突变情况[1-5],详见表1-2。
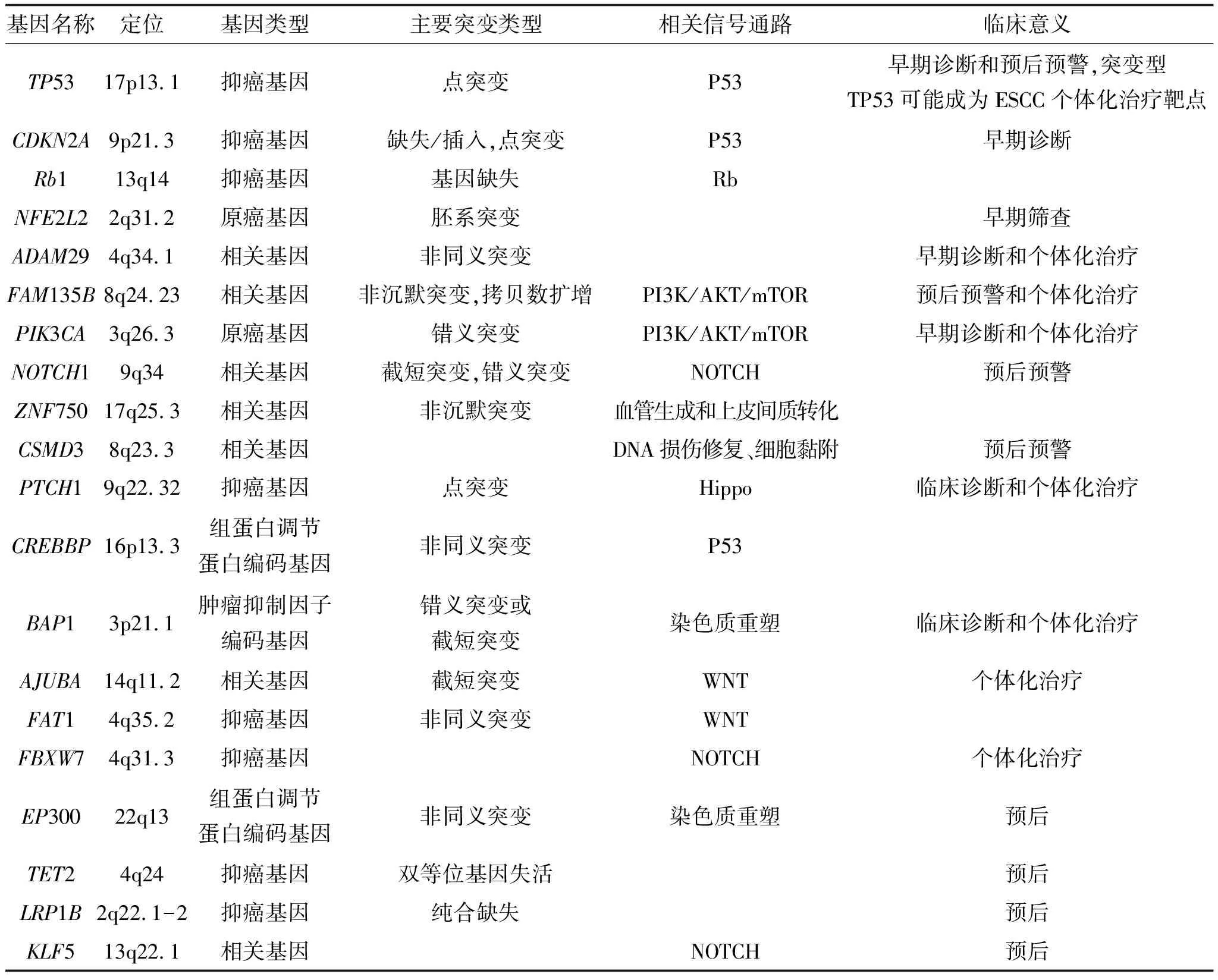
表1 ESCC相关突变基因[1-5]
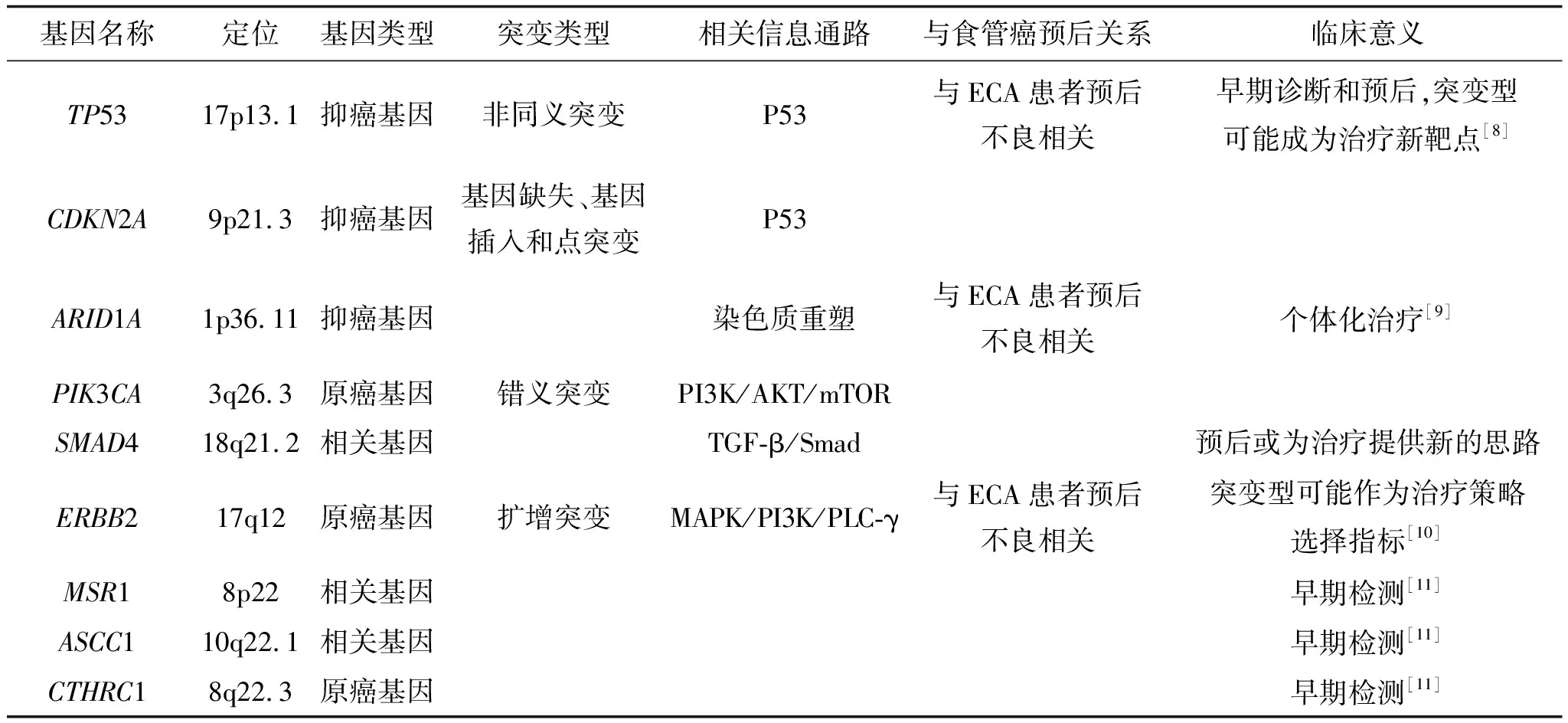
表2 EAC相关突变基因[6-7]
1.1 ESCC相关基因突变
1.1.1NOTCH1人类的NOTCH1基因位于核基因组9q34.3,是蛋白编码基因,其编码蛋白为I型跨膜蛋白,是NOTCH蛋白家族的成员,拥有细胞表面受体和基因转录因子双重功能,主要在脂肪、皮肤和脾脏等组织细胞中表达。从肿瘤相关功能的角度,NOTCH1基因归属于原癌基因的范畴。实验研究发现,NOTCH1基因的突变是ESCC中较常见的原癌基因突变。NOTCH蛋白家族,除了NOTCH 1外,还有NOTCH 2、NOTCH 3和NOTCH 4等,是细胞NOTCH信号通路关键的跨膜蛋白节点,在55%的Ⅰ期ESCC 中有突变,提示NOTCH信号通路在早期ESCC中发挥作用。2016年,Song等用二代测序技术(next generation-sequencing,NGS)分析了104例中国ESCC中NOTCH1基因的突变情况,发现该基因的突变与细胞的分化、病程、癌细胞局部淋巴结转移相关,且NOTCH1基因突变的食管癌患者相较于未突变患者生存期短、化疗抵抗[12]。基于此,该文作者提出NOTCH1基因及其突变或可用于ESCC分子分型,预警ESCC患者预后。
1.1.2FAM135B人类的FAM135B(family with sequence similarity 135,member B,FAM135B)基因位于核基因组8q24.23,其编码的蛋白主要表达于睾丸、大脑和肾上腺等组织细胞。目前,有关FAM135B基因在肿瘤等疾病发生发展中的生物学功能尚不清楚。Song等研究发现,FAM135B在6.8%(6/88)的ESCC组织中发生非沉默性突变,在25%(35/140)的ESCC组织中存在扩增,其突变与ESCC患者的预后不良显著正相关[2]。同样,FAM135B也可能成为ESCC分子分型的重要分子,预警ESCC患者的预后。
1.2 EAC相关基因突变
1.2.1TP53TP53编码p53蛋白,被称为“基因组的守护者”,是人类癌症中最常见的突变基因之一[13],也是EAC中突变频率最高的抑癌基因。WGS和WES研究表明,EAC和发育异常的BE都有高达70%的TP53基因突变率,表明该基因在EAC发病中发挥作用[6,14-15]。另外,突变的TP53基因与EAC患者的不良预后相关,但与肿瘤分期无关[8]。根据TP53基因的突变状态对EAC患者进行分层分析,可能对EAC临床个体化治疗具有指导意义;例如,TP53基因在EAC中的突变状态可以预测对标准化疗方案(如氟尿嘧啶或顺铂)的反应性[16]。
1.2.2ARID1A人类的ARID1A基因位于核基因组1p36.11,是一种重要的抑癌基因,编码一种ATP依赖的染色质重塑因子,属于SWI/SNF重塑复合物成员[17]。在EAC中,ARID1A调节癌细胞的生长增殖和侵袭,且ARID1A敲除的癌细胞增殖能力增强,而ARID1A缺失的癌细胞,ARID1A重新表达可显著抑制癌细胞的增殖[9]。ARID1A的突变广泛存在,且与多种人类肿瘤的发生相关。ARID1A在EAC中的突变率较ESCC中的高[7],与EAC患者的不良预后正相关,可用于EAC分子分型,可能是识别胃肠道肿瘤患者对免疫治疗反应的分子标志物。
2 食管癌相关基因拷贝数变异
拷贝数变异(copy number variation,CNV)是指基因组中大于1 kb的DNA片段,通常在1 kb至3 Mb范围,发生插入、扩增或缺失等变异,可改变相应基因的编码序列,影响基因远距离表达调控,进而影响基因的表型,引起疾病的发生或增加疾病发生的易感性,是一种重要的与疾病易感相关的遗传变异[18]。人群中频率大于1%的CNV也被称作拷贝数多态性(copy number polymorphism,CNP),为常见的CNV。CNV覆盖更多的核苷酸序列,因而可能覆盖更多的功能性基因的DNA,对基因表达和疾病易感性的影响较SNP更大[19]。目前,利用荧光原位杂交技术(fluorescence in situ hybridization,FISH)、NGS以及比较基因组杂交技术(comparative genomic hybridization,CGH)等高通量手段,已鉴定出多个与食管癌相关的基因组拷贝数变异位点[20-21]。然而,迄今为止,有关CNV与食管癌的发生发展、预后及治疗等的研究尚少。
2.1 ESCC相关基因拷贝数变异
人类的PIK3CA基因位于染色体3q26.3,共包含20个外显子,编码磷脂酰肌醇-3-激酶(phosphatidylinositol-3-kinase,PI3K)的催化亚基p110ɑ。PIK3CA基因突变在人类恶性肿瘤中十分常见,近1/3人类实体肿瘤存在PIK3CA突变,且突变形式多样,包括缺失和扩增等[22]。PIK3CA基因突变导致PI3K/PTEN/AKT/mTOR信号通路的异常活化,进而影响ESCC的发生发展[23]。Shigaki H等研究发现,发生在PIK3CA基因第九和第十二外显子的突变与ESCC较好的预后呈正相关[24]。因此,通过PIK3CA基因CNV探索ESCC生物分子标记物具有广阔的临床应用价值。然而,PIK3CA突变在ESCC发生发展中的机制依然不清楚。
2.2 EAC相关基因拷贝数变异
人类的ERBB2基因,又称HER2基因,位于核基因组17q12,隶属于细胞表皮生长因子受体酪氨酸激酶基因家族,是重要的原癌基因,与家族其它成员EGFR/HER1、HER3和HER4共同形成了一个广泛的信号网络,促进肿瘤细胞增殖、抑制肿瘤细胞凋亡、促进肿瘤细胞迁移。HER2蛋白二聚化通过促分裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)、磷酸肌醇-3激酶(phosphoinsitide-3-kinase,PI3K)和磷脂酶 C(PLC)-γ,至少3种途径进行信号传递。与PI3K途径不同,HER2蛋白的多种二聚体(HER1/HER2、HER2/HER3和HER2/HER4)均可激活MAPK途径。在EAC中,ERBB2基因存在着普遍的癌性扩增,但扩增部位及其与EAC发生发展和预后的相关性尚待深入研究。有研究显示,对于HER2阳性EAC患者,采用曲妥珠单抗和帕妥珠单抗联合放化疗进行新辅助治疗,相较于对照组,其安全性、耐受性及初步疗效更好[25]。因此,ERBB2/HER2可作为EAC分子分型的潜在分子标志物,用于指导EAC化疗药物的选择。
3 食管癌相关基因单核苷酸多态性
单核苷酸多态性(single nucleotide polymorphisms,SNPs)是由于基因组序列中的单个核苷酸(A、T、G和C)的替换而引起的多态性,而碱基的插入、缺失以及重复序列拷贝数的变化通常不属于SNP[26]。一个SNP表示在基因组某个位点上有一个核苷酸发生的变化,主要由单个碱基的转换或颠换所引起。SNP具有以下特点:数量多,广泛分布在人群中;遗传稳定性高,可以标记不同个体特定位点上的基因型、分析特定基因在群体中的基因频率以及不同个体之间表型差异的遗传基础等;易于基因分型与筛查。以往,曾有人运用全基因组关联分析(genome-wide association study GWAS)鉴定与食管癌相关的SNPs变异位点[27]。若将这些位点与食管癌预后之间的关联及其相关分子机制进行深入探讨,将有助于实现实验室结果与临床表型相结合,进而指导食管癌的早期诊断及个性化靶向治疗。
3.1 ESCC相关基因单核苷酸多态性
人类的PLCE1基因位于染色体10q23,是长度334.3 kb的单拷贝基因[31]。该基因所编码的蛋白 PLCε1属于磷脂酶C家族,具有复杂的分子结构与作用机制。与ESCC相关的PLCE1基因的多态性位点有rs2274223、rs11187842、rs11187870、rs3765524、rs3781264和rs753724等。Abnet等学者报道了PLCE1基因错义突变位点rs3765524的多态性与ESCC存在相关性[32]。然而,有关该位点核苷酸变化情况及与ESCC预后的关系尚存在争议。
3.2 EAC相关基因单核苷酸多态性
Gharahkhani等利用PubMed中的BE及EAC相关GWAS结果进行Meta分析,确认了8个新的BE或EAC风险基因位点:rs17451754、rs17749155、rs10108511、rs62423175、rs9918259、rs7852462、rs139606545和rs9823696,分别在CFTR、MSRA、LINC00208、BLK、KHDRBS2、TPPP、CEP72、TMOD1、SATB2、HTR3C、ABCC5等基因之中或其附近[30]。然而与之相关的功能与机制方面的研究甚少,其临床价值如何也有待研究。
4 食管癌相关融合基因
基因融合(gene fusion)是指由于某种机制(如基因组变异)使得两个在不同部位的基因,部分或全部序列融合到一起,形成一个新的基因。融合基因的产生常见于如下3种机制:①染色体易位(chromosomal translocation);②中间缺失(interstitial deletion);③染色体倒位(chromosomal inversion)。在此过程中,产生了可能与各种癌症发生发展紧密相关的融合基因。融合基因的致癌机制主要有以下几种:①原基因的部分序列缺失,导致基因调控区(如5′-UTR和3′-UTR)改变或者编码的蛋白重要结构域缺失,进而改变原基因的表达调控或所编码蛋白的结构与功能,参与癌症发生;②启动子交换使得原本调控原癌基因的区域被其他基因置换,进而导致原癌基因的转录异常;③基因融合后所编码的嵌合蛋白,失去其原有的结构与功能。目前已发现了一些食管癌相关融合基因,但数量较少,其功能与临床意义也有待研究探讨[35]。
4.1 ESCC相关融合基因
有研究报道,成纤维细胞生长因子(fibroblast growth factor,FGF)信号异常激活、FGF受体(fibroblast growth factor receptor,FGFR)表达、FGFR编码基因转录物选择性剪接、FGFR突变或易位或FGF的可利用性升高均增加患癌风险[33]。另外,Mizukami等研究发现,FGFR3的外显子18和TACC3的外显子11之间融合,形成FGFR3-TACC3融合基因。尽管该融合基因在ESCC中的发生频率只占1%,但是携带该融合基因的患者可以从酪氨酸激酶抑制剂治疗中获益[34]。然而,有关该融合基因在ESCC发生发展中的作用尚不清楚。
4.2 EAC相关融合基因
目前,EAC相关融合基因尚鲜有研究。2016年,Andrew等通过RNA-seq(RNA sequencing)发现,在大约10%的EAC病例中,发生RPS6KB1-VMP1基因融合。VMP1和RPS6KB1基因均位于17q23.1,同向,VMP1基因位于RPS6KB1基因的5′端;然而,基因融合后,VMP1基因位于融合基因的3′端。RPS6KB1-VMP1是一种通过调节自噬相关过程促进EAC的融合基因,融合基因阳性的EAC患者总生存率明显降低。因此,该融合基因可能作为EAC诊断的生物分子标志物,协助判断EAC患者的预后。
综合而言,基于临床特征、病理分型和分子分型的个体化治疗方案对进展期食管癌非常重要。未来食管癌的治疗模式将会逐渐发展为分子分型指导下的个体化治疗。

