超声多模态成像鉴别肝脏局灶病变良恶性的价值*
王璐,卢漫,吴晓波,谭波,何发伟,邹世彬
610041成都,四川省肿瘤医院·研究所,四川省癌症防治中心,电子科技大学医学院 超声医学中心
超声检查是评估肝脏局灶性病变(focal liver lesions,FLLs)最常用的方法[1-2],其通过判断FLLs的位置、形状、内部回声及血流信号等特点来判断FLLs的性质,但是这些特征往往不能够准确诊断FLLs[3]。近年来,超声造影、剪切波弹性成像逐渐用于FLLs的研究,明显提高肝脏局灶性病变良恶性判断的准确性[4-6]。但是用剪切波弹性成像(shearwave elastography,SWE)+超声造影(contrast-enhanced ultrasound,CEUS)联合诊断FLLs的研究较少[7]。本研究通过对129个肝脏局灶性病变的研究评估常规超声、CEUS、SWE及CEUS+SWE联合对FLLs良恶性的诊断价值。
1 资料和方法
1.1 研究对象和资料
2018年9月至2019年9月期间,前瞻性纳入于四川省肿瘤医院行超声检查发现肝脏局灶性病变的85例患者,共150个FLLs,纳入标准:1)肝内实性病变,病灶直径>10 mm;2)病灶深度<80 mm,距肝脏包膜大于10 mm;3)患者可以满足屏气15 s以上的要求。排除标准:1)肝脏囊性病变;2)FLLs位置特殊靠近大血管、胆管或心脏者;3)有造影剂过敏史者;4)有不能纠正的凝血障碍、严重心血管疾病、体内有金属物件植入者(CE-MRI禁忌证);5)妊娠。
以临床诊断标准为金标准。临床诊断不能确定者行穿刺活检,以病理结果为金标准。具体为: 1)肝细胞癌(hepatocellular carcinoma,HCC):①有肝炎/肝硬化背景:a. 结节1~2 cm:增强CT和增强MRI两项检查均表现典型(动脉期高增强、门脉期/延迟期低增强);b. 结节>2 cm:具备下列2项之一:增强CT或增强MRI表现典型;甲胎蛋白(alpha fetoprotein,AFP)>200 ng/mL;②无肝炎/肝硬化背景:a. 结节≤2 cm:需病理诊断;b. 结节>2 cm:增强CT或增强MRI表现典型+AFP>200 ng/mL。2)转移性肝癌:肝内新病灶有典型增强CT或增强MRI表现+原发病诊断确切。3)肝血管瘤、灶性结节性增生(focal nodular hyperplasia,FNH):肝内病灶有典型的增强CT或增强MRI表现+随访至少1年无变化。4)肝脓肿:穿刺引流出脓液[8]。进行操作前获得所有患者的书面知情同意签字。
1.2 仪器与方法
由一名有5年以上肝脏超声诊断经验并熟练弹性成像及超声造影技术的超声科医生使用Supersonic Imagine Aixplorer的SC6-1凸阵探头(频率1~6 MHz,配备SWE成像技术)及Philips EPIQ 7超声诊断仪的C5-1探头(探头频率为1~5 MHz)完成所有FLLs的常规超声、SWE、CEUS检查(其中常规超声、CEUS检查使用两种机器均可,SWE检查仅使用(Supersonic Imagine Aixplorer)。
具体操作流程为:1)患者准备:检查前空腹4~6 h;2)常规超声检查:患者仰卧位,暴露腹部,启动二维超声模式扫查肝脏,发现FLLs后调整探头,选择FLLs显示最佳切面,观察其形态、大小、边界及回声情况并记录,并启动彩色多普勒血流显像观察病灶内及病灶周边的血流情况并记录;3)CEUS检查:常规超声检查结束后尽量在显示最佳切面将FLLs置于屏幕中央,探头位置不变,进入超声造影实时双幅模式,调整深度及增益,使双幅超声造影模式下二维超声平面的FLLs病灶显示最佳,然后经肘静脉推注事先准备好的超声造影剂Sonovue(Bracco,Milan,Italy),待生理盐水冲管结束后开启计时器,同时机器开始视频录像,在此切面实时动态观察目标FLLs超声造影模式,持续固定探头120 s后可移动探头观察肝内其他部位以检出二维超声模式遗漏的FLLs,2 min、3 min、4 min时可分别再次固定探头到之前的FLLs观察10 s后移开行全肝检查,动态观察及录像持续4 min;4)SWE检查[均使用Supersonic Imagine Aixplorer的SC6-1凸阵探头(频率1~6 MHz,配备SWE成像技术)完成]:超声造影结束后嘱患者休息20min后行SWE检查,找到FLLs并使其显示最佳,尽量避开大血管、胆管等,然后启动弹性成像模式,调整取样框大小:①病灶小者,取样框囊括FLLs及部分周围正常肝组织;②病灶较大超过机器内置取样框大小者,取样两次(a.取样框置于病灶中央,b.取样框置于病灶边缘包括部分病灶和部分周围肝组织),并调整弹性图像量程为70 Kpa(图像中红色代表病变质地较硬,蓝色代表病变质地较软,SWE数值越大则提示组织越硬),嘱患者屏住呼吸,观察弹性成像彩色图像,等其无马赛克且充满取样框二分之一以上范围并稳定3~5 s时定帧,存取图像,使用内置Q-Box & Q-Box Ratio定量分析工具选用相同大小的感兴趣区域 (region of interest,ROI)(10 mm×10 mm)测量病灶及周围肝脏组织的杨氏模量值并记录。
1.3 图像分析
由1名具有5年肝脏超声诊断经验的超声医师完成所有患者的常规超声、CEUS及SWE检查并在超声机器内存储影像资料。获得的资料由另外两名不少于 5 年超声造影工作经验的超声医师进行分析,需详细描述所分析FLLs的常规超声、CEUS及SWE 声像特点(图1~3),并根据相应的声像特点判断FLLs的良恶性。判断良恶性时遵循以下标准:1)常规超声判断FLLs:①边界不清晰;②内部回声不均匀;③形态不规则;④后方回声衰减。良性病变:满足<前述2条标准,恶性病变:满足≥前述2条标准者[9]。2)超声造影诊断FLLs:观察FLLs开始增强时间、增强程度、开始消退时间以及各个时相的增强模式,参照标准为周围正常肝组织增强模式及增强时间,诊断依据为《肝超声造影应用指南(2012年修改版)》[10];3)SWE判断FLLs良恶性标准为:绘制SWE三个参数ROC曲线所得的截断值:E-max为34 Kpa,E-mean为22.8 Kpa,E-min为13.0 Kpa。SWE参数大于截断值诊断为恶性,小于截断值诊断为良性。
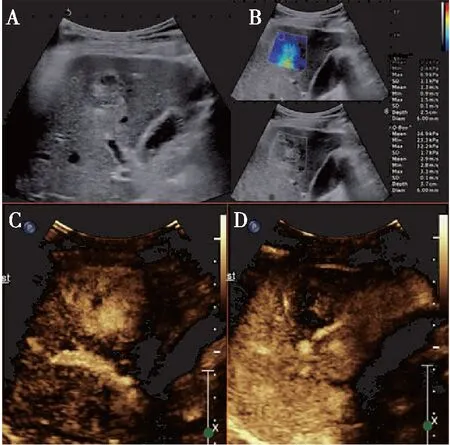
图1 超声多模态成像诊断FLLs
1.4 统计分析
统计分析使用Medcalc 15.2软件和SPSS 20.0软件进行,用方差分析比较FLLs良恶性E-max、E-mean、E-min之间的差异,差异有意义定义为P<0.05,最终诊断结果作为标准,利用Medcalc 15.2软件分别绘制常规超声、CEUS、SWE诊断FLLs良恶性的ROC曲线,在得出的结果中选择Youden指数最大时的临界值及相应的准确率、阳性预测值、阴性预测值、灵敏度、特异性。SWE+CEUS联合诊断定义:1)超声造影诊断为恶性,如SWE三个值均为良性(以之前所得截断值为界),则SWE+CEUS联合诊断的结果判为良性;如SWE三个值有一个值为恶性,则SWE+CEUS联合诊断的结果仍判为恶性。2)超声造影诊断为良性,如SWE三个值均为恶性,则SWE+CEUS联合诊断的结果判为恶性;如SWE三个值有一个为良性,则SWE+CEUS联合诊断的结果仍判断为良性。

图2 超声多模态成像诊断FLLs
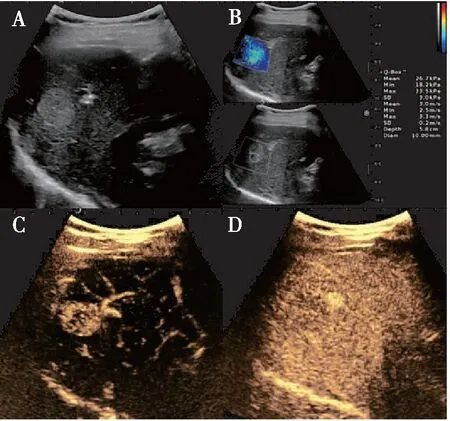
图3 超声多模态成像诊断FLLs
2 结 果
对纳入研究的85例患者所含有的150个FLLs进行二维超声、CEUS及SWE检查。其中10例患者的21个FLLs因SWE检查过程中不能获取无马赛克且充满取样框1/2以上范围的图像而排除研究,最后,75例患者的129个FLLs纳入统计,其中男性43名,女性32名,平均年龄(52.09±12.47)岁,包括良性病变51个,恶性病变78个。
SWE结果显示恶性病变杨氏模量参数E-max、E-mean、E-min的平均值大于良性病变杨氏模量平均值,且良恶性病变平均杨氏模量值之间差异有统计学意义(P<0.05,表1)。E-max及E-mean单独诊断FLLs良恶性的AUC值大于CEUS单独诊断(Pmax=0.797,Pmin=0.050),E-min单独诊断的AUC值小于CEUS单独诊断(P=0.774)(表2、图4),差异均无统计学意义。SWE+CEUS联合诊断FLLs良恶性的AUC值大于CEUS和SWE三个参数单独诊断,差异有统计学意义(表2、图4)。
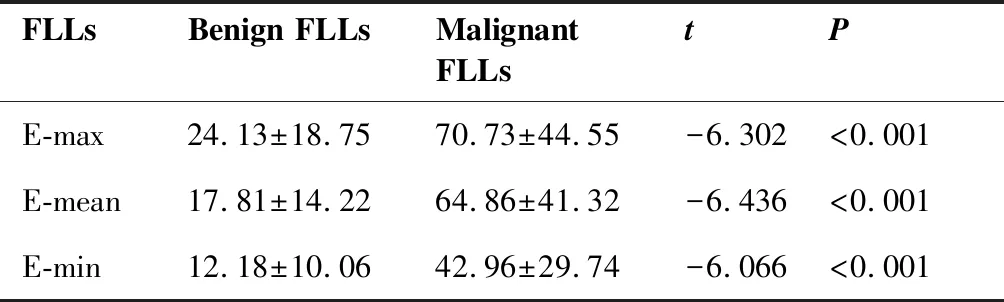
表1 良恶性FLLs的E-max、E-mean及E-min值
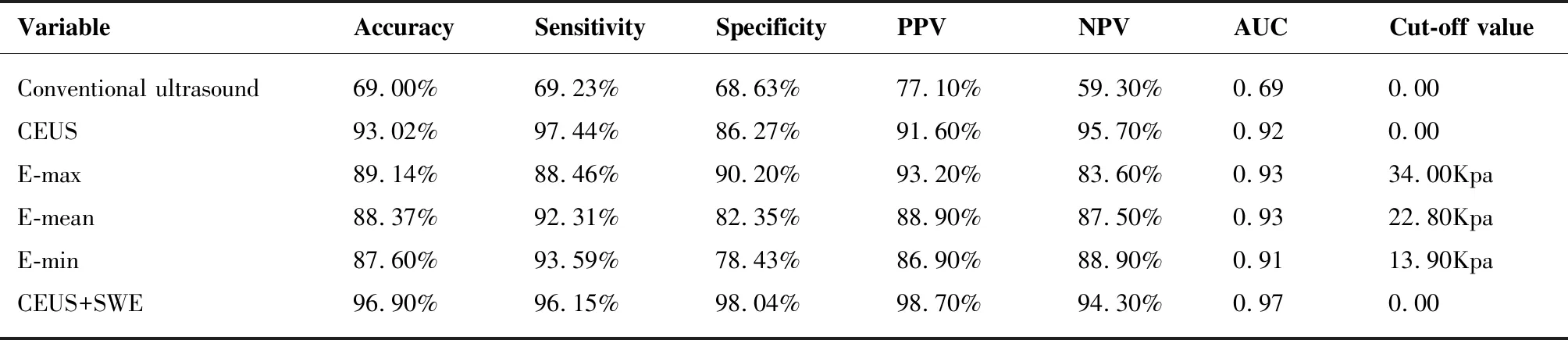
表2 常规超声、CEUS、SWE不同杨氏模量值、CEUS+SWE诊断FLLs的价值
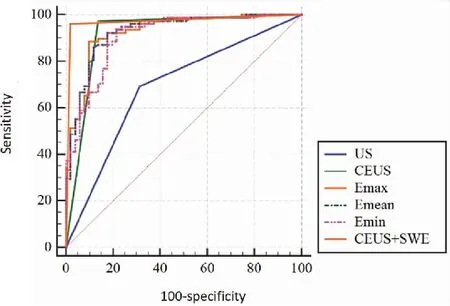
图4 各种超声成像方式诊断FLLs的ROC曲线
3 讨 论
FLLs的发现率随影像技术的发展不断增高,FLLs有良恶性之分,包含许多不同的种类,不同的FLLs有各自的治疗方式和预后,区别较大。肝癌是典型的恶性FLLs,我国肝癌的发病率及死亡率均居恶性肿瘤的前列[11],而早期诊断和治疗被认为是提高生存率和改善预后的有效方式[12],因此,早期判断检出的FLLs的良恶性非常重要。在FLLs良恶性的诊断中,影像检查是较重要的一步,其包括CT、MRI、超声等。超声检查作为其中一种影像检查方式有着不可替代的作用。
常规超声由于具有方便、价格低、无辐射的优点被推荐为肝癌筛查的首选检查。但是常规超声仅根据病灶形态、边界、内部及后方回声和彩色多普勒血流特点来鉴别FLLs类型。具有典型常规超声声像图特征的FLLs虽然可以通过前述特点判断良恶性。但大部分FLLs的常规超声声像图特征没有特异性,且各类型及良恶性结节的声像图特征之间存在交叉,所以鉴别FLLs类型时常规超声局限性较大,有学者使用常规超声鉴别94例FLLs的类别得出结论为:二维超声对HCC、原发性胆管细胞癌(cholangiocellular carcinoma,CCC)、转移性肝癌、血管瘤、肝脏FNH、硬化结节、不均匀脂肪肝的诊断准确性分别为:84.61%、40.00%、10.00%、75.00%、33.33%、60.00%、50.00%[13]。另一项研究也表明在鉴别FLLs良恶性时,常规超声的准确性、特异性、敏感性仅分别为75.6%、75.0%、75.9%[9]。本研究结果发现,常规超声鉴别FLLs良恶性的敏感性、特异性、阳性预测值、阴性预测值、准确性分别为69.2%、68.6%、77.1%、59.3%、69.0%,不能满足精准医疗的要求。
超声造影的出现改善了超声诊断FLLs准确性低的现状。在Mansour等[14]的研究中,CEUS诊断FLLs良恶性的敏感性为94.2%、特异性为88.9%、准确性为92.3%。在Hohmann等[15]的研究中发现,CEUS将诊断的敏感性、特异性及准确性分别从常规超声的66%、54%、50%提高到96%、76%、72%。有学者研究儿童FLLs的CEUS检查,其特异性为98.0%,阴性预测值为100%,研究中没有出现造影剂导致的副反应[16]。对于横断面检查(CT或MRI)诊断不明确的FLLs,CEUS诊断的准确性和特异性分别为92%和98%[17]。本研究结果发现,CEUS诊断FLLs的敏感性为97.4%、特异性为86.3%、阳性预测值为91.6%、阴性预测值为95.7%、准确性为93.02%,诊断效能明显优于常规超声(P<0.001)。
SWE是新的超声成像技术,在FLLs的研究中逐渐增多,对FLLs类型及良恶性的鉴别有一定优势[18]。2013年Guibal等[19]的研究发现SWE可在一定程度上鉴别FNH和肝细胞腺瘤,以及鉴别CCC和HCC。在Tian等[20]的研究中对FLLs和邻近肝实质的E-max值进行对比,发现两者之间的差异对鉴别FLLs良恶性有益。本研究的结果显示SWE鉴别FLLs良恶性的能力明显高于常规超声。但是我们的研究同样也显示良恶性FLLs杨氏模量值之间存在交叉,所以SWE单独用于诊断FLLs良恶性存在误差。
临床诊断可以联合使用2种或2种以上技术以提高诊断的整体效果,当利用两种或两种以上超声检查技术成像时,称为多模态超声成像,目前关于多模态超声的研究主要集中在甲状腺、乳腺、淋巴结等,主要是国内研究[21-23],在肝脏局灶性病变中的应用较少。宋毅等利用SWE和CEUS联合诊断FLLs,发现SWE联合CEUS诊断FLLs良恶性的价值最高,在临床应用中SWE可作为辅助CEUS诊断FLLs良恶性的方[24]。本研究用SWE+CEUS联合诊断FLLs良恶性,其AUC为0.942,灵敏度、特异度、阳性预测值、阴性预测值及准确率分别约96.2%、98.0%、98.7%、94.3%、96.9%,明显大于E-max、E-mean、E-min及CEUS单独诊断,故联合方法或有助于提高诊断效能。
本研究的局限性:纳入的样本数量有限;由于诊断的特殊性部分结节未使用活检结果作为金标准。
综上所述,CEUS及SWE能有效鉴别FLLs良恶性,诊断效能明显优于常规超声,相比单纯SWE或CEUS诊断,SWE+CEUS联合诊断的AUC、灵敏度、特异度、阳性预测值、阴性预测值及准确率最高,SWE+CEUS联合诊断能进一步提高超声对FLLs良恶性鉴别的诊断效能。
作者声明:本文全部作者对于研究和撰写的论文出现的不端行为承担相应责任;并承诺论文中涉及的原始图片、数据资料等已按照有关规定保存,可接受核查。
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统的学术不端检测。
同行评议:经同行专家双盲外审,达到刊发要求。
利益冲突:所有作者均声明不存在利益冲突。
文章版权:本文出版前已与全体作者签署了论文授权书等协议。

