面包酵母β-葡聚糖颗粒负载甲氨蝶呤抗急性单核细胞白血病的体外研究*
陈妍灵,孙莹,罗子怡,张冬冬,江宏强,灿灿,谭御心,周芙玲,许小娟
430071 武汉,武汉大学中南医院 血液内科(陈妍灵、罗子怡、江宏强、灿灿、谭御心、周芙玲);430072 武汉,武汉大学 化学与分子科学学院(孙莹、许小娟);441000 湖北 襄阳,湖北医药学院附属襄阳市第一人民医院 肿瘤科(张冬冬)
急性单核细胞白血病(acute monocytic leukemia,AMoL)是一类血液系统的恶性肿瘤,是急性髓系白血病(acute myeloid leukemia,AML)FAB分型中的M5型,占儿童AML的20%,在婴儿AML中占比甚至超过一半[1]。临床上,该病常表现为白细胞增多、髓外浸润和凝血功能异常[2]。该病治疗以药物化疗、骨髓移植以及支持治疗为主,但易耐药复发,患者生存率低下[3]。甲氨蝶呤(methotrexate,MTX)为二氢叶酸还原酶抑制剂,化学结构与叶酸相似,是一种抗代谢和抗叶酸药物,可干扰DNA、RNA和蛋白质的形成。MTX广泛应用于治疗实体瘤、血液系恶性肿瘤和自身免疫疾病,如乳腺癌、白血病、类风湿关节炎等[4-5]。然而MTX在水中的不溶性和低生物利用度限制了其临床应用[6]。MTX对热和光敏感,暴露后易分解,在20℃蒸馏水中的溶解度只有0.01 mg/mL,并且是pH依赖性的,易溶于稀碱,微溶于稀盐酸,合适pH值为6.6~8.2[7]。肾脏能在短时间内消除大量的MTX,血浆半衰期只有4.5~10 h[8]。由于其半衰期短且消除率高,临床上需要高剂量给药,但低水溶性会导致其生物利用度低,更重要的是高剂量的MTX导致许多严重的毒性作用,例如骨髓抑制、肝毒性、肾毒性、神经毒性和肺毒性[9-10]。为了降低毒性并提高治疗效果,需要开发新型MTX缓释递送系统。本次研究制备了以面包酵母β-葡聚糖(baker’s yeast-derived β-glucan,BBG)为载体、以生物相容性海藻酸钙凝胶(alginate gel crossed by Ca2+,Alg)进行封装的MTX缓释体系(以下简称:BBG/MTX/Alg),并对结构进行表征,初步探究了其体外抗急性单核细胞白血病的毒性及安全性。
1 材料与方法
1.1 材料与试剂
面包酵母多糖购于东方酵母有限公司(日本,东京),由神户大学Hishoshi Ashida教授友情提供,β-葡聚糖含量约为75%;氢氧化钠(NaOH)、盐酸(HCl)、氯化钙(CaCl2)、二甲亚砜(DMSO)等化学试剂购自国药集团,由申试化工提供;MTX购自Sigma-Aldrich(St. Louis, MO);海藻酸钠(32~250 kDa)购自上海源叶生物技术有限公司,并测定其在25℃下0.1 M NaCl水溶液中的特性粘度([η])为12.562 dL/g;胎牛血清,胰蛋白酶,购自Gibco;RPMI-1640培养基,DMEM培养基,IMDM培养基,PBS缓冲液,购自Hyclone;双抗(青霉素和链霉素) ,购自Biosharp;CCK-8试剂盒,购自日本同仁;Annexin V-FITC/PI细胞凋亡试剂盒,细胞周期试剂盒,购自联科生物。
1.2 细胞系及培养
人急性单核细胞白血病细胞株THP-1和MV-4-11购自中国科学院(上海)细胞库。正常细胞株小鼠胚胎成骨细胞MC3T3-E1、人成骨细胞hFOB1.19由武汉大学中南医院科学研究中心保存。THP-1培养于含10%胎牛血清和1%青霉素-链霉素的RPMI-1640培养基;MV-4-11培养于含10%胎牛血清和1%青霉素-链霉素的IMDM培养基;MC3T3-E1、hFOB1.19培养于含10%胎牛血清和1%青霉素-链霉素的DMEM培养基。以上细胞均于37℃,5% CO2条件下培养。
1.3 主要仪器与设备
紫外分光光度计,Shimadzu UV-2600,日本;X射线粉末衍射(X-ray diffraction,XRD)仪,Rigaku Miniflex600,日本;透射电子显微镜(transmission electron microscope,TEM),JEM-2100F,日本;细胞计数仪,Thermo,德国;恒温细胞培养箱,Heraeus,德国;超净台,苏州苏净;酶标仪,UNICO,上海;流式细胞仪,BD,美国;电子分析天平,Sartorius,德国。
1.4 方法
1.4.1 BBG/MTX/Alg的制备 基于MTX易溶于稀碱,微溶于稀盐酸的特性,采用溶解-沉淀法[11]制备BBG/MTX/Alg,具体步骤为:将250 mg MTX粉末分散在5 mL去离子水中,添加3.5 mL浓度为0.25 M的NaOH溶液,从而得到澄清的MTX·2Na溶液。然后加入1 g BBG,持续搅拌12 h后离心收集上清。根据上清体积,加入适量HCl中和,搅拌10 min,同时使BBG内部MTX沉淀。离心收集沉淀,超纯水清洗后冻干。为了进一步将MTX固定在BBG中,将BBG/MTX冻干粉浸泡在0.5%的海藻酸钠中并搅拌6 h。 5 000 rpm离心10 min,弃上清。将沉淀边添加边搅拌至50 mL 2% CaCl2溶液中,随后静置15 min,离心去上清,沉淀用超纯水漂洗后冻干,便得到水凝胶固定包裹在BBG中的MTX(BBG/MTX/Alg)。BBG/MTX/Alg为黄色粉末,室温避光保存于干燥器中。
1.4.3 XRD 通过粉末衍射仪测定BBG、MTX、BBG/MTX/Alg的X射线衍射光谱,扫描区域设置为2θ=3°~40°,步距为0.02°,扫描速度为2°/min。
1.4.4 载药量测定 将BBG/MTX/Alg溶于DMSO,并使用紫外分光光度计在303 nm处测量其紫外吸收。配置MTX溶于DMSO的不同浓度标准品,并测定其紫外吸收,得到标准曲线。基于标准曲线得到载入MTX的重量,再根据公式载药量(%)=(载入MTX的重量/BBG/MTX/Alg的总重量)× 100%计算MTX在冻干BBG/MTX中的载药量。
1.4.5 体外药物模拟释放 模拟药物体外胃肠道释放条件:胃液pH通常位于1~2之间[12],食物或药物停留大约1~3 h,使用0.04 M HCl溶液作为模拟缓冲液,pH值为1.2;肠液pH值约为5.5~7.5[12],使用0.9% NaCl缓冲液作为模拟缓冲液,pH值为7。称取5 mg BBG/MTX/Alg载药颗粒,分散于1 mL 0.9% NaCl溶液,置于截留分子量8~10 kDa透析管中。将透析管放置于80 mL胃液模拟液(pH1.2的HCl溶液)中,37℃下70 rpm模拟释放。在设定时间点取出1 mL模拟液,并迅速加入等量新鲜模拟液。使用紫外分光光度计在303 nm下测量紫外吸收,并计算MTX的累积释放量。2 h后将透析管转移至80 mL肠液模拟液(pH7的0.9% NaCl溶液),后期实验步骤同上。模仿药物体外缓冲液释放条件:使用0.9% NaCl溶液作为释放介质,测量方法同上。
1.4.6 细胞增殖/毒性实验(CCK-8法) 取实验细胞用台盼蓝染色后,使用细胞计数仪计数并测定细胞活力。取2×104/100 μL每孔的标准均匀铺于96孔板中,每个试验孔至少设计三个副孔,培养箱孵育过夜后进行药物处理。根据预实验结果,设定实验组BBG/MTX/Alg用生理盐水稀释至终浓度为50、100、200、400 ng/mL,对照组为等量生理盐水。根据实验设计处理相应时长后,每孔加入10 μL CCK-8检测工作液,混合均匀后置于培养箱避光孵育1~4 h,用酶标仪检测450 nm处吸光度值(OD值),再根据公式细胞存活率(%)=(实验孔OD值-空白对照孔OD值)/(对照组OD值-空白对照孔OD值)×100%计算细胞存活率。
1.4.7 细胞凋亡检测(Annexin V-FITC/PI) 取实验细胞1×106/2 mL每孔的标准均匀铺于6孔板中,培养箱孵育6 h后进行药物处理。根据预实验结果,实验组BBG/MTX/Alg终浓度为1 μg/mL,对照组用等量生理盐水。处理24 h后收集细胞,用预冷PBS离心洗涤2次,用500 μL的1×Binding Buffer重悬细胞。每管加入5 μL Annexin V-FITC和10 μL PI,轻柔涡旋混匀后,室温避光孵育5 min。随后在流式细胞仪上通过FITC通道检测Annexin V-FITC和通过PE通道检测PI。实验独立重复3次。
1.4.8 细胞周期检测 取实验细胞1×106/2 mL每孔的标准均匀铺于6孔板中,培养箱孵育6 h后进行药物处理。实验组BBG/MTX/Alg终浓度为1 μg/mL,对照组用等量生理盐水。处理24 h后收集细胞,用预冷PBS离心洗涤1次,加入1 mL DNA Staining Solution和10 μL Permeabilization Solution,轻柔涡旋振荡混匀,室温避光孵育30 min。选择低速上机,流式细胞仪检测处理前后细胞周期变化。实验独立重复3次。
1.5 统计学分析
采用GraphPad Prism 8.0软件进行统计学分析,实验数据用均数±标准差呈现。两组数据选用t检验,多组间分析选用方差分析。P<0.05被认为具有统计学意义。流式分析数据主要应用CytExpert 2.3进行分析。XRD数据采用Origin 2019b进行分析。
经费的支持也是机构库发展必不可少的物质条件之一,因此,机构库建设者就要积极主动地想办法来筹措经费。要解决经费问题,可以采取多渠道并进,主要有以下几种方式:(1)国家层面的经济资助。(2)行业范围的经济资助。(3)机构知识库使用单位的赞助。(4)图书馆作为社会性的公益事业单位,可以通过建立图书馆基金会的方式,接受校友、企业和热心人士等的捐赠来筹集发展资金。(5)国外项目资助委员会的经费。
2 结 果
2.1 BBG/MTX/Alg的制备
按1.4.1的步骤,通过重沉淀法将橙黄色小分子药物MTX载入到乳白色BBG粉末的空腔内,并用Alg进一步固定,得到淡黄色BBG/MTX/Alg复合药物。BBG、MTX、复合药物BBG/MTX/Alg的实物如图1所示。
图1 BBG、MTX和BBG/MTX/Alg的图片
2.2 BBG/MTX/Alg的表征
2.2.1 TEM形貌表征 BBG、BBG/MTX/Alg横截面的TEM图像如图2所示,呈扁平态,可见BBG内部为中空结构,封装MTX后,BBG/MTX/Alg依然保持着BBG的形态,但显示出更高的衬度,表明MTX成功载入BBG空腔并保持BBG自身结构不变。
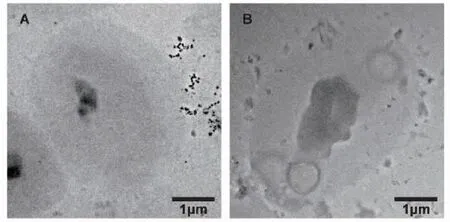
图2 BBG和BBG/MTX/Alg形貌特征
2.2.2 XRD图谱 为了进一步进行物相分析,BBG、MTX、BBG/MTX/Alg行XRD,衍射光谱如图3所示。MTX在9.3°、13.7°、14.1°、19.6°、27.8°处显示出特征性晶体峰,与Agrawal[13]等报导的MTX的XRD图谱一致。BBG与BBG/MTX/Alg的XRD图谱在6.4°处均表现出Hisamatsu等[14]曾报道的三螺旋酵母β-葡聚糖有序排列晶体峰,说明BBG依然保持着原有的结构和部分结晶。但BBG/MTX/Alg中未见MTX结晶峰,表明MTX被封装在BBG颗粒内,且呈非晶态,可能是由于MTX在重沉淀的过程中来不及结晶。

图3 BBG、MTX和BBG/MTX/Alg X射线粉末衍射光谱
2.2.3 载药量及体外药物模拟释放 通过紫外分光光度计测得BBG/MTX/Alg中MTX的负载量约7.8%。其体外药物释放效率如图4所示,在2 h的胃液模拟液中MTX的累积释放率小于15%,能保证后续肠道中BBG/MTX/Alg负载的MTX具有足够的浓度。另一方面,pH值对药物释放速率有明显影响,当0~2 h处于胃液模拟液中时,药物释放速率明显较生理盐水中快,并对后续释放有促进作用,这可能是因为海藻酸盐凝胶在酸性环境下具有更强的溶胀特性[15]。但BBG/MTX/Alg中包裹的MTX在24 h释放率均达到95%左右,这有利于体外实验数据为体内实验提供参考。
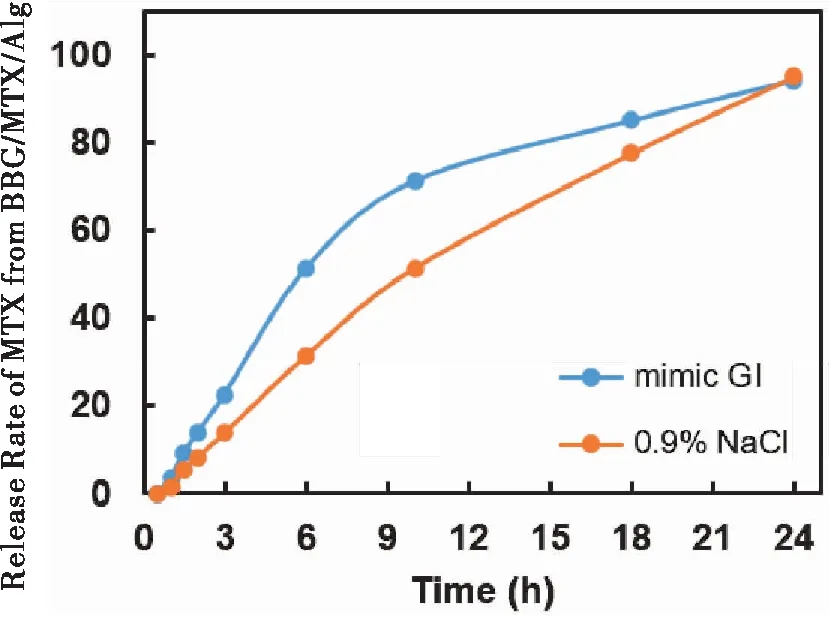
图4 BBG/MTX/Alg模拟在胃肠道及0.9% NaCl中的MTX释放
2.3 各组细胞增殖抑制率
2.3.1 BBG/MTX/Alg对AML-M5增殖的影响 不同浓度不同时间BBG/MTX/Alg处理THP-1和MV-4-11后结果如图5所示,可见与等量生理盐水对照组即药物浓度为0相比,BBG/MTX/Alg能有效抑制AML-M5细胞的增殖,且细胞增殖抑制率呈浓度及时间依赖性。
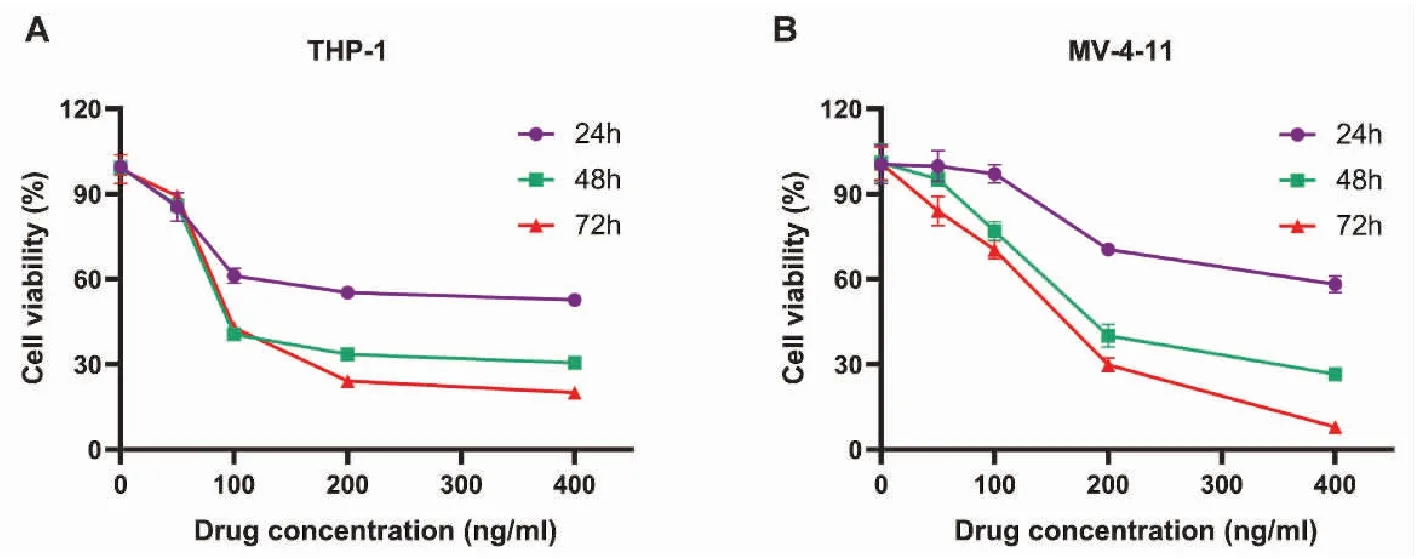
图5 BBG/MTX/Alg对THP-1和MV-4-11增殖的影响
2.3.2 BBG/MTX/Alg对正常细胞的毒性 为了确定药物的安全性,我们进一步检测了BBG/MTX/Alg对正常细胞的细胞毒性。根据Vis-UV光谱法测得的BBG/MTX/Alg中MTX的载药量比例,以等量游离MTX作为对照组,不同浓度BBG/MTX/Alg作为实验组处理正常细胞系24 h,结果如图6。可见在200 ng/mL以下未见BBG/MTX/Alg细胞毒性(P< 0.05),而在较高的浓度,BBG/MTX/Alg对MC3T3-E1和hFOB1.19的细胞毒性比等量游离MTX的毒性小。
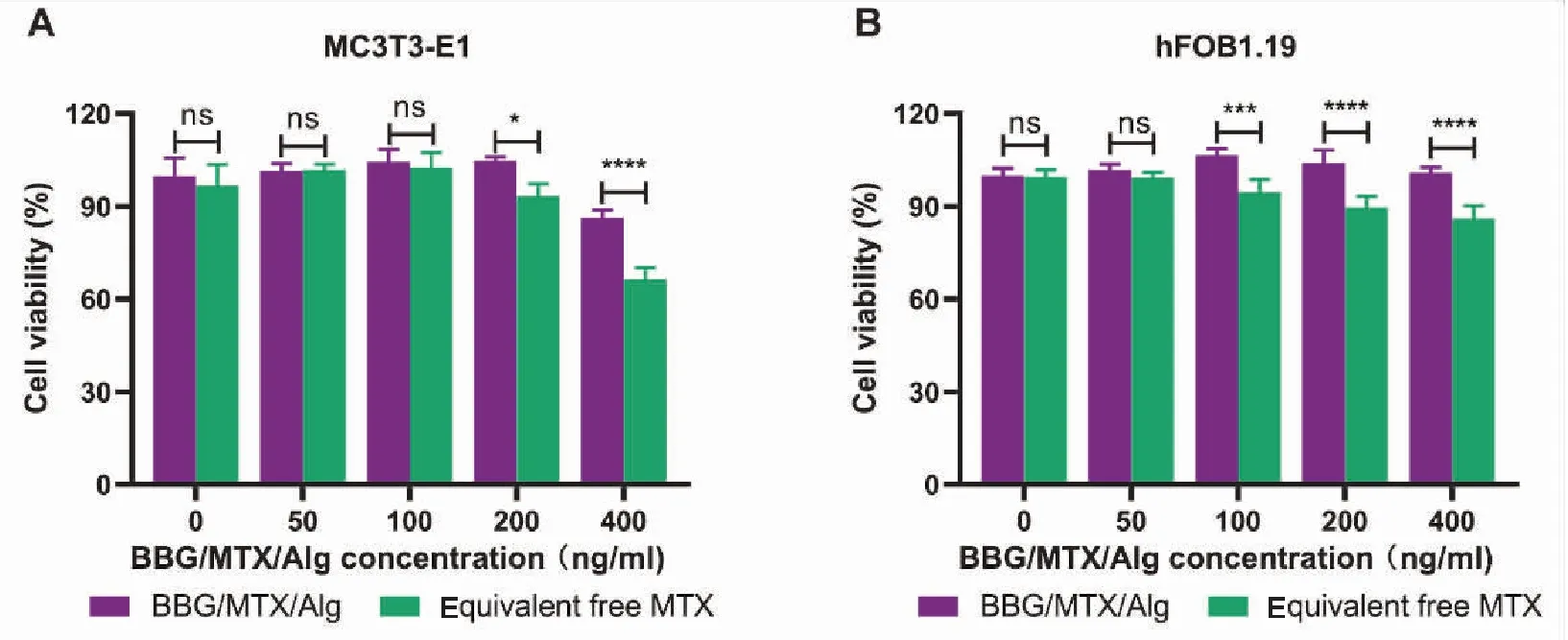
图6 BBG/MTX/Alg和MTX对正常细胞的毒性
2.4 BBG/MTX/Alg对THP-1和MV-4-11凋亡的影响
BBG/MTX/Alg处理后,THP-1及MV-4-11细胞凋亡率显著升高。与THP-1对照组(7.27%±3.29%)相比,1 μg/mL BBG/MTX/Alg处理THP-1 24 h时,细胞凋亡率为34.22%±3.77%。与MV-4-11对照组(11.63%±4.72%)相比,1 μg/mL BBG/MTX/Alg处理MV-4-11 24 h时,细胞凋亡率为46.1%±2.10%。差异均具有统计学意义(P<0.001)(图7、8)。
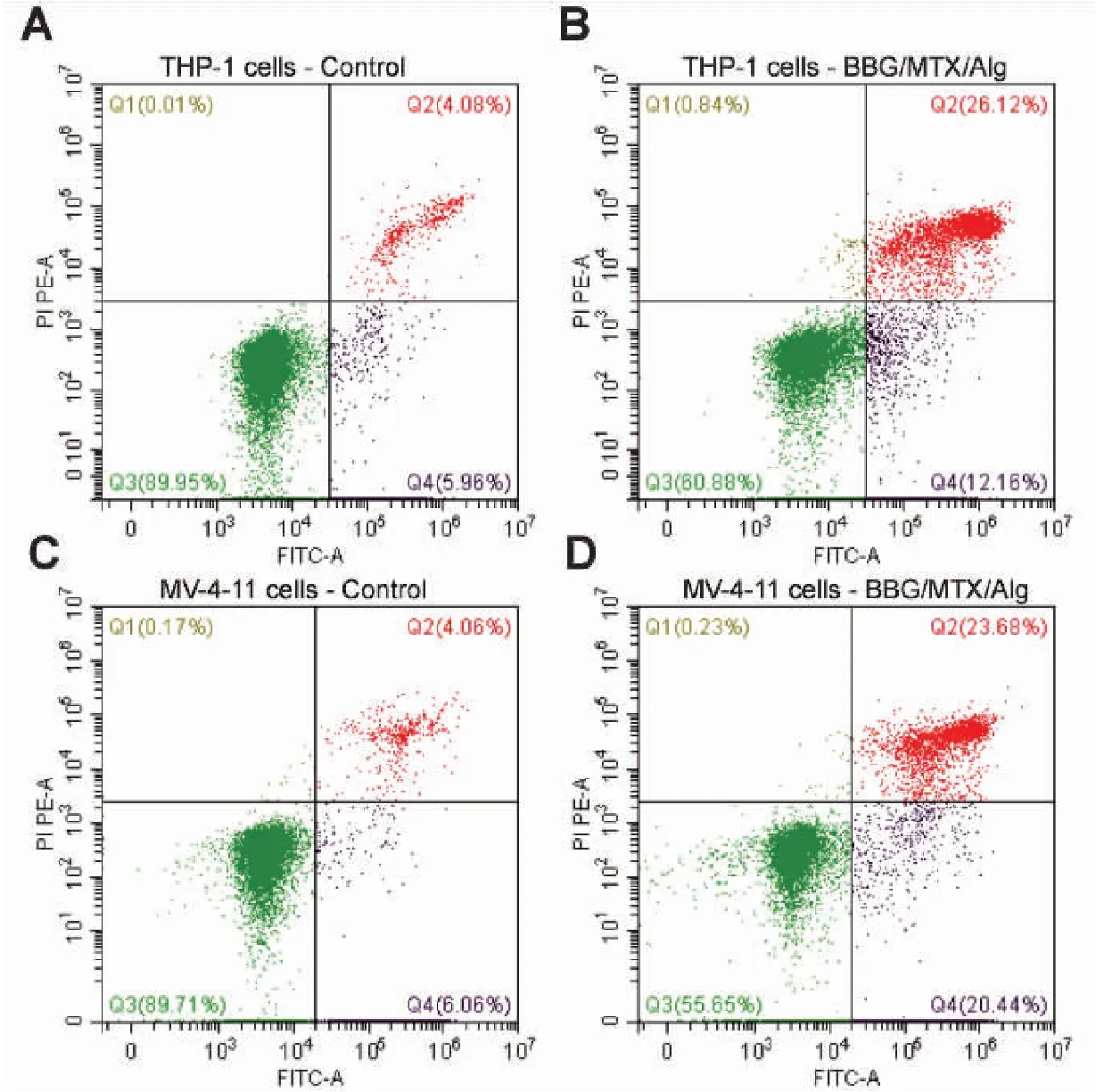
图7 BBG/MTX/Alg促进THP-1和MV-4-11凋亡
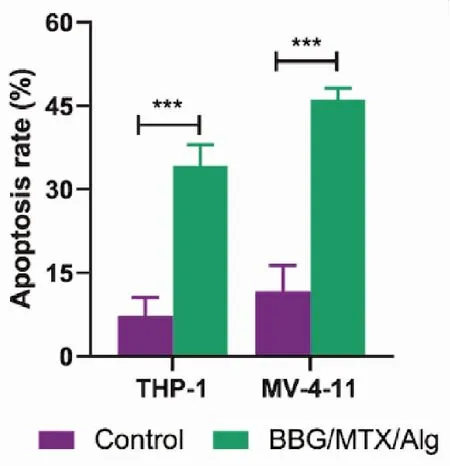
图8 BBG/MTX/Alg作用后THP-1和MV-4-11的凋亡率
2.5 BBG/MTX/Alg对THP-1、MV-4-11周期的影响
细胞周期流式检测结果如图9、10所示,与对照组相比,BBG/MTX/Alg处理后,THP-1及MV-4-11处于G0/G1期的细胞比例均明显上升,且差异具有统计学意义(P< 0.0001),这提示BBG/MTX/Alg处理后阻滞细胞于G0/G1期。
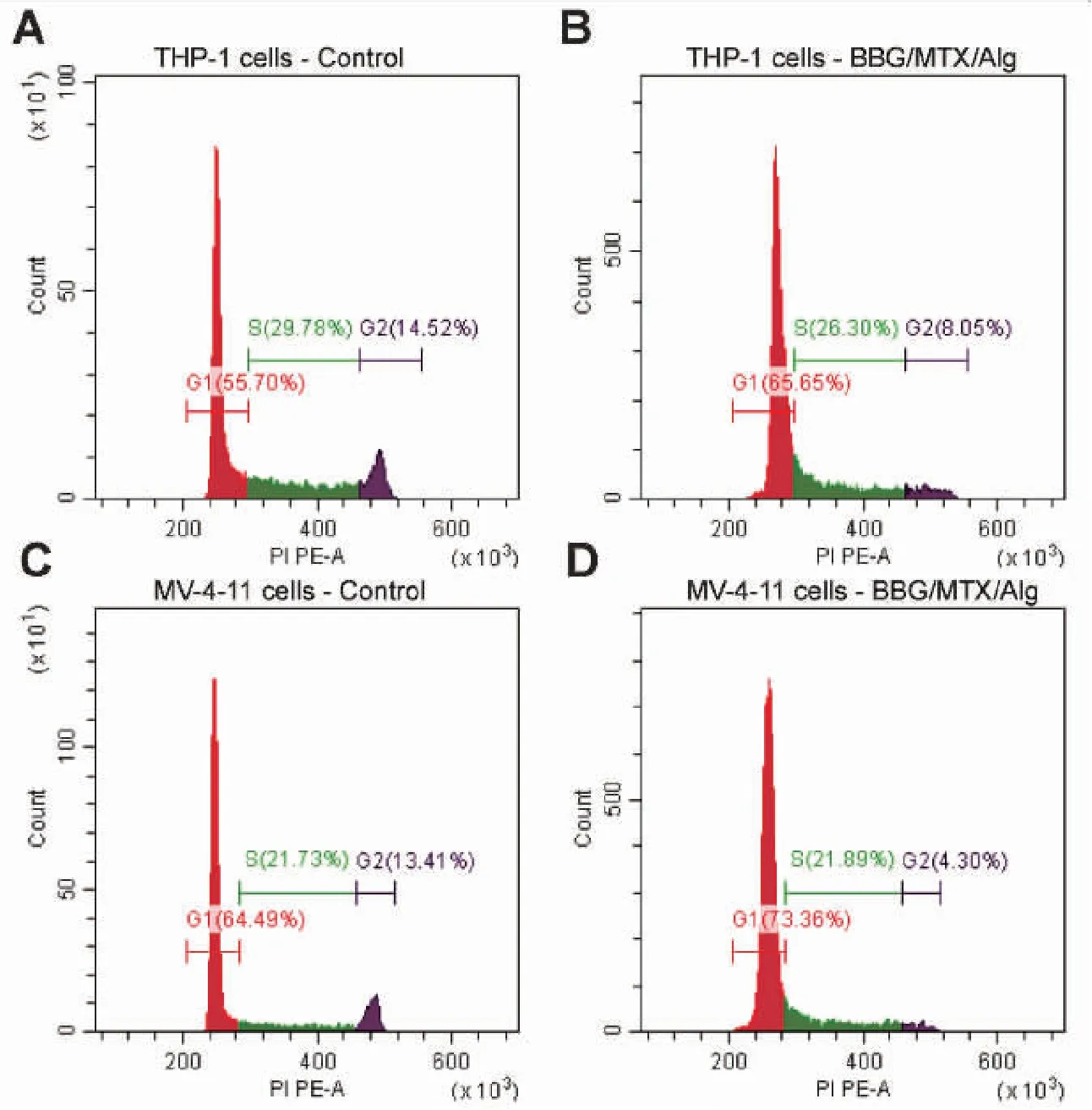
图9 BBG/MTX/Alg对THP-1和MV-4-11细胞周期的影响

图10 BBG/MTX/Alg作用后THP-1和MV-4-11各周期比例
3 讨 论
白血病是血液系统常见的恶性肿瘤,占2020年全球癌症新发人数的2.5%和死亡人数的3.1%[16]。AML-M5是最常见的急性白血病之一,与其他AML亚型相比,混合系白血病基因(mixed lineage leukemia,MLL)重排和不良预后基因更多是其遗传学特点[17]。AML-M5发病急,化疗敏感性差,化疗后复发率高。诊断为AML-M5的老年患者由于治疗引发的不良反应导致差的预后,其平均总生存期仅5~10个月[18]。因此,需要寻找毒性更小且更有效的治疗方式来应对AML-M5。其中,口服缓释制剂因释药缓慢,血药浓度“峰谷”波动小,可避免超过浓度范围的毒副作用,又能维持疗效,具有给药方便、用药次数少、毒性小、药效高、开发周期短等优势,引起了越来越多关注。
MTX作为常用叶酸拮抗剂,是治疗白血病及其他癌症的有效药物,它可以竞争性地抑制叶酸合成的关键酶,进一步阻止嘌呤和嘧啶地合成,从而抑制肿瘤细胞地生长[19]。MTX价格便宜,最方便的给药途径是口服,然而其渗透性低溶解性差,在胃肠道中的吸收主要通过质子依赖的主动吸收,且具有浓度依赖性,因此口服MTX生物利用度较低。MTX缺少靶向性,在肠道部位对正常肠道上皮细胞也有伤害作用,因此副作用较大,在临床应用上受限。目前已经报道了许多类型的新型MTX缓释递送系统,例如纳米颗粒、脂质体、聚合物胶束、微球等[20-21],能够实现MTX的缓慢释放和靶向治疗,取得较好的疾病治疗效果,但仍存在一些问题,比如释放时长远大于胃肠道停留时间或使用的交联剂对胃肠道产生毒性。
近年来,由于天然多糖良好的生物活性及生物相容性,其作为药物缓释载体的功能引起广泛关注[22]。酵母多糖作为美国食品药品监督局认定的安全食品成分,是酵母细胞壁的主要成分,为水不溶性多糖,其主要成分为β-1,3-D-葡聚糖,含有少量β-1,6-D-葡聚糖。采取不破坏酵母细胞壁结构的温和化学提取方法,可以得到保持酵母细胞壁结构形态的酵母β-葡聚糖颗粒,呈中空结构,粒径2~4 μm,是药物释放的天然载体[11,23]。在肠道部位,酵母β-葡聚糖颗粒能够在肠道部位通过小肠 M 细胞主动吸收的方式进入体内[24],可促进负载药物在肠道部位的吸收,减少副作用。另外,酵母β-葡聚糖具有良好的生物活性,课题组前期研究已证明BBG具有良好的抗炎活性[23]。除此之外,β-葡聚糖还具有良好的免疫调节、抗肿瘤活性等[25],相比于合成高分子药物载体,酵母β-葡聚糖颗粒作为药物载体具有其内在优势。
MTX呈弱酸性,在碱性条件下可溶,在中性和酸性条件下水不溶,利用该特点,本研究通过调节pH,将MTX溶解后重新沉淀载入BBG的空腔,为了实现MTX在BBG空腔内的缓慢释放,我们利用生物相容性良好的Alg封装,制备MTX缓释制剂,以期提高口服MTX的疗效及减少毒性。透射电镜和XRD表征实验结果均证明MTX成功载入BBG空腔。口服药物载体的第一道挑战就是通过胃部强酸性环境时保证载体的完整性和稳定性,体外模拟胃肠道释放实验证明,BBG/MTX/Alg复合物在pH=1.2的模拟胃液中2小时药物释放量低于15%,大部分MTX通过载体到达肠道部位,保证BBG/MTX/Alg到达肠道部位 MTX 依然具有足够的有效剂量,到达肠道部位后3~10小时MTX 的累积释放量急剧增加,在10 h内达到 70%左右,然后缓慢释放,在 24 h 释放量达到95%左右,使 MTX 在肠道部位迅速达到有效的吸收浓度,并长时间维持有效浓度,这有利于药物于胃肠道安全释放及被吸收。
课题组前期研究已证明BBG负载MTX颗粒可以有效促进MTX在结肠炎治疗中的临床应用。[11]由于MTX还具有良好的抗白血病特性,课题组进一步合作研究BBG负载MTX抗急性单核细胞白血病的效果,并根据预实验结果调整药物成分,以期得到更佳的释放速率与抗白血病效果。体外实验证明,新合成的BBG/MTX/Alg能有效抑制急性单核细胞白血病细胞系THP-1和MV-4-11增殖,随着时间的延长,抑制增殖的作用增强。在200 ng/mL的较低浓度下,72 h对THP-1和MV-4-11的增殖抑制率达75%和70%,随着处理浓度的增加,MV-4-11增殖抑制作用更强,而增加浓度对THP-1增殖的影响较小。在正常细胞系中,与等量游离MTX相比,BBG/MTX/Alg处理24 h后对正常细胞系的毒性较小,说明合成的缓释制剂具备更低的毒性,提示其更有利于临床应用。体外细胞实验环境下BBG/MTX/Alg中MTX的释放特性可以通过BBG/MTX/Alg在生理盐水的环境中释放来模拟(图4),在0~24 h内,MTX保持着平稳缓慢的释放,因此相比于游离MTX,BBG负载后能够降低MTX与正常细胞的接触,从而降低MTX对于正常细胞的毒性。
细胞凋亡实验结果显示,与生理盐水对照组相比,BBG/MTX/Alg能显著触发AML-M5细胞系的凋亡反应,阻滞白血病细胞从G1期进入S期从而抑制增殖,这与Zhao等[26]合成的寡核苷酸适体-MTX偶联物抗AML结果一致。BBG/MTX/Alg在体外通过抑制白血病细胞增殖,并阻滞细胞于G0/G1期促进其凋亡,有效抑制白血病细胞生长,且对正常细胞具有更低的毒性,说明BBG作为MTX的缓释载体,能够保证MTX发挥正常的药效,并降低对正常的毒性,具有一定的应用前景。
综上所述,BBG/MTX/Alg因其低毒高效,或可作为良好的抗急性单核细胞白血病口服缓释药。我们的实验为临床应用MTX治疗M5型白血病提供了新的治疗手段和理论依据,BBG/MTX/Alg在体外对白血病细胞系具有良好的抑制作用,其体内代谢途径、白血病治疗效果以及作用机制还有待进一步深入研究。
作者声明:本文全部作者对于研究和撰写的论文出现的不端行为承担相应责任;并承诺论文中涉及的原始图片、数据资料等已按照有关规定保存,可接受核查。
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统的学术不端检测。
同行评议:经同行专家双盲外审,达到刊发要求。
利益冲突:所有作者均声明不存在利益冲突。
文章版权:本文出版前已与全体作者签署了论文授权书等协议。
——谷物β-葡聚糖的最新研究进展

