力竭运动过程中大鼠皮层–基底神经节通路α/β同步振荡的起源和传递路径
黄浩洁
1,2 侯莉娟1 刘晓莉1 乔德才1
1 北京师范大学体育与运动学院(北京100875)2 厦门大学体育教学部(厦门361005)
基底神经节(basal ganglia,BG)是大脑皮层下几个相互联系的神经核团的总称,包括纹状体(striatum,Str)、苍白球外侧部(external globuspallidus,GPe)、黑质致密部(substantia nigraparscompacta,SNc)、丘脑底核(subthalamic nucleus,STN)、苍白球内侧部/黑质网状部复合体(internal globuspallidus /substantia nigra reticular part,GPi/SNr)等[1,2],通过“平行模块结构”方式对运动皮层传入的信息进一步整合加工后传至丘脑,再由丘脑传回运动皮层,实现对运动的准确调控[3,4]。振荡电活动是大脑编码信息的基础,无论是在单个神经元的放电还是颅外磁场,每个层面都可观察到神经元振荡电活动现象[5]。这种振荡电活动可反映记录电极附近一定空间范围数以万计的神经元兴奋性突触后电位(excitatory postsynaptic potentials,EPSPs)与抑制性突触后电位(inhibitory postsynaptic potentials,IPSPs)总和的大小,亦称之为局部场电位(local field potentials,LFPs)。根据LFPs 电生理特征可分为delta(δ,1~3 Hz),theta(θ,3~8 Hz),alpha(α,8~12 Hz),beta
(β,12~30 Hz)和gamma(γ,30~100 Hz)5 种频段振荡电活动[5]。有研究发现,不同频段的振荡电活动与运动功能状态密切相关,如基底神经节的β频段振荡电活动与运动执行有关[6],γ频段振荡电活动与警醒密切关联[7]。近些年来,我们采用微电极技术研究了运动性疲劳大鼠皮层和基底神经节的电生理特征[8-10],发现这两个部位存在不同程度的同步振荡电活动。Str作为基底神经节的主要输入核团,约95%由γ-氨基丁酸(γ-aminobutyric acid,GABA)能中等多棘神经元组成,其球形的树突状和非层状的细胞结构组织[11],使突触活性易产生对LFPs 净贡献较小的封闭电场[12]。由于Str 缺乏反复的兴奋输入和局部抑制[5],因此,Str被认为不具备自发产生同步振荡的基础[13],这提示Str 存在的同步振荡可能是由其他核团传入。鉴于此,本研究采用多核团同步记录的电生理学技术,实时同步记录整个力竭运动过程中大鼠皮层和基底神经节振荡电活动,通过格兰杰因果分析(Granger causality,GC)方法探究异常同步振荡电活动起源和传递路径,旨在探寻运动疲劳振荡电活动的中枢调控机制,为运动疲劳恢复的中枢靶点提供理论依据。
1 研究方法
1.1 实验动物
实验选用健康4周龄雄性Wistar 大鼠(260~340g,北京市维通利华公司,SCXK 京2012-0001),饲养在温度和湿度相对适宜、自然节律光/暗循环的环境下,大鼠可自由获取食物和水。正式实验开始前大鼠先在跑步机(中国杭州段式制作,DSPT-216)上进行3天跑台适应性训练,筛选出能够以20 m/min的速度持续运动30 min以上的大鼠实施电极埋藏手术[14],共计20只。
1.2 梯度电极制作和手术植入
梯度电极制作:适当截取5根直径120 μm优质碳钢合金丝(A-M Systems,美国),一端去绝缘层,分别焊接在16 通道电极母座中的5 个通道电极金属接头上(M1,C05;Str,C08;GPe,C09;STN,C12;SNr,C13),另外两根铜线则焊接到GND和REF通道的金属接头上,分别作为地线和参考线;然后对应穿过根据各核团坐标位置制作的电极固定板小孔,将电极母座和电极固定板用牙科水泥包被,以增强机械强度。在显微镜下将电极丝拉垂直,以黑质致密部通道电极丝为参考,5根电极梯度按核团相对长度相应地裁剪,制作成梯度阵列电极(图1A 和B),并用nanoZTMImpedance Tester系统(Blackrock,美国)检测每根连通性和阻抗,确保电极制作成功。
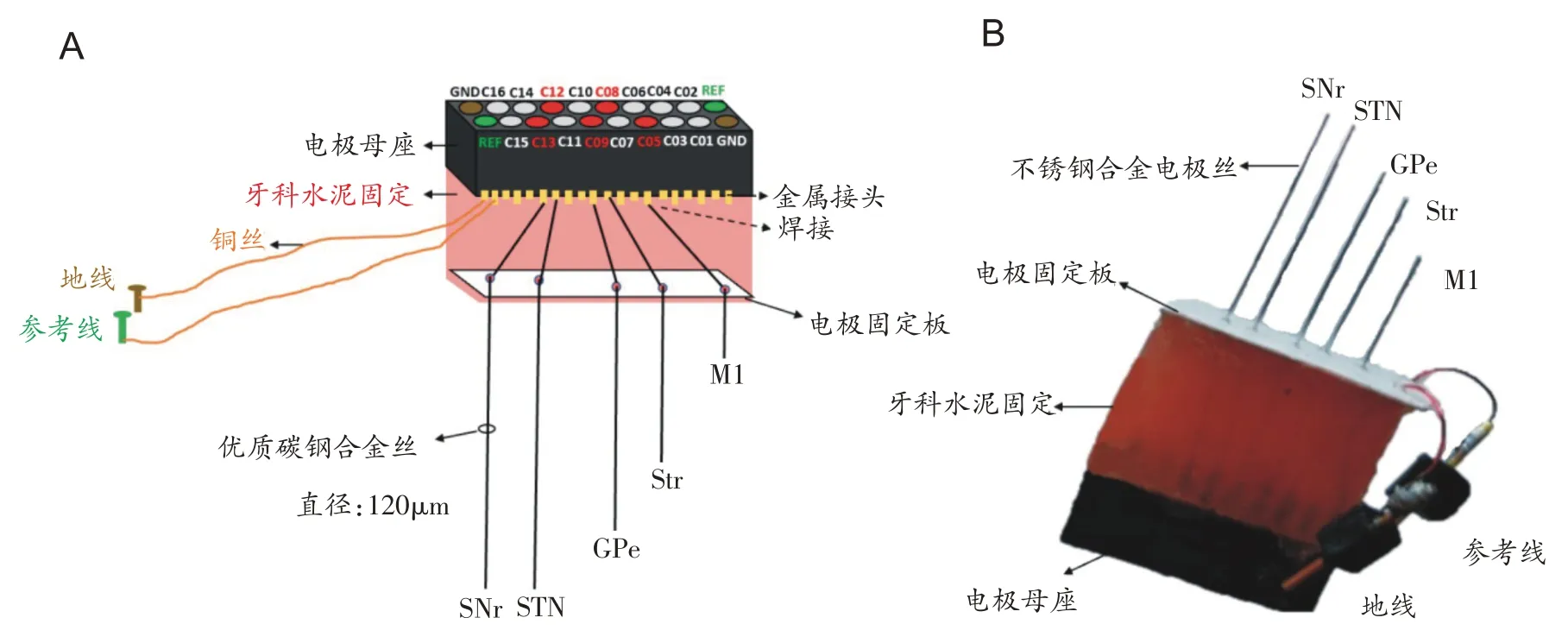
图1 皮层-基底神经节梯度电极制作示意图
手术植入:将筛选出的大鼠用10%水合氯醛溶液腹腔注射麻醉,固定于脑立体定位仪上,剃毛并剪除颅顶皮肤充分显露前后囟,使前后囟处于同一水平面。根据George Paxinos 大鼠脑立体定位图谱分别标记右侧脑区M1(AP:+2.0 mm,R:3.0 mm,DV:1.8~2.0 mm)、Str(AP:+0.25 mm,R:3.65 mm,DV:4.6~5.0 mm)、GPe(AP:- 1.25 mm,R:2.975 mm,DV:6.4~6.8 mm)、STN(AP:- 3.5 mm,R:2.3~2.5 mm,DV:7.55~7.65 mm)和SNr(AP:- 5.125 mm,R:2.5 mm,DV:7.85~8.0 mm),如图2A所示。在显微镜下,使用高速涡轮牙钻在各标记点上钻孔至硬脑膜,清洁颅骨表面,然后将梯度电极缓慢下降进入脑组织内至目标位置,再在小脑上方植入两个微型螺钉作为地线和参考线(图2B),最后用牙托水泥固定电极丝及覆盖全部颅骨表面。实验结束后灌流大鼠、断头、取脑、切片和尼氏染色(图2C),参照大鼠脑立体定向图谱在显微镜下鉴定确定M1、Str、GPe、SNr和STN的位置。5根电极末端在相应核团所取数据均为有效数据,有8 只大鼠因电极位置插入不准确所取数据没有纳入统计范畴,最终获取12只大鼠有效数据。
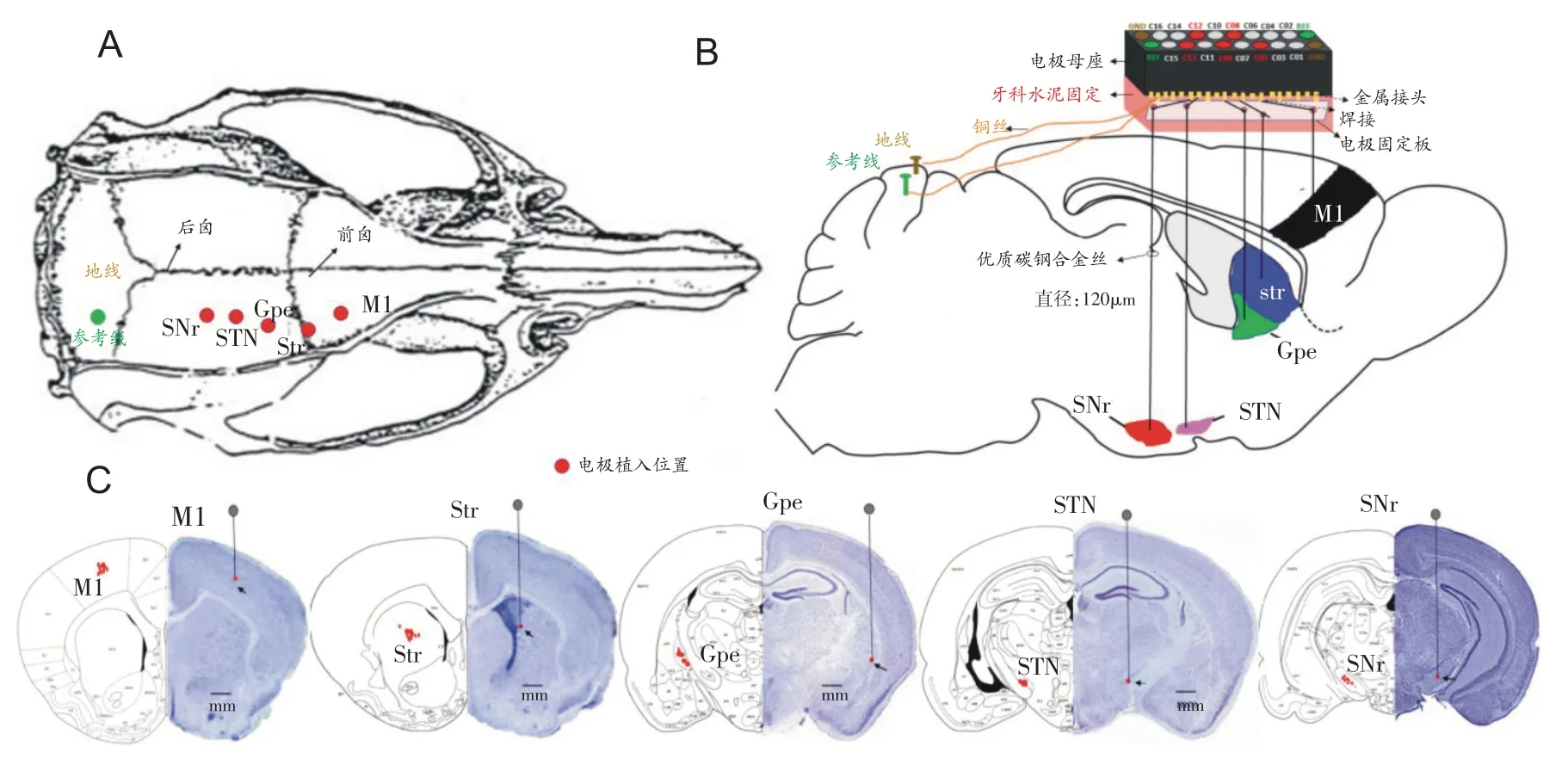
图2 各核团电极植入位置和深度以及位置确定
1.3 一次性力竭运动方案和LFPs信号采集
大鼠手术埋置电极恢复7 天后,开始进行一次性力竭运动实验。力竭运动方案采用改良的Bedford 递增负荷运动方案[14],负荷分为3 级:Ⅰ级负荷:8.2 m/min,15 min;Ⅱ级负荷:15 m/min,15 min;Ⅲ级负荷:20 m/min(图3A)。力竭判断标准[14]:大鼠跑姿由蹬地式变为伏地式,滞留在跑道后1/3处,且用声、光和电刺激均不能使其继续维持原有速度运动。LFPs信号采集使用Cerebus-128多通道(Blackrock,美国)信号采集系统,记录一次性力竭运动过程中皮层(M1)和基底神经节(Str、GPe、SNr 和STN)LFPs 电信号(采样频率:30 kHz/s;记录抗干扰滤波:低通滤波250 Hz,带通滤波250 Hz~500 kHz),并采用NeuroMotive 系统实时监控录像,记录大鼠跑台运动全过程行为活动,以备后续信号分析时使用。
1.4 LFPs信号分析
功率谱密度分析:将原始LFPs 信号通过NeuroExplorer 分析软件包加入陷波滤波器去除电噪声干扰(50 Hz的整数倍)实现数据预处理,不同阶段分析截取30s连续时间无噪音干扰的LFPs信号X(t)求平均振幅值,然后进行快速傅立叶转换[15]:
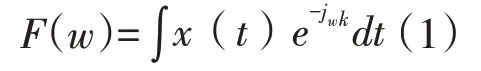
式子(1)中的w为角频率,再通过公式(2)计算一次力竭运动过程中各核团的功率谱密度(power spectral density,PSD):
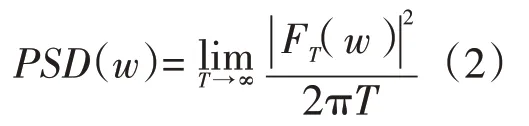
Granger因果分析:Granger因果分析作为一种可以衡量两个时间序列之间相互影响关系的方法,可反映一个时间序列X(t)对另一个时间序列Y(t)的统计可预测程度[16]。本研究中记录到的LFPs信号为稳定的时间序列信号,可用该方法来研究核团之间LFPs信号的传递路径和起源[17]。进行Granger 因果分析时,两个核团的LFPs时间序列X(t)和Y(t)可通过双变量p阶自回归模型(autoregressive model)分别拟合:
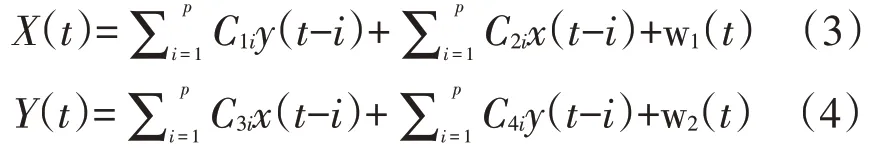
式(3)和(4)中,w表示残差项,假定为不相关。
本实验基于该原理使用自定义Matlab程序(RRID:SCR_001622)结合Chronux 工具箱,采用多变量自回归模型的方法来计算频域上的偏相关Granger因果系数,用于分析皮层和基底神经节各核团LFPs 信号两两之间双向的因果联系。
1.5 统计学分析
所有数据均采用SPSS20.0统计软件包进行统计分析,采用GraphPad Prism 8 软件作图。结果以均值±标准差(±s)表示。一次力竭运动过程不同时期之间的LFPs 平均振幅值差异采用配对样本t检验,采用单侧配对Wilcoxon符号秩检验进行非参数检验来评估大鼠不同频段Granger因果参数之间是否有显著差异,P<0.05为差异有统计学意义。
2 结果
2.1 大鼠行为学观察及力竭运动过程不同阶段划分
行为学观察结果发现:大鼠从运动开始,在跑台递增负荷下可自主进行运动,持续运动一段时间后运动能力开始下降,此时如给予一定的外部刺激,仍可维持原有强度继续运动直至力竭。由于每只大鼠运动时间存在显著差异(126.0 ± 8.2 min),为便于比较大鼠不同运动阶段LFPs的动态变化规律,结合大鼠运动行为特征,可将整个力竭运动过程划分为安静期、自主运动期、运动疲劳初期、力竭期(运动疲劳后期)和恢复初期5 个阶段[18]。开始运动前,将大鼠置于跑道上,此时为安静期(30 min);开始运动后大鼠可在自我驱动下维持Ⅲ级负荷强度跑动,此时为自主运动期(62.2 ± 7.4 min);随着运动时间的延长,大鼠运动能力逐渐下降,无法自主继续向跑台前端运动,需要采用声、光或电刺激才能继续维持预定强度跑动,此时为运动疲劳初期(30.3 ± 5.9 min);当大鼠长时间滞留在跑道末端的挡板上,且声、光和电共同刺激均不能使其继续运动时,表明进入力竭期(3.5 ± 1.2 min);停止运动后,继续记录30 min,此时为恢复初期,如图3所示。
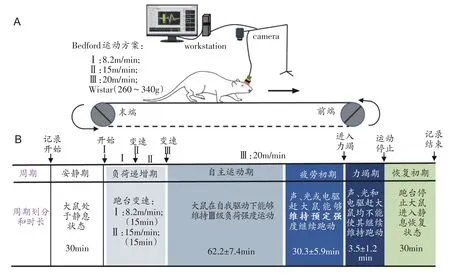
图3 大鼠一次性力竭运动方案、各阶段划分和大鼠运动时间
2.2 一次力竭运动过程中皮层和基底神经节功率谱分析
LFPs振幅值可间接反映神经元群振荡电活动同步化程度,本研究结果显示,大鼠在安静期各核团LFPs振幅值都比较低;进入自主运动期时皮层和基底神经节LFPs振幅值开始加大(P<0.05);随着运动持续,当进入运动疲劳初期和力竭期,LFPs平均振幅值进一步增大(P<0.01);进入恢复期LFPs平均振幅值又显著降低,恢复到接近安静期水平,各期变化值如图4A和4B所示。
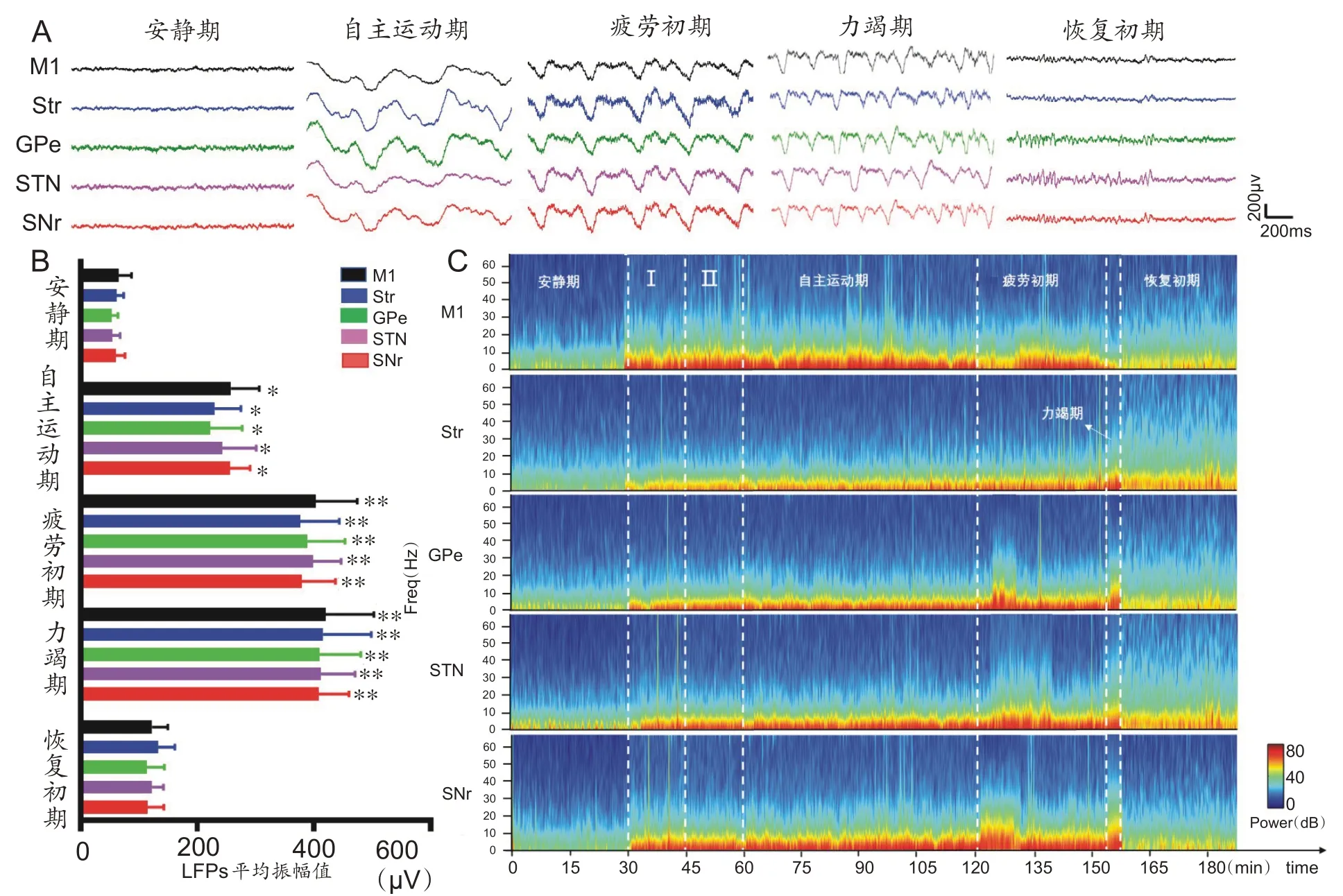
图4 一次力竭运动过程中皮层和基底神经节LFPs变化特征
PSD分析可以将LFPs信号分解为不同频率的正弦波信号,通过一次性力竭运动过程中皮层和基底神经节各核团的频谱图可进一步揭示各阶段各频段PSD出现动态变化特征,如图4C 所示。结果发现:与安静期相比,自主运动期各核团主要在低频段δ/θ的PSD 显著升高(P<0.05);随着运动的持续,进入运动疲劳初期各核团仅在中频段α和高频段β的PSD 显著升高(P<0.05);进入力竭期各核团只在高频段β的PSD 显著升高(P<0.05);恢复初期时,各核团仅在中频段α的PSD显著升高(P<0.05)。此外,每个阶段各自升高的幅度和频段范围也并不完全一致,如图5所示。这说明皮层–基底神经节广泛存在的低频段δ/θ同步振荡电活动增强可促进自主运动,而中高频α/β同步振荡电活动增强则抑制运动,推测广泛存在的增强的同步振荡电活动可能是源于皮层–基底神经节某个核团,然后向其他核团扩散。
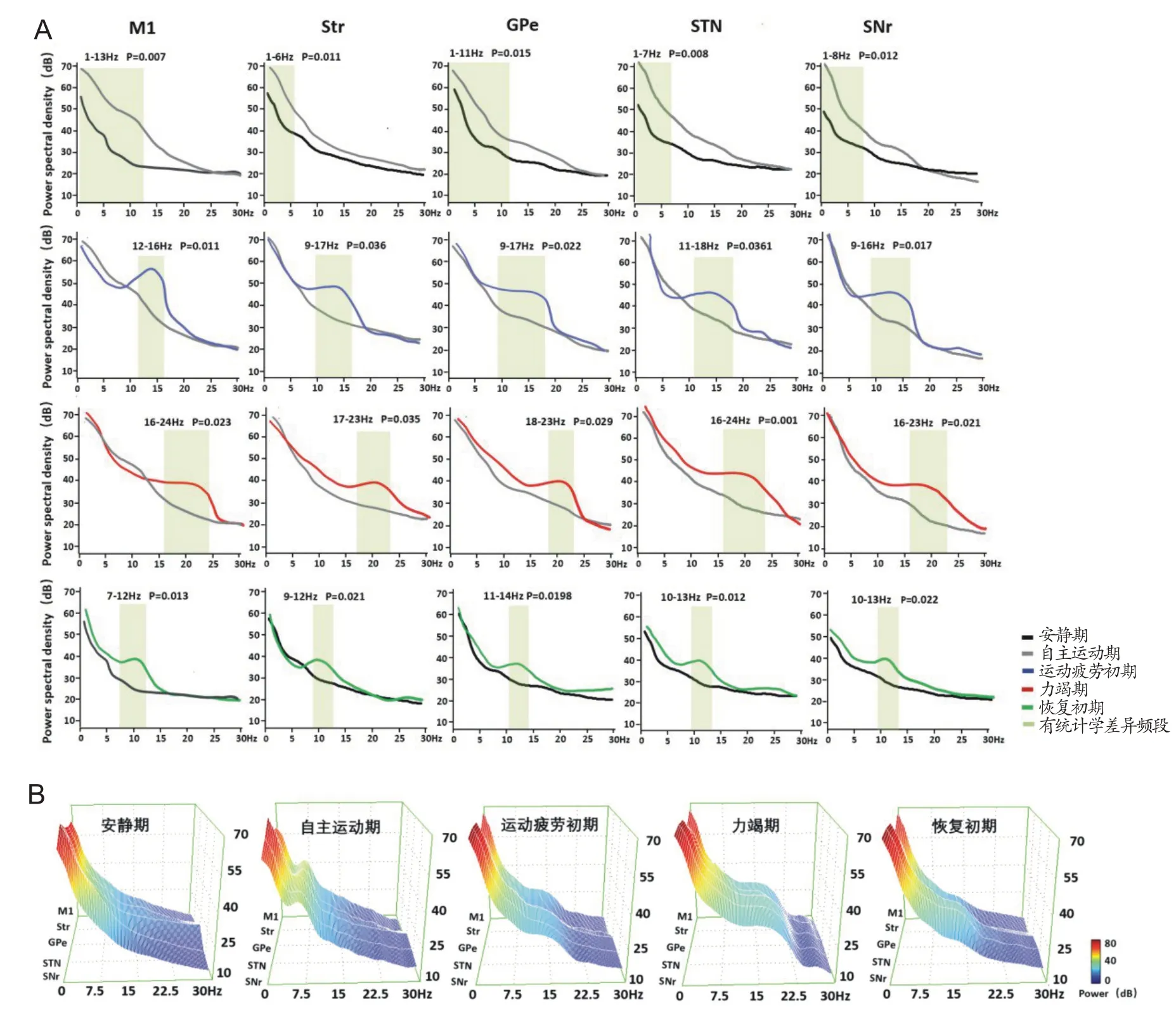
图5 各核团不同阶段不同频段PSD值比较
2.3 力竭运动过程中皮层和基底神经节两两核团之间Granger因果分析
为了进一步探究自主运动期、运动疲劳初期和力竭期出现增强同步振荡电活动的起源和传递路径,本研究采用有向连通Granger 因果关系分析方法对皮层和基底神经节两两核团进行双向(X→Y 和Y→X)的Granger 系数计算,实验结果显示:大鼠稳定以20 m/min 进行自主运动时,与安静期相比,两个核团之间以M1(M1→Str、M1→STN 和M1→SNr)、Str(Str→GPe、Str→STN 和Str→SNr)、STN(STN→SNr 和STN→GPe)、GPe(GPe→STN)和SNr(SNr→M1)为起始传递方向上,主要是δ和θ频段的Granger 因果系数显著升高(P<0.05),但各自升高的频段范围不完全一致,其他频段和方向无显著变化(P>0.05),如图6所示。
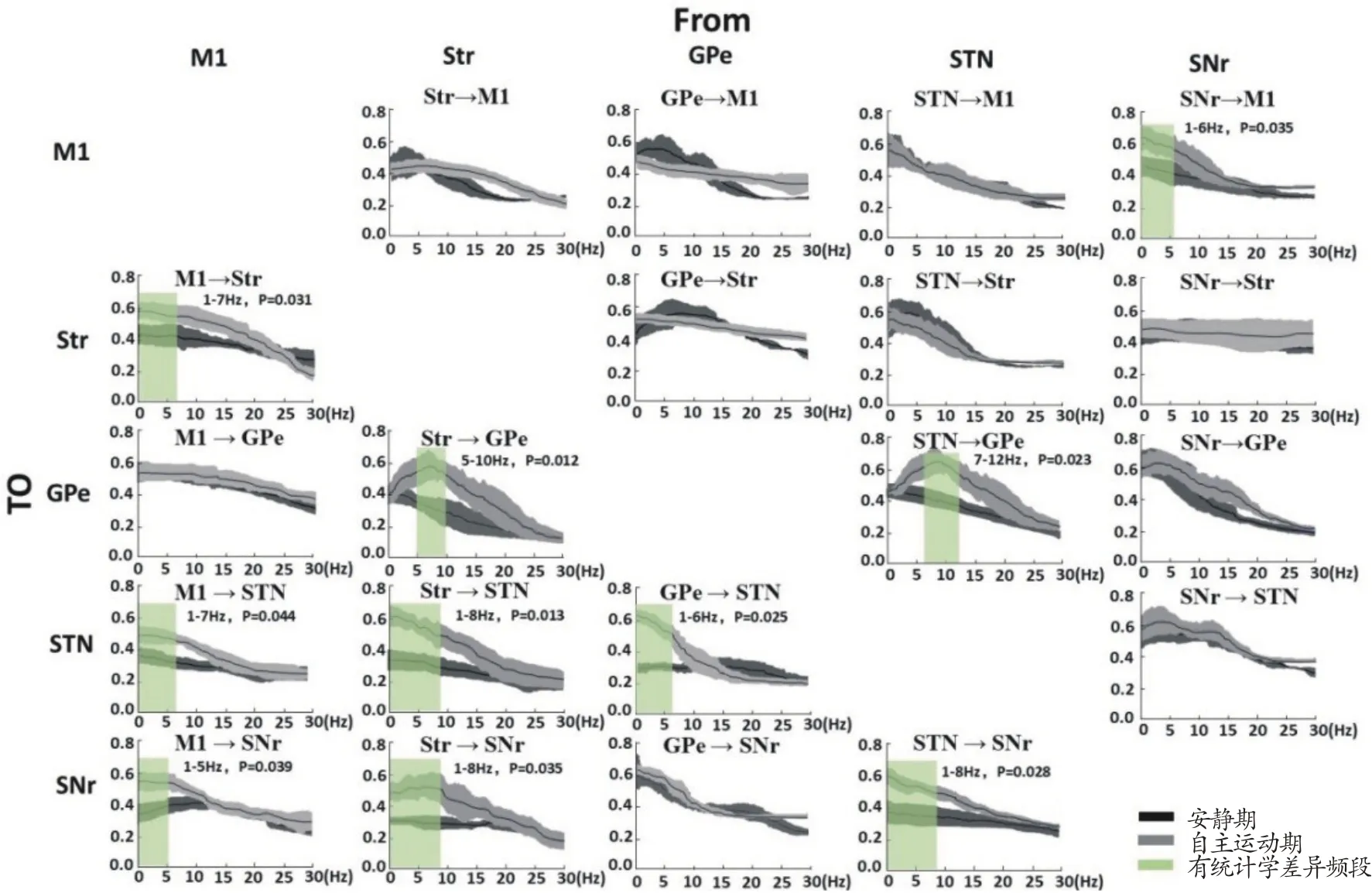
图6 安静期与自主运动期两两核团之间双向Granger因果关系比较
当大鼠进入运动疲劳初期时,两两核团在以STN(STN→M1、STN→ Str、STN→ GPe 和STN→ SNr)、GPe(GPe→Str、GPe→STN 和GPe→SNr)和SNr(SNr→M1)为起始传递方向上,主要是α和β频段的Granger因果系数显著升高(P<0.05),但各自升高的频段范围也不完全一致,如图7所示。
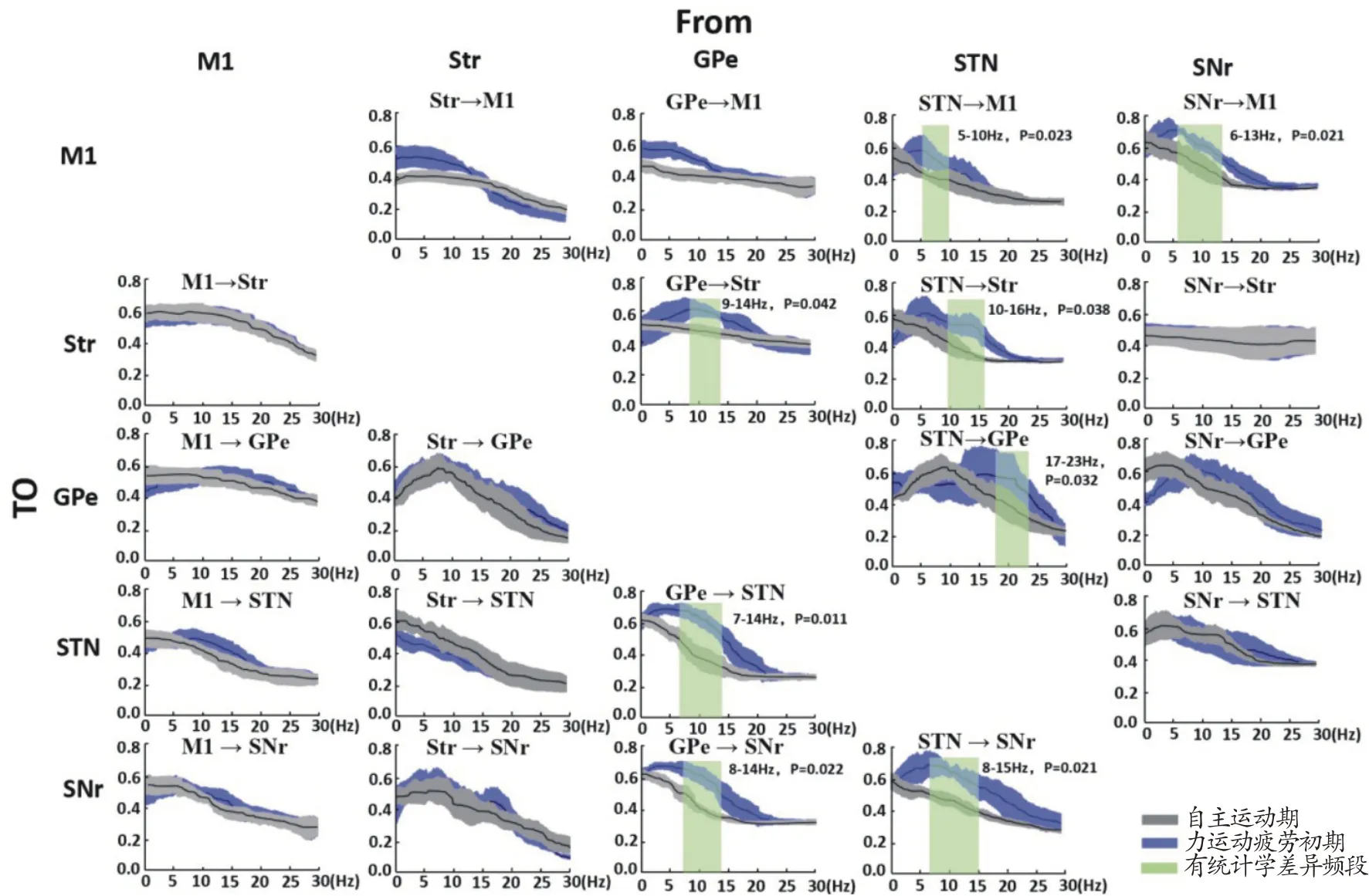
图7 运动疲劳初期和自主运动期两两核团之间双向Granger因果关系比较
当大鼠进入力竭期时,运动疲劳初期情况类似,也是在以STN、GPe和SNr为起始传递方向上,主要是α/β频段(β为主)的Granger 因果系数显著升高(P<0.05),各自升高的频段范围也不完全一致,如图8所示,其他频段和方向均无显著变化(P>0.05)。
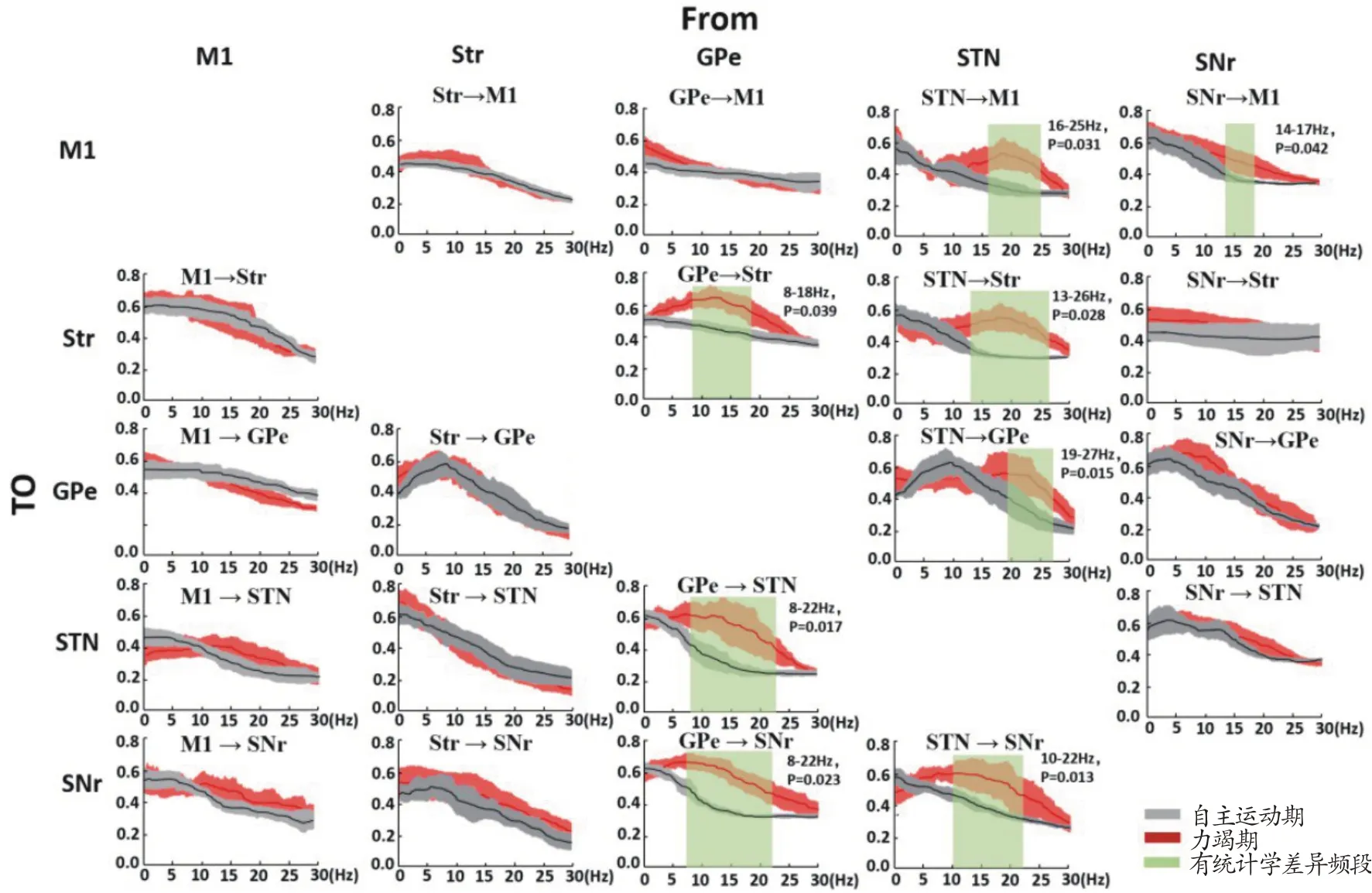
图8 力竭期和自主运动期两两核团之间双向Granger因果关系比较
3 讨论
LFPs 与传统微电极记录的单个神经元放电相比,可以提供更多的有效信息,而与脑电图(EEG)相比,具有更高的时间与空间分辨率信息[19]。LFPs振幅强度主要由神经元群的放电频率以及特定频率下参与放电的神经元数量来决定。当神经元处于异步振荡时,放电无规律性,各个频段的LFPs 幅度都比较低;当神经元出现同步振荡时可观察到某一特定频段下的LFPs 幅度加大,并且随着同步化程度的增强,LFPs 的幅度和PSD 值也进一步增加[5]。LFPs 信号的同步被认为是大脑区域信息传递的重要方式之一[20]。同步的作用是把不同频段振荡的神经元所编码的局部信息通过相位同步“捆绑”起来,实现不同脑区的协同工作,神经网络的作用就是在同步和非同步的状态间切换,实现脑区间的功能联系和信息传递。
3.1 自主运动和运动疲劳时皮层-基底神经节通路分别呈现δ/θ振荡和α/β振荡同步化增强
本研究利用多导梯度电极实现了在大鼠一次性力竭运动过程中皮层和基底神经节多核团振荡电活动的同步记录,并结合大鼠运动行为分析运动不同阶段LFPs 的PSD,结果发现:1)大鼠在自主运动期间,皮层–基底神经节通路各核团原始LFPs 平均振幅值均显著升高,说明神经元振荡同步化增强;经进一步分析各频段PSD 值发现主要是低频的δ(1~3 Hz)和θ(3~8 Hz)振荡同步化增强,提示皮层和基底神经节低频δ/θ振荡电活动增强参与调控促进运动信息传递。Berke[6]和Daniel 等[21]也发现,啮齿动物在自主运动阶段,基底神经节中δ/θ振荡电活动同步化增强具有促运动效应(pro-kinetic effects),这可能是运动和空间导航相关的网络级计算的潜在神经基础[22-24];2)大鼠在运动疲劳初期,皮层和基底神经节的LFPs 平均振幅值进一步升高,主要表现为高频α(8~12 Hz)和β(12~17 Hz)振荡同步化增强。在进入运动疲劳期后,给予各种外界刺激驱赶大鼠仍可进行一段时间的运动直至力竭,此时大鼠极度疲劳,暂时失去应激反应(即失去对外界声、光和电刺激的反应能力),在这种状态下可能会超过机体的生理极限,然后经历一个“灾难性”的稳态失衡,此时皮层–基底神经节通路仅在高频β振荡同步化增强。也有研究发现,正常生理状态下,人类[25]、灵长类[26]和啮齿动物[27,28]在执行抑制性运动任务期间,皮层和基底神经节也出现β同步振荡增强现象。在病理状态下,帕金森病(Parkinson’s disease,PD)表现出的运动启动困难和运动迟缓也与皮层和基底神经节广泛存在β振荡电活动同步化增强有直接关系[29,30],当降低PD 患者基底神经节β同步振荡时运动迟缓症状得到显著缓解[31]。因此,我们认为,皮层–基底神经节通路的β振荡同步化增强具有抑制运动效应(anti-kinetic effects),参与了编码抑制运动信息,从而抑制了运动皮层兴奋性,导致运动能力下降。这也可能是运动皮层不能被有效驱动,导致大鼠运动能力下降的重要原因之一,是大脑皮层在运动疲劳发生过程中出现的一种保护性抑制结果。
3.2 振荡电活动同步化增强的起源和传递路径
本研究引入了在神经科学领域广泛应用的有效连接Granger因果分析方法,进一步探究核团之间不同频段振荡电活动的起源和传递路径,经过比较皮层和基底神经节两两核团双向的Granger系数发现:①自主运动期大鼠皮层和基底神经节出现广泛增强的δ/θ振荡主要是以M1 和Str 核团为起始向下游核团传递,再通过SNr 传回M1,如图9A 所示。由于Str 不具备产生同步振荡的结构基础,并且Str接受皮层广泛的纤维投射同时向下游核团GPe 和SNr 投射神经纤维连接,因此,我们认为大鼠在自主运动中皮层和基底神经节广泛存在增强的δ/θ同步振荡起源和传递路径,可能是以M1起始向基底神经节各核团传递,或M1 先传递给Str 然后再传递给基底神经节其他核团,最后再返到皮层;②无论是运动疲劳初期还是力竭期,振荡的传递方向均是以STN 和GPe 核团为起始,通过STN→M1、STN→GPe、STN→SNr、GPe→SNr、GPe→STN、GPe→Str 和SNr→M1 路径向其他核团传递,其中STN 和GPe 之间是相互传递,如图9B 所示。分析其原因我们发现,STN-GPe 微环路可能是β同步振荡的起源,而M1 可能是β振荡的“最终接收者”,其传递路径是:第一,从解剖上看,STN 接受大量来自皮层的神经纤维投射,因此β振荡电活动可从STN沿神经纤维逆向传递到M1,是神经纤维逆向传播的结果。该路径属于超直接通路,β同步振荡增强可能激活了该通路,该通路激活会使M1兴奋性输出产生抑制作用[25,32];第二,STN向GPe投射Glu神经纤维,而GPe 的神经元又向上游Str 投射神经连接,β振荡还可通过STN→GPe→Str路径向上传递给Str[33];第三,由于SNr和丘脑以及丘脑和M1之间也存在许多相互的神经纤维投射[34],β振荡还可通过STN→SNr→Tha→M1 路径向下游SNr 核团传递,再向上间接传到M1。M1增强的α/β同步振荡电活动不能有效驱动外周运动神经元募集更多肌纤维,从而导致运动疲劳的产生。有研究也发现,使用β频段电刺激运动皮层会降低运动输出[33],为此可以认为β振荡同步化增强可以“抑制”回路,使运动编码不能在更精细的空间分辨率上进行[34,35],从而抑制了脊髓运动信息的输出[36]。
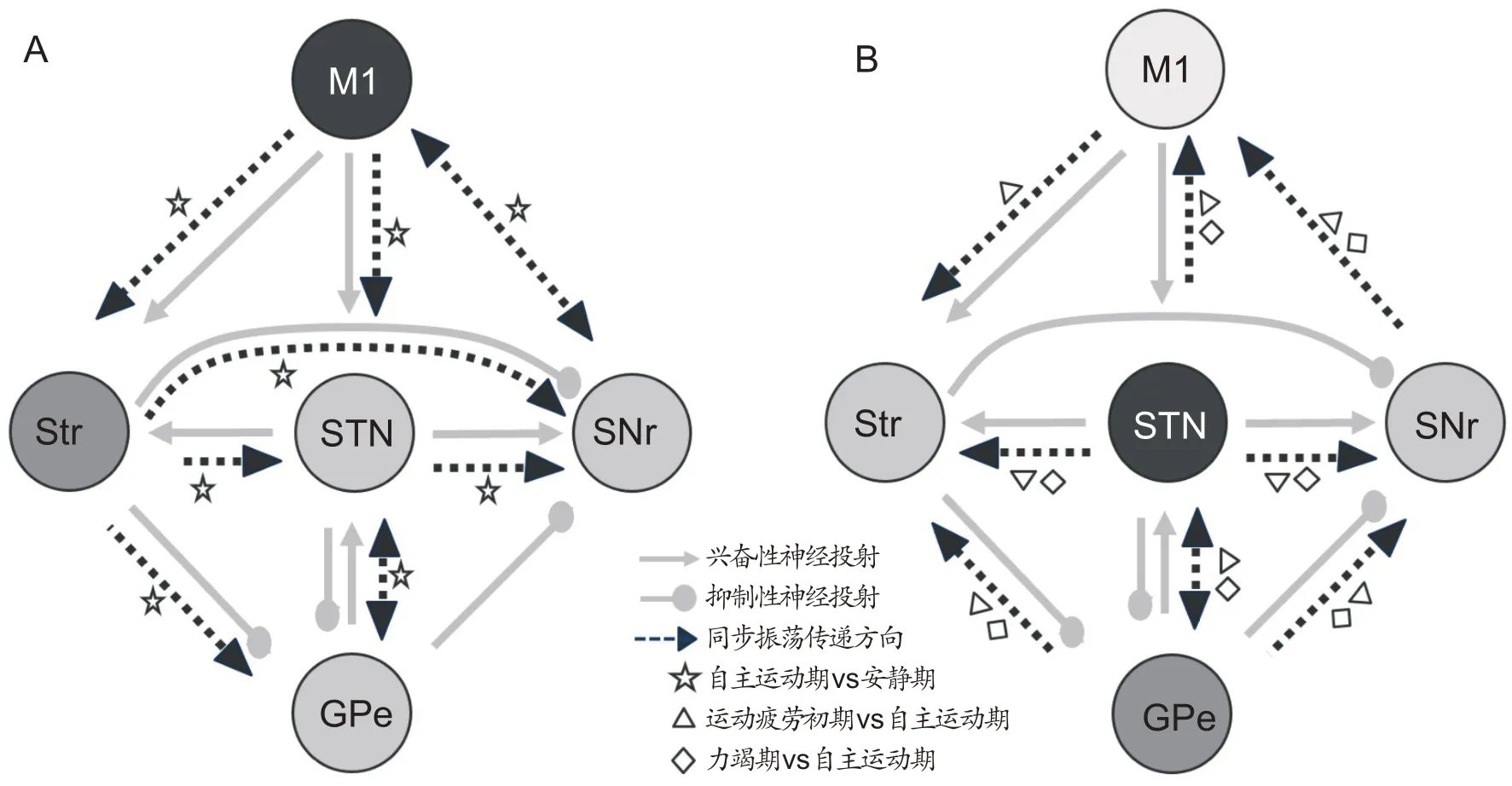
图9 皮层-基底神经节同步振荡的传递路径
3.3 STN-GPe环路可能是α/β振荡同步化起源的分析
STN 和GPe 之间存在大量互惠的神经纤维投射,形成局部微环路。STN向整个基底神经节提供快速的兴奋性Glu能输入[37],而GPe为整个基底神经节提供广泛的抑制性GABA 能输入[38]。当STN 的兴奋性神经元持续受到刺激产生兴奋性突触后电位(EPSPs)传递到GPe时,可使其产生抑制性突触后电位(IPSPs),然后又回传给STN兴奋性神经元,使得兴奋性停止响应,直到抑制性动作电位的发放也结束,开始另一个周期。这种连接方式就如电路的振荡器一般,只要有刺激不断地输入到这个微环路,它就会以某种频率产生振荡。此外,STN还受来自大脑皮层的兴奋性Glu能投射的影响,研究表明,来自皮层的兴奋性输入对GPe-STN微环路振荡电活动的影响可能与它们之间的异突触长时程增强(hLTP)有密切联系[39],过度激活的运动皮层神经元纤维投射到STN可过度诱导GPe神经元的hLTP,从而导致GPe 传入STN 的抑制性输入过分增强[40]。我们认为正常状态下大脑皮层的输入对GPe-STN 突触的hLTP 起到重要调节作用,随着运动的持续,运动皮层的过度激活使得GPe-STN突触的hLTP达到较高水平,过度增强的hLTP 可能是运动疲劳状态下机体诱导出的一种代偿机制:大脑皮层释放兴奋性Glu 递质增加,加强了M1-STN的兴奋性突触功能连接,为了维持STN的功能稳定,STN加强GPe-STN的突触功能连接,抵消Glu 对STN 的兴奋作用。但由于GPe-STN 之间存在一个作用相反的反馈微环路,加之STN 神经元拥有特殊的膜电位特性,使其对GABA 的IPSPs 特别敏感,当突触后膜上超极化的程度足够大时,反而使得STN 神经元产生去极化电流[41,42],加剧同步化振荡的发生。此外,由于STN 和基底神经节其他核团均有广泛纤维投射连接,使其具备向其他核团传递同步振荡的结构基础。关于更深层的振荡电活动产生机制,需在细胞层结构的基础上进行多核团单细胞放电记录才能进一步解释。
4 结论
大鼠力竭运动发生过程中,皮层–基底神经节环路中出现广泛增强的δ/θ同步振荡电活动呈现促运动效应,兴奋运动皮层促进自主运动,δ/θ振荡的起源和传递路径可能是以M1 为起始向基底神经节各核团传递或M1 先传递给纹状体然后再传递给基底神经节其他核团。随着运动疲劳的产生,皮层–基底神经节环路中出现广泛增强的α/β同步振荡则呈现抑制运动效应,抑制运动皮层兴奋诱发运动疲劳,且GPe-STN微环路可能是这种振荡电活动产生的源头,并通过STN→M1 和GPe→STN→SNr→M1 路径参与对运动皮层兴奋性的调控,这可能是运动疲劳出现时人体实现对皮层保护性抑制的重要途径之一。

