运动干预毒品成瘾环路:内啡肽的调节作用研究进展
孙鲁月 周跃辉
曲阜师范大学体育科学学院(山东曲阜 273165)
当前各种戒毒举措多以美沙酮替代疗法为“金标准”,但该药物介入治疗的效果存在一定局限性,并伴有副作用(它本身是一种成瘾物质),尤其不能实现长期、有效地预防复吸。戒毒的关键和难点在于预防复吸。运动被认为是一种潜在的戒毒新方法。大量的流行病学、循证医学和随机对照实验研究发现,运动能够有效降低毒品渴求,减少戒断症状,预防复吸[1-4]。2019年司法部发布《中国司法行政戒毒工作发展报告》,强调把科学运动戒毒作为一种新技术、新方法部署未来戒毒工作发展模式。虽然,大量研究已经证实运动在毒品成瘾者大脑、生理和心理层面产生积极的干预效果,但运动干预戒毒的机理目前尚不清晰,这将阻碍我国运动干预戒毒工作的开展。
毒品成瘾可诱发奖赏愉悦、学习记忆、抑制控制和行为动机等脑神经环路的功能连接失调,从最初使用毒品到强迫性滥用毒品,意味着前额叶皮层对其下行海马、杏仁核等脑区的执行功能紊乱[5,6]。作为一种天然的大脑奖赏物质,内啡肽(endorphin,EP)能产生类似毒品的欣快感,通过参与成瘾环路中奖赏愉悦感产生、情绪记忆形成、抑制和动机控制的调节过程介导毒品成瘾,是毒品成瘾的共同作用介质[7]。另一方面,运动可以提高EP的水平,尤其是中高强度运动,可短时间、大幅度地提升机体中枢和外周的EP 浓度[8-10]。这可能是运动干预毒品成瘾环路的作用机制。因此,本研究将从毒品成瘾环路、EP 在毒品成瘾环路中的作用、运动对EP的影响,以及EP在运动干预毒品成瘾环路中的作用4个方面进行综述,旨在揭示运动戒毒的EP机制。
1 毒品成瘾环路
美国药物依赖研究所在2006年提出了毒品成瘾的神经环路理论[5],认为成瘾的脑区可分为奖赏愉悦、学习记忆、抑制控制及行为动机4 条成瘾环路(图1)。其中,奖赏环路的异常激活会导致记忆环路损伤,而记忆环路的损伤又反向强化奖赏环路异常。随着毒品的反复滥用,条件反射形成并固化,使得这种由毒品诱发的成瘾记忆可通过联想学习的方式,进一步增强吸毒的动机[11]。同时,异常化的奖赏环路改变了前额叶皮层的功能活性,造成情感信息加工与处理障碍,减弱认知控制能力,增强用药冲动性,进而产生不顾后果的觅药行为和动机[6,12]。当毒品戒断后,前额叶皮层与杏仁核相互作用,促使戒断场景重新激活成瘾记忆,导致恶性的复吸循环[13]。上述研究提示,奖赏和认知(记忆和控制)环路功能异常,是毒品成瘾及复吸的重要原因。
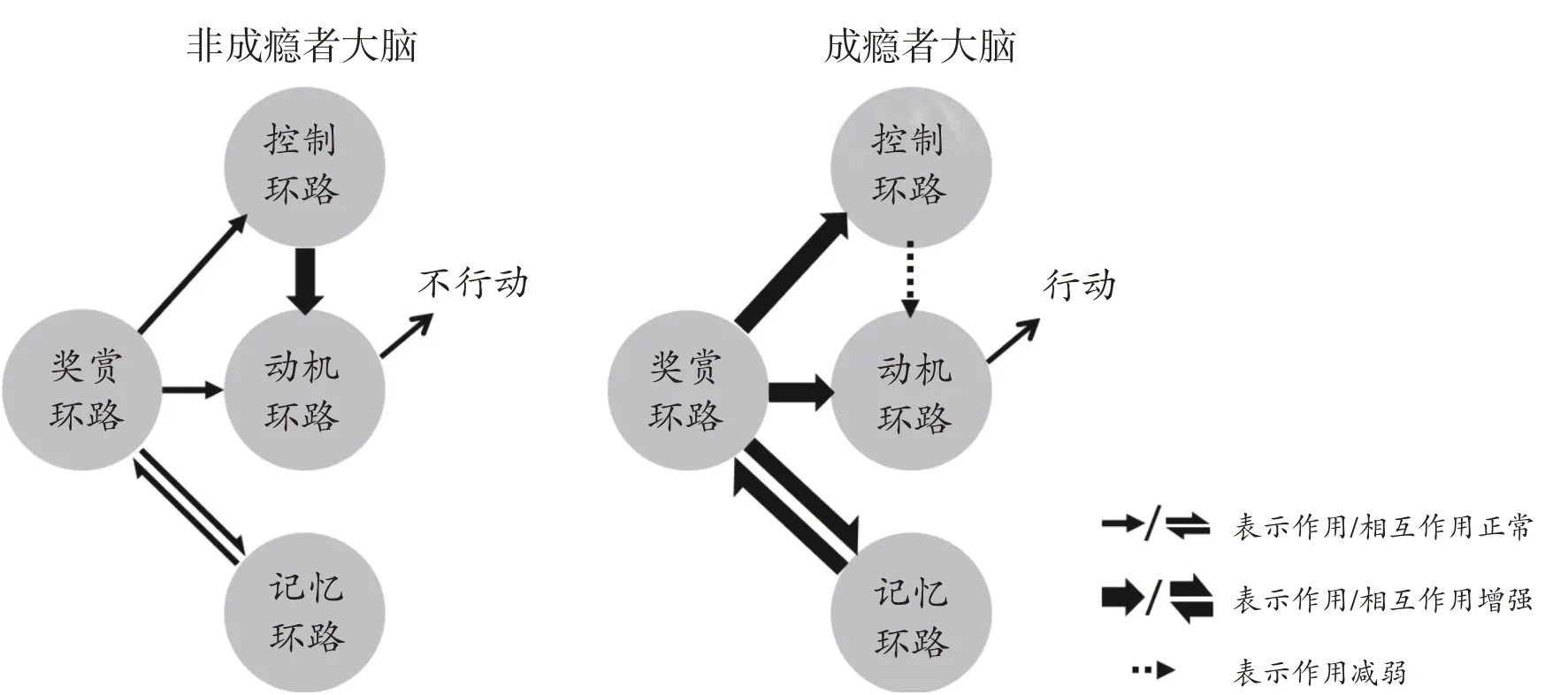
图1 毒品成瘾环路[5]
2 内啡肽在毒品成瘾环路中的作用
EP 是一种内源性的类吗啡样肽类激素,包含α、β和γ等亚型,具有镇痛、奖赏、情绪、认知调控以及免疫等功能[14,15]。在海马、皮层、伏隔核和杏仁核等成瘾环路脑区,分布着大量的阿片受体。外源性阿片样物质(如毒品)与内源性阿片样物质竞争性结合这些受体,导致内源性EP 系统的功能损伤,造成奖赏环路异常,进而也影响到其他环路,诱发成瘾性认知障碍及戒断症状[16,17]。
2.1 参与奖赏愉悦
条件性位置偏爱(conditioned place preference,CPP)模型被广泛应用于评估滥用药物的奖赏效应。有研究运用该范式建立小鼠可卡因依赖模型,向小鼠侧脑室注射β-EP可显著增加其活动水平(行为敏感性),并产生了显著的CPP现象,而采用纳洛酮可阻断β-EP所产生的这种积极效应[18]。这说明EP是毒品发挥奖赏效应的关键物质。另外,EP 还可通过与多巴胺(dopamine,DA)、内源性大麻素等多个系统相互作用来介导毒品奖赏和强化效应。例如,多项研究表明β-EP诱导的药物强化和DA 释放的增加呈正相关[7,16];内源性大麻素受体CB1与EP 高适配受体——μ阿片受体可发生异二聚化,产生协同作用,共同抑制γ-氨基丁酸(γaminobutyric acid,GABA)的释放,强化奖赏效应[19]等。
2.2 参与认知调控
内源性脑EP可介导生理遗忘机制,与DA、去甲肾上腺素(norepinephrine,NE)、促肾上腺皮质激素联合作用,影响记忆的获得、巩固和恢复[16]。此外,EP 神经元可向前额叶皮层、海马和杏仁核等中脑边缘DA奖赏脑区发送投射信号,参与毒品成瘾的认知调控[16]。这些脑区参与记忆的形成、认知控制等神经活动,其功能完整性与毒品成瘾诱发的病理性记忆形成和抑制控制能力受损密切相关[17]。例如,负责学习记忆的海马前体细胞分布有大量阿片受体,增加β-EP 含量或其μ受体活化水平,能显著提升海马前体细胞的增殖水平。相反,阻断这些受体,则会抑制海马前体细胞的增殖[20]。再者,负责高级认知调控的前额叶皮层EP 及阿片受体功能紊乱,是成瘾药物诱发认知控制损伤的重要原因[6,21]。前额叶皮层也是毒品戒断场景重新激活成瘾记忆的重要枢纽。其可将戒断场景激活的成瘾记忆信号重新投射到杏仁核另一神经元进行记忆信号提取,从而诱导复吸的发生[13]。
2.3 参与行为动机
毒品戒断期间产生的生理(躯体)和心理(精神)戒断症状,是导致复吸行为动机的主要原因[6]。EP 介导上述戒断症状,尤其β亚型。如海洛因戒断早期β-EP水平降低,并至少可持续1个月,且其吸毒渴望度和焦虑水平与β-EP水平成负相关[22]。同时,阿片受体(尤其是μ阿片受体)也是各种毒品成瘾中的重要调节介质。长期的毒品滥用也会造成阿片受体的耐受性,改变其密度和活性,破坏中脑边缘DA 奖赏系统的功能完整性,致使低剂量的毒品摄入量无法满足机体奖赏系统的需求,进而产生一系列的躯体和精神戒断症状[23],造成强烈的吸毒行为动机。
3 运动对内啡肽的影响
运动应激可通过体温升高、氧张力变化、能量代谢、下丘脑-垂体-肾上腺(hypothalamic pituitary adrenal,HPA)轴的激活和血浆离子浓度的变化等方式,引起EP 在下丘脑基底部及延髓孤束核等多个部位的持续性应答。EP 对维持运动中机体的内环境稳态具有一定的良性作用。如在温度异常(过热或过冷)的情况下,EP 可发挥体温正常化效应,维持运动中体温的相对恒定。另外,作为一种抑制性的神经递质,在大强度运动应激时,EP还可作用于呼吸中枢,抑制呼吸频率、降低肺部通气功能,以延缓呼吸肌的过度疲劳[15]。由此可见,运动中EP的释放可能是机体的一种保护性机制。
毒品成瘾者机体中内源性EP 及其受体在成瘾过程中会发生根本性变化,致使成瘾者戒断后血浆β-EP水平较常人普遍偏低[24-26]。而运动,无论是长期运动[24,25]还是急性运动[24],均可促进毒品成瘾者血浆β-EP 水平的升高。且有研究推测,运动促使机体对毒品诱导的渴求行为的减弱是由于运动激活了内源性阿片肽系统[27]。这提示,EP 可能在运动干预戒毒过程中发挥重要作用。但EP 的释放,尤其是β-EP,受运动方式、运动强度及运动时间等多种因素的影响(表1)。
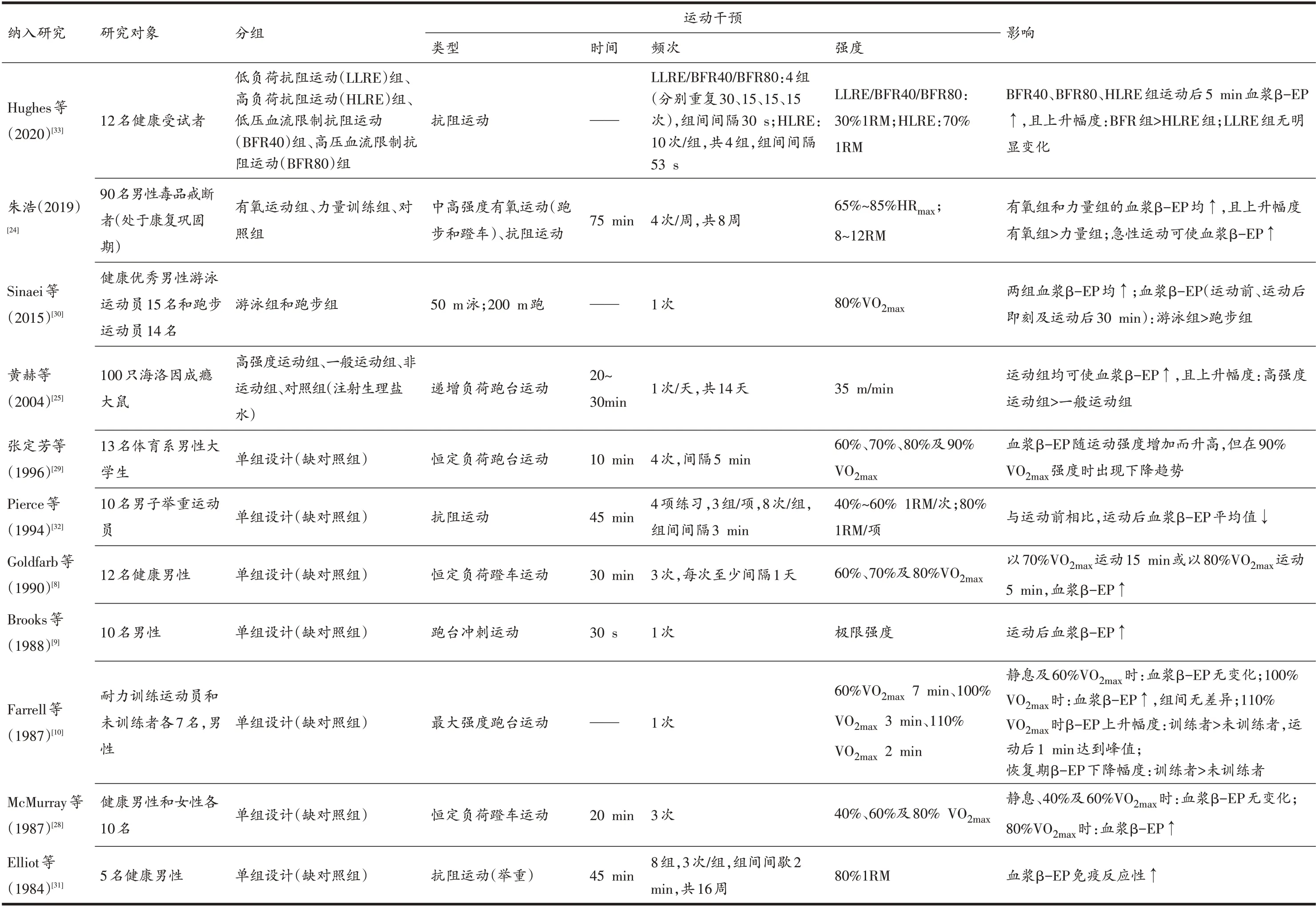
表1 不同运动干预对β-EP的影响
3.1 运动方式
当前与β-EP 相关的运动方式主要为有氧运动和抗阻运动。中高强度的有氧运动已被证明会增加运动中及运动后血浆β-EP浓度[8,10,28-30]。而抗阻运动对β-EP水平的影响研究结果不一致。Elliot等[31]研究发现,持续16 周的举重运动可显著增加血浆β-EP 的免疫反应性。而Pierce 等[32]则表示抗阻运动不能显著增加运动后血浆β-EP水平,并可能会使其浓度下降。其推测造成结果不同的可能原因为运动方案及受试者心理状态的差异。Hughes 等[33]采用血流限制、不同负荷等多种抗阻运动方式进行研究,结果发现高负荷抗阻运动和血流限制训练均能提高血浆β-EP浓度,而低负荷抗阻运动对其无明显影响。由此可见,不同运动方式均可对EP产生影响,运动强度可能是其中的关键调控因素。
3.2 运动强度
β-EP 的变化具有强度依赖性。McMurray 等[28]固定运动时间,发现60%VO2max及以下强度的一次性运动不会引起β-EP 变化,80%VO2max才会明显提升血浆β-EP浓度;Goldfarb 等[8]研究表明,提高血浆β-EP的临界阈值强度至少为70%VO2max,此外,强度越大,β-EP 升高速度越快;而张定芳等[29]研究认为,血浆β-EP浓度从60%VO2max时开始上升,在90%VO2max时反而会出现下降。上述研究提示,β-EP 与运动强度之间呈倒“U”型关系,60%VO2max和80%VO2max可能分别是其阈值、峰值强度。
3.3 运动时间
运动时间不单独对β-EP起作用,可能与强度共同起调节作用,即强度越大,β-EP水平升高越明显,所需时间也越少。30 s 极强冲刺跑即可引起血浆β-EP 浓度大幅提高,其升高水平至少为静息水平的2 倍[9]。Goldfarb等[8]对此也进行了研究,结果显示以80%VO2max强度运动5 min,血浆β-EP 浓度即可显著上升;而以70%VO2max强度运动时,需至少15 min才可达到同等水平。由此可见,运动强度与运动时间的相互作用对EP水平的影响十分明显,可能是影响EP水平的最主要因素。
3.4 其他
运动项目及训练水平的不同也可导致β-EP 不同的运动性应答。游泳较跑步能释放更多的β-EP,前者静息β-EP 水平也较后者高,其可能与BMI、环境有关[30];Farrell 等[10]探讨了训练水平对β-EP的影响,发现训练者血浆β-EP 水平在极限强度运动中显著高于未训练者,其恢复期β-EP 的下降水平也较后者高,这表明训练水平可改变EP系统对运动应激(尤其是在极端条件下)的适应能力。此外,运动时的环境温度、个体差异以及采血的时间与方式等都有可能会对β-EP 水平造成影响,这可能也是造成许多研究结果不一致的原因。
4 内啡肽在运动干预毒品成瘾环路中的作用
4.1 发挥奖赏替代作用,降低渴求度
渴求度是用于评价毒品戒断者复吸发生率的主要指标。运动被证明可有效减缓毒品成瘾者的渴求度,预防复吸[2,3]。其机制可能为运动可调控紊乱的大脑奖赏系统,提高DA 等神经递质的含量,从而促进机体对抗外源性毒品的不良奖赏刺激,降低毒品渴求。而EP 是机体奖赏效应的主要调节因子。β-EP 与机体奖赏系统的中心——中脑边缘DA 系统存在互促作用。β-EP可通过与μ阿片受体结合,抑制GABA能神经元,从而使DA 能神经元去抑制化,促进伏隔核(奖赏环路主要脑区)等脑区DA的释放,激活奖赏效应,引发欣快感[15]。这也是阿片类药物成瘾的主要机制。
EP 在降低渴求度中的具体作用表现在如下两个方面:第一,运动产生的内源性EP 可以同毒品产生的外源性EP 竞争结合阿片受体,激活奖赏效应,促进伏隔核(奖赏环路主要脑区)等脑区DA的释放,使机体产生欣快感。第二,运动可促进毒品戒断者EP 的合成,当外源性EP 无法得到补充时,运动产生的EP 可发挥心理代偿作用,改善毒品戒断期所产生的心理戒断症状及不良情绪反应。由此可推测,EP主要通过发挥毒品的奖赏替代效应来降低毒品渴求,即运动干预促使机体产生具有内源性竞争和代偿性的EP[34],拮抗机体对外源性毒品的需求,模拟毒品带来的兴奋刺激,从而实现降低渴求度的目的。此外,长期的运动干预还可以引起阿片受体的适应性改变,使大脑奖赏系统趋于正常化[1,17],进而达到长期抑制毒品渴求、降低复吸率的效果。
4.2 减少戒断症状,降低吸毒动机
戒断综合征是指成瘾个体停止或减少用药后所诱发的躯体及精神戒断症状。躯体戒断症状是指机体产生的恶心呕吐、震颤、肌肉疼痛等一系列身体不适症状;而精神戒断症状是指焦虑、抑郁、疲乏及睡眠障碍等。与躯体戒断症状相比,精神戒断症状更难以戒除,其引起的焦虑、抑郁等负性情绪状态是诱发强烈吸毒动机的重要原因。而运动缓解上述戒断症状、降低吸毒动机的神经生物学机制也十分复杂,涉及包括EP系统在内的各神经递质系统、内分泌以及细胞间信号传递等多个方面[34,35]。
β-EP 介导躯体戒断症状。脑室插管灌流及侧脑室微量注射β-EP 可明显抑制吗啡引起的扭体、咬牙、湿抖和逃逸等自然戒断反应[36]。且目前已有动物实验研究表明,运动可通过影响中枢及外周内源性阿片肽及阿片受体的变化来降低毒品作用的敏感性,减轻其戒断症状[25,27,37]。推测运动通过EP减少躯体戒断症状的作用机理可能取决于两个方面:其一,运动促使中枢和外周内源性EP 水平升高,改善奖赏、认知等脑部神经通路紊乱,促使内源性阿片肽系统、DA 能奖赏系统等各部分脑区正常化,从而使戒断症状减轻;其二,躯体戒断症状的产生主要是由机体神经内分泌系统功能失调导致的,而EP可作用于参与戒断反应的其他递质或激素,如EP可抑制NE(可促进机体敏感性)、5-羟色胺(介导痛觉及情绪调节等)在中枢的活性[15,34],调节机体内分泌系统及生理功能,从而维持机体的稳态,减少躯体戒断症状。
此外,运动还能有效缓解毒品戒断者的焦虑和抑郁症状[2,3],进而缓解精神戒断症状。而进一步的机理研究发现,跑步等运动后引起的各种心理效应,包括压力减轻、焦虑缓解、情绪提升以及痛觉降低等,即“跑步者高潮”与内源性阿片肽系统有关[38]。由此,EP参与毒品戒断者运动干预过程中情绪的调控。其主要表现为:一方面,EP尤其是β亚型,可调节人的情绪,缓解焦虑、抑郁等负性情绪状态。β-EP神经元信号的增强可显著增加酒精依赖大鼠对高架十字迷宫开放臂的探究活动,表明了β-EP的抗焦虑作用[39]。推测其机理与β-EP参与HPA轴(介导中枢压力应激反应)的活性变化,从而缓解了紧张和压力,降低了吸毒动机有关。另一方面,EP及其受体可介导运动带来的正性情绪状态。阿片受体可介导运动诱发的积极情绪效应,采用纳洛酮阻断该受体可消除运动带来的正性情绪状态[40],这说明阿片受体活化是运动改善情绪状态的必要条件。且血浆β-EP含量的变化可能与心境的改善成正性相关,可能是介导适宜运动改善情绪状态的一个重要因素[41]。
4.3 减轻成瘾记忆,提高抑制能力
成瘾记忆是由于毒品滥用导致海马、杏仁核等学习与记忆脑区受损而形成的,是诱发毒品渴求及复吸的关键。运动可以改善甚至逆转这种病理性记忆。如长期接触吗啡会造成海马区的损伤从而损害物体位置记忆(一种海马依赖的空间记忆),而运动可以改变海马中脑源性神经营养因子(brain derived neurotrophic factor,BDNF)的表达,并增加海马结构中的神经发生,进而改善吗啡依赖大鼠的空间记忆缺陷[42]。运动可通过多重有益效应改善大脑记忆。有研究通过被动回避测试表明,跑步逆转吗啡导致的记忆缺陷可能是通过激活海马体中某些神经递质的释放而促成的[43]。EP及其受体可能是其中的一分子[44]。EP参与记忆的存储和摄取过程,在情感状态增强时可介导人类记忆特定方面的改变,选择性地修改应激条件下的大脑记忆[15]。这可能是毒品成瘾者在面临药物及药物相关线索时,发生注意力偏向[45]及强烈用药动机的原因之一。
运动还可以改善毒品成瘾者的抑制能力,推测与EP 也有一定联系。抑制能力是机体抵制诱惑或冲动行为的一种自我控制过程,与之相关的主要脑区为前额叶皮层。长期的毒品滥用造成该脑区损伤,使其对动机行为的抑制控制能力减弱,进而导致强迫性用药行为的发生。来自脑电的证据表明,运动尤其是急性中等强度有氧运动可有效改善甲基苯丙胺依赖者的抑制能力损伤,其机制可能与前额叶皮层的激活有关[46]。而前额叶细胞中含有大量μ阿片受体及阿片肽,且μ阿片受体的激活与前额叶皮层细胞的活动相关[26]。加之与学习记忆有关的海马、杏仁核脑区均有EP及其受体分布,由此推测运动减轻成瘾记忆、提高抑制能力的过程中有EP的参与,但其具体效应机制还需进一步研究。
综上,EP可在涉及毒品成瘾环路的多个脑区发挥调节作用(图2)。如EP可通过抑制腹侧被盖区GABA能神经元促进伏隔核、前额叶皮层等脑区DA 的释放,激活奖赏效应;可作用于前额叶皮层和杏仁核,通过戒断场景重新激活成瘾记忆,诱发复吸等。这提示,保持、改善内源性EP 及其受体功能,有助于预防和治疗外源性EP样物质或EP受体激动剂(如鸦片、吗啡和海洛因等)诱发的奖赏和认知环路损害。一旦EP分泌紊乱,则可能会加剧这些脑区的功能损伤,促使毒品诱发病理性记忆和不良奖赏效应。
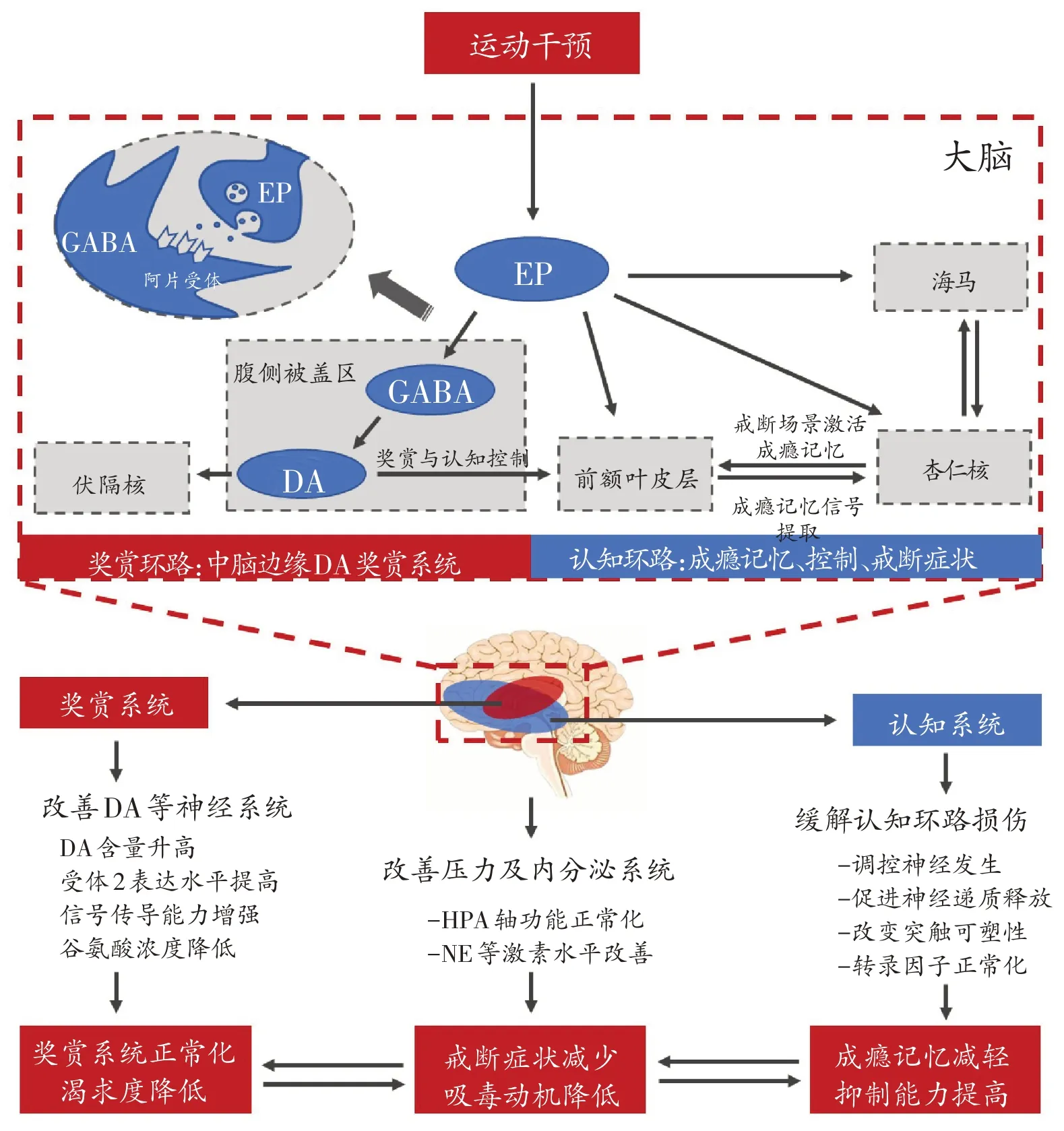
图2 内啡肽在运动干预毒品成瘾环路中的作用路径
运动干预毒品成瘾环路的途径主要表现在:首先,运动通过提高中脑边缘奖赏系统DA的含量、受体2表达水平和信号传导能力,以及降低谷氨酸浓度等途径,促使紊乱的奖赏系统功能正常化,降低渴求度[2];其次,运动能够调控神经发生、神经递质释放、突触可塑性改变、转录因子表达等分子事件,缓解成瘾环路的认知损伤,减轻成瘾记忆,增加拒毒控制力[17];再者,运动通过调节HPA轴及NE等激素水平等方式,改善压力及内分泌系统,改善焦虑、抑郁等情绪状态[34,47],促进生理和心理健康,减少毒品相关的戒断症状,降低吸毒动机。而这3条途径均与EP直接或间接相关。EP的主要作用在于产生欣快感,重塑奖赏通路,在抑制控制、记忆等功能的调节方面虽不具有决定性作用,但也可产生一定影响。运动可通过促进中枢释放EP等肽类神经递质,改善阿片受体功能等方式干预毒品成瘾,发挥以上相关效应。这提示,基于EP成瘾环路的运动干预处方,将为戒毒的运动干预实践提供更加有效的循证依据。
5 小结与展望
5.1 小结
5.1.1 奖赏环路和认知(学习记忆和认知控制)环路功能异常,是毒品成瘾的重要原因。
5.1.2 EP在毒品成瘾环路中参与奖赏愉悦、认知调控和行为动机等过程。
5.1.3 EP 的释放,尤其β-EP 受运动方式、运动强度及运动时间等因素影响。其中运动强度是影响EP 释放的最主要因素,且两者可能存在“U”型关系。
5.1.4 EP 在运动干预毒品成瘾环路中的作用主要表现为发挥奖赏替代效应,降低渴求度,减少躯体症状,降低吸毒动机,以及减轻成瘾记忆,提高抑制能力。
5.2 展望
5.2.1 运动促进毒品戒断者康复的作用机理研究,将有助于运动干预戒毒实践的广泛开展。然而,当前研究主要集中在外周血液、脑电、生理和行为等层面,缺乏围绕毒品成瘾脑神经环路的运动干预机理研究,尤其运动干预对成瘾脑区肽类神经递质的生物学作用研究相对较少。考虑到肽类递质EP 在成瘾环路中发挥着奖赏替代、认知改善与动机调控等效应,且在毒品成瘾相关的奖赏、记忆和抑制控制等脑区中存在着大量阿片受体,后续研究可通过基础研究,从细胞、分子层面,探讨EP在运动干预毒品成瘾环路中的信号转导通路。
5.2.2 基于EP成瘾环路的运动干预处方,将为戒毒的运动干预实践提供更加有效的循证依据。需要注意的是,运动可通过EP 作用于成瘾环路,但针对毒品成瘾人群,不同类型、强度、时间和频次的运动干预,EP 反应如何?与正常人的EP 反应是否具有差异性?尚需进一步深入探究。此外,在制定运动处方时,由于毒品成瘾者的身体状况及机能较差,运动方案的不合理可能造成其系统功能的进一步紊乱,故如何科学地制定毒品戒断者的运动干预方案也是一个值得关注的课题。

