伯氏疟原虫PbPH表达特点和单克隆抗体传播阻断效应研究
张耀文 , 刘鹏波, 寇 旭 , 郑文琪 , 刘 飞, 王美莲*
(1.中国医科大学基础医学院 病原生物学教研室,辽宁 沈阳 110021;2.中国医科大学基础医学院 免疫学教研室,辽宁 沈阳 110021)
雌性按蚊传播的疟疾是一种虫媒传染病,其病原体为疟原虫。尽管人类在控制疟疾方面取得了一定的进展,但是2019 年WHO世界卫生组织报告的数据显示,2018 年全球仍有约2.28 亿疟疾病例,其中死亡约40.54 万人[1]。因此,世界卫生组织提出区域疟疾消除计划,以2030 年实现“最少35个国家完全消除疟疾”为目标。然而,这一目标的实现却面临着若干技术的挑战,包括间日疟原虫和恶性疟原虫共同流行的许多地区间日疟原虫的发病率或比例的增加。目前,治疗疟疾依然主要依靠以青蒿素为基础的复方药物或药浸蚊帐。然而,疟原虫和按蚊分别对抗疟药物和杀虫剂耐药性的日益增加,严重阻碍了对疟原虫传播的有效控制,因此,开发高效的传播阻断疫苗迫在眉睫[2-3]。传播阻断疫苗(transmission blocking vaccine,TBV)是通过阻断蚊中疟原虫的发育阻止疟疾的传播。基本原理是通过有性阶段或蚊阶段寄生虫的表面抗原免疫人类,从而在人体内诱导相应抗原的抗体,阻止疟原虫在蚊中肠内的进一步发育,从而阻断疟疾的传播[4]。然而到目前为止,针对疟原虫有性阶段传播阻断疫苗候选抗原的筛选却不太理想,目前主要包括候选抗原Pfs25、Pfs48/45 和 Pfs230。针对Pfs25产生的抗体主要抑制合子在蚊子肠道内的发育[5-6];Pfs48/45是配子体细胞膜蛋白,其在配子出现后从红细胞中释放出来,其抗体可阻断疟原虫卵囊的形成,从而阻断恶性疟原虫的传播[7];Pfs230在恶性疟原虫有性期表面形成复合物参与雄配子和雌配子的受精过程,以补体依赖的方式阻断恶性疟原虫的传播[8-9],其产生的抗体也可以阻止恶性疟原虫卵囊发育[10]。根据中国医科大学基础医学院病原生物学教研室之前发表的数据,筛选出受精前后均有表达的PbPH作为研究对象[11]。因此,本研究制备了抗PbPH单克隆抗体,通过WB和IFA检测PbPH的表达阶段和抗PbPH单克隆抗体的特异性,并通过体外配子体出丝和动合子形成实验检测抗PbPH单克隆抗体的传播阻断效果。
1 材料与方法
1.1 材料
1.1.1 试验材料 伯氏疟原虫(Plasmodiumberghei)ANKA 株,为中国医科大学基础医学院免疫学教研室保存;6~8周龄的雌性BALB/c小鼠购自北京维通利华实验动物技术有限公司。
1.1.2 培养基 裂殖体培养基:RPMI1640,50 mg/L青霉素,50 mg/L链霉素,20%(体积分数)热灭活胎牛血清,50 mL/0.5 mL血液;动合子培养液:RPMI1640,50 mg/L青霉素,50 mg/L链霉素,100 mg/L新霉素,20%(体积分数)热灭活FCS,1 mg/L肝素钠,pH 8.0;HAT培养基;HT培养基。
1.1.3 试剂 苯肼、辣根过氧化物酶标记的羊抗鼠IgG、Alexa-488标记的羊抗鼠IgG、Hoechst33258 (美国Invitrogen 公司);Alexa-555标记的羊抗兔IgG(英国Abcam);抗Pbs21 单克隆抗体由日本自治大学Hiroyuki Matsuoka 教授赠予;RPMI 1640、胎牛血清(美国Thermo 公司);肝素钠及其余化学试剂(鼎国昌盛生物技术有限责任公司)。
1.1.4 仪器与设备 移液器(QZ07508,Thermo公司);垂直电泳槽(EPM-7552,上海天能科技有限公司);电转槽(Bio-Pad,美国);分析天平(L-1660DTP,日本Shimadzu);电热恒温培养箱(HH-B11-420,上海跃进医疗器械厂);OLYMPUS显微镜及成像系统(BX53,日本OLYMPUS公司);涡旋振荡器(VORTEX-5,海门其林贝仪器制造有限公司)。
1.2 方法
1.2.1 抗PbPH单克隆抗体的制备 利用已纯化的rPbPH重组蛋白对BALB/c雌性小鼠进行免疫,免疫过程和方法与文献[11]基本相同,于末次免疫后3~4 d,分离出小鼠脾细胞与SP2/0骨髓瘤细胞进行融合培养。经过聚乙二醇处理后,将融合培养的细胞适当稀释,分置于96 孔培养板中,培养24 h后加入4×HAT选择培养基,每隔2~3 d更换一次培养基(1×HAT),定期观察其生长状况。2周左右更换为HT培养基,待杂交瘤细胞长至孔底面积1/3时,取其培养上清用间接ELISA法检测抗体含量,经2 次检测阳性的细胞,按照有限稀释法进行克隆,至阳性率达到100%,且抗体滴度基本一致时,筛选出克隆株[12-13]。
1.2.2 抗PbPH单克隆抗体的收集 将筛选出的杂交瘤细胞用含5%胎牛血清的RPMI1640培养基进行大量培养,待细胞生长旺盛时,离心收集上清液,提纯备用。预先给小鼠腹腔注射液体石蜡,1周后将杂交瘤细胞接种到小鼠腹腔中,10 d后采集腹水离心后,取上清液进行纯化。
1.2.3P.berghei裂殖体/配子体/动合子的收集及其疟原虫抗原的提取 收集裂殖体,雌性BALB/c 小鼠经尾静脉注射1×106个P.berghei感染的红细胞,待感染率达到3%时,乙醚麻醉小鼠,收集肝素化血液置于裂殖体培养基中,然后于37 ℃的10% O2、5% CO2和85% N2温箱中孵化20 h[11]。培养物经58%(体积分数)的Nycodenz密度梯度进行分级分离,收集中间灰白层的裂殖体,经PBS清洗2次,取1 μL进行Giemsa染色,光学显微镜下检测裂殖体含量与纯度。收集配子体,苯肼处理过的雌性BALB/c小鼠尾静脉注射1×107个P.berghei感染的红细胞,于感染第4天,给小鼠饮用磺胺嘧啶(20 mg/L饮水)2 d。乙醚麻醉小鼠,心脏采血并将血液保存在冰上以避免过早活化配子体,经48%(体积分数)的Nycodenz分离,收集中间灰白层配子体,PBS洗涤2次,取1 μL进行Giemsa染色,光学显微镜下检测配子体含量与纯度[11]。收集动合子,用1×107个P.berghei感染的红细胞感染苯肼处理过的雌性BALB/c小鼠,于感染第3天,乙醚麻醉小鼠,心脏采血,1 mL血液置于9 mL动合子培养液中。19 ℃培养24 h,然后用62%(体积分数)Nycodenz密度梯度离心,收集中间灰白层动合子,PBS清洗2次,取1 μL进行Giemsa染色,光学显微镜下检测动合子含量与纯度。收集纯化的伯氏疟原虫,用0.2%的皂角苷裂解去除红细胞。伯氏疟原虫抗原经裂解液(1% TritonX-100、2% SDS、PBS溶解,含有蛋白酶抑制剂)裂解30 min。10 000 r/min离心10 min,取上清BCA定量,-80 ℃保存。
1.2.4 Western Blot检测抗PbPH单克隆抗体的特异性 将等量的伯氏疟原虫抗原(30 μg/泳道)于10% SDS-PAGE凝胶上进行分离,电泳结束后,4 ℃ 45 V恒压转膜3 h后,先用5%(质量分数)TBST溶解的脱脂奶粉4 ℃封闭2 h,然后TBST清洗3次。清洗后的膜分别与TBST稀释的抗PbPH单克隆抗体(1∶500)和抗rHSP70鼠血清(1∶500)于4 ℃结合过夜。再次用TBST将膜清洗3次,每次5 min,再用TBST(1∶5 000)稀释的辣根过氧化物酶HRP标记的山羊抗鼠IgG抗体在37 ℃孵育2 h,用TBST将膜清洗3次。最后进行ECL发光,在荧光图像分析系统中对其进行检测。
1.2.5 间接免疫荧光实验检测PbPH的表达阶段 为确定抗PbPH单克隆抗体是否能检测到PbPH天然构象蛋白,将苯肼处理过的雌性BALB/c小鼠经尾静脉注射1×107个P.berghei感染的红细胞,感染后第3天,取10 μL感染小鼠尾血制备雌雄配子体、雄配子出丝(25 ℃孵育15 min)、雌配子/合子(25 ℃孵育2 h)、动合子(19 ℃孵育24 h)样品,用4%多聚甲醛和0.007 5%戊二醛室温条件下固定30 min,经PBS洗1次后,透膜组用0.1% Triton X-100透膜10 min,透膜组和不透膜组均加入5%脱脂奶粉/PBS封闭1 h。经PBS洗1次后,透膜组加入1∶500倍稀释的抗rPbPH单克隆抗体和Marker(雌配子体:兔源抗-Pbg377多抗;雄配子体:兔源抗-α-tubilin多抗;合子及动合子:兔源抗-Pbs21多抗)孵育1 h。不透膜组加入1∶500倍稀释的抗rPbPH单克隆抗体孵育1 h后,PBS洗涤3 次,0.1%Triton X-100透膜10 min,5%脱脂奶粉/PBS 封闭1 h后,再加入1∶500倍稀释的Marker混合液孵育1 h。PBS漂洗后,加入1∶500倍稀释的Alexa-488标记的羊抗鼠IgG和Alexa-555标记的羊抗兔IgG孵育1 h。PBS漂洗后,加入1∶1 000倍稀释的Hoechst33258进行细胞核染色15 min后,荧光显微镜观察结果[14]。
1.2.6 体外配子体出丝数的检测 为确定抗PbPH单克隆抗体是否影响配子体出丝,将苯肼处理过的雌性BALB/c 小鼠经尾静脉注射1×106个P.berghei感染的红细胞,感染后第3天,取10 μL感染小鼠的尾血与40 μL动合子培养基稀释的抗PbPH单克隆抗体/PBS(1∶5、1∶10、1∶50)混合,25 ℃培养15 min,光学显微镜计数配子体出丝数。
1.2.7 体外动合子形成的检测 为确定抗PbPH单克隆抗体是否影响动合子形成,将苯肼处理过的雌性BALB/c 小鼠经尾静脉注射1×106个P.berghei感染的红细胞,感染后第3天,取10 μL感染小鼠的尾血与90 μL动合子培养基稀释的抗PbPH单克隆抗体/PBS(以1∶5、1∶10、1∶50)混合,19 ℃培养24 h,固定培养物,以抗-Pbs21单克隆抗体(1∶500)标记,染色方法同文献[11],荧光显微镜下计数动合子形成数。
1.2.8 统计方法 采用SPSS 23.0 软件进行t检验的统计学分析,P<0.05具有统计学意义。
2 结果与分析
2.1 抗PbPH单克隆抗体的获取
利用细胞融合技术、有限稀释法、间接ELISA等实验方法,从30株单克隆杂交瘤细胞株中筛选出1株能够稳定分泌抗PbPH单克隆抗体的杂交瘤细胞,并在扩大培养后,通过相应的实验技术获取了抗PbPH单克隆抗体。
2.2 Western blot检测抗PbPH单克隆抗体的特异性
为了确定抗PbPH单克隆抗体是否识别伯氏疟原虫蛋白,对纯化后的裂殖体、配子体和动合子的裂解物进行Western blot(WB)分析。抗PbPH单克隆抗体主要识别配子体和动合子,条带大小约33 kDa,与预测的蛋白大小一致,在裂殖体抗原中未检测到相应条带(图1)。这与本教研室之前的研究结果相符合[11],证实了抗PbPH单克隆抗体可以识别疟原虫配子体和动合子。
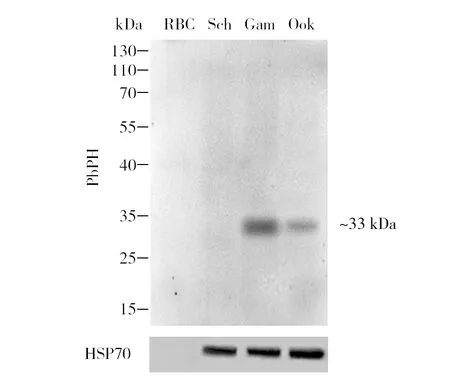
图1 WB检测抗PbPH单克隆抗体的特异性Fig.1 The specifically of anti-PbPH mAb by WBRBC:红细胞裂解液(阴性对照);Sch:裂殖体;Gam:配子体;Ook:动合子。用抗PbPH单克隆抗体(1∶500)孵育纯化后的裂殖体、配子体和动合子的裂解物(30 μg/泳道),HSP70为阳性对照,33 kDa为pbDH抗原的分子量RBC: red blood cell lysate (negative control); Sch: schizonts; Gam: gametocytes; Ook: ookinetes. The purified lysates of schizonts, gametocytes and ookinetes (30 μg/lane) were incubated with anti-PbPH monoclonal antibody (1∶500), HSP70 was used as a positive control,PbPH antigen had a molecular weight of approximately 33 kDa
2.3 IFA检测PbPH的表达阶段
利用IFA对WB的结果进行进一步验证。抗PbPH单克隆抗体可以识别雌雄配子体及雄配子、雌配子/合子、retort、动合子的表面抗原。透膜时,在配子体及其以后的阶段均检测到荧光信号;不透膜时,只在配子及其以后的阶段能检测到荧光信号;PBS对照组在这些阶段均未检测到荧光信号(图2)。与之前的研究相一致,表明PbPH可分泌到疟原虫有性阶段的膜表面,同时抗PbPH单克隆抗体可以有效识别分泌到疟原虫膜表面的蛋白。
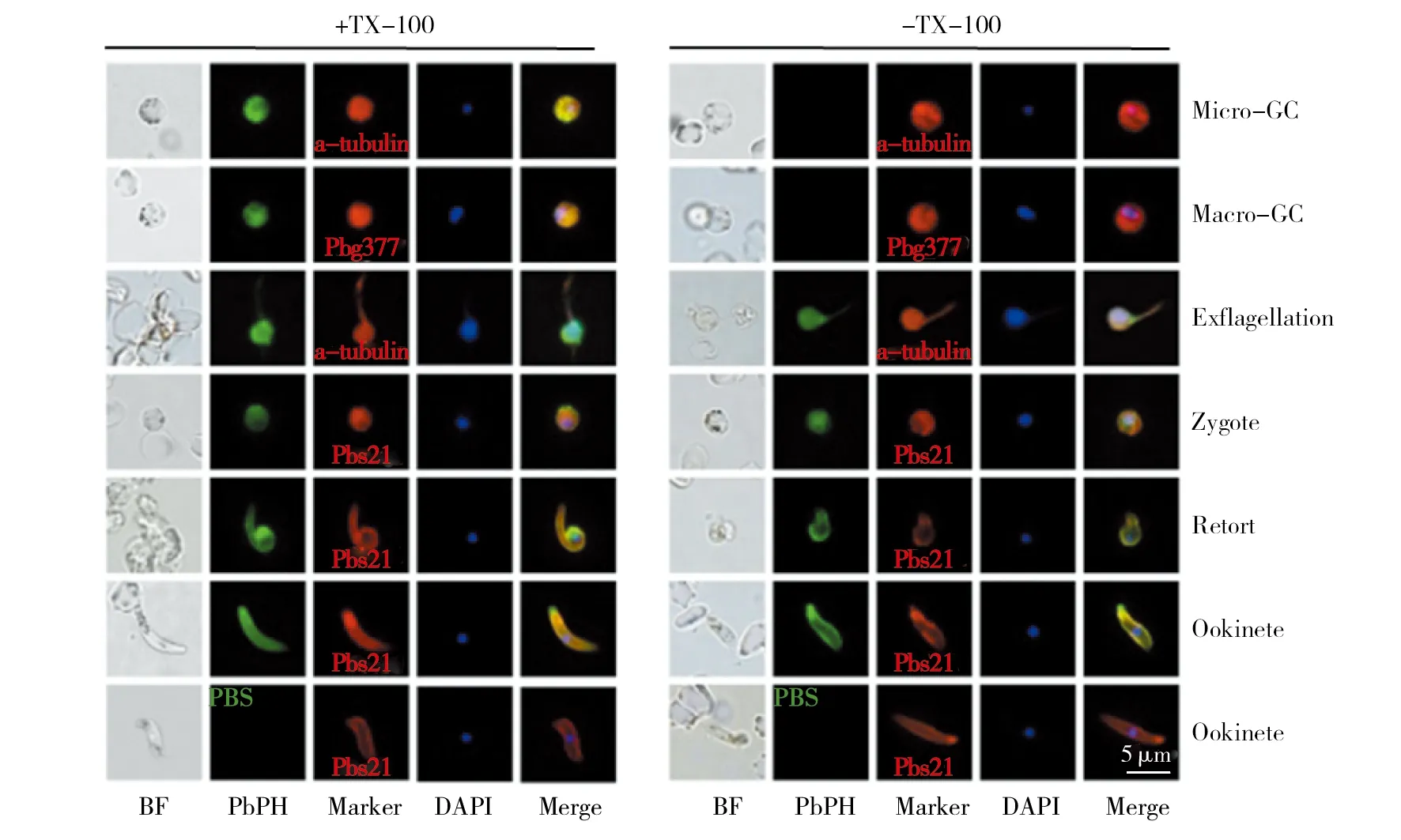
图2 IFA检测PbPH的表达阶段Fig.2 Location of PbPH in the parasites by IFABF:明视野;PbPH:抗PbPH单克隆抗体与Alexa-488标记的羊抗鼠IgG结合(绿色);Marker:雌配子体:兔源抗-Pbg377多抗,雄配子体:兔源抗-α-tubulin多抗,合子、retort及动合子:兔源抗-Pbs21多抗(红色);DAPI:Hoechst33258,疟原虫核染料(蓝色);Merge:第二、三、四列合成图。PBS为阴性对照BF: bright field; PbPH: anti-PbPH monoclonal antibody binds to Alexa-488-labeled anti-mouse IgG antibody(green); Marker: female gametocytes: rabbit anti-Pbg377 polyantibody,male gametocytes:rabbit anti-α-tubulin polyantibody, zygote、retort and ookinetes: rabbit anti-Pbs21 polyantibody (red); DAPI: Hoechst33258, Plasmodium nuclear dye (blue); Merge: PbPH+Marker+Hoechst33258. PBS was negative control
2.4 抗PbPH单克隆抗体对配子体出丝的影响
与PBS对照组相比,在加入不同释放倍数(1∶5、1∶10、1∶50)的抗PbPH单克隆抗体共同培养15 min后,配子体出丝数分别减少了41.7%、32.7%和8.3%。在抗PbPH单克隆抗体浓度为1∶5和1∶10时,差异具有统计学意义(t=2.14,P=0.038;t=3.05,P=0.003 9),表明1∶5和1∶10稀释情况下的抗PbPH单克隆抗体可以有效抑制配子体出丝(图3)。
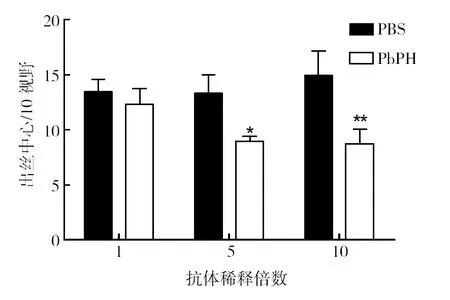
图3 体外培养检测抗PbPH单克隆抗体对配子体出丝的影响Fig.3 Effect of anti-PbPH mAb on exflagellation of male gametocytes*P<0.05;**P<0.01,下图同*P<0.05;**P<0.01,the same below
2.5 抗PbPH单克隆抗体对动合子形成的影响
与PBS对照组相比,在加入不同稀释倍数(1∶5、1∶10、1∶50)的抗PbPH单克隆抗体共同培养24 h后,动合子形成数分别减少了45.1%、14.8%和7.8%。在抗PbPH单克隆抗体稀释倍数为1∶5和1∶10时,差异具有统计学意义(t=2.73,P=0.013;t=7.62,P<0.000 1),表明1∶5和1∶10稀释情况下的抗PbPH单克隆抗体可以有效抑制动合子的形成(图4)。

图4 体外培养检测抗PbPH单克隆抗体对动合子形成的影响Fig.4 Effect of anti-PbPH mAb on ookinete conversion in vitro
3 讨 论
高效的TBV候选疫苗可能需要结合受精前后表达的抗原,以达到完全阻断传播的目的[15-16]。PbPH为受精前和受精后抗原,针对这种蛋白的抗体可能会在多个时期阻断疟原虫的传播。首先,本研究制备了抗PbPH单克隆抗体;然后通过WB和IFA验证了抗PbPH单克隆抗体的特异性,即抗PbPH单克隆抗体能有效地识别雌雄配子体、雄配子、雌配子/合子、retort和动合子。最后利用抗PbPH单克隆抗体进行了体外实验,结果表明,其单克隆抗体(1∶5、1∶10)对配子体出丝中心以及动合子的形成有明显地抑制作用,表明抗PbPH单克隆抗体具有一定的传播阻断能力。
针对候选抗原,利用不同的实验方法可以制备相应的多克隆抗体与单克隆抗体。多克隆抗体可以识别一个抗原上的多个抗原表位,利于放大抗原抗体反应,且其制备方法相较单克隆抗体简单。但是单克隆抗体只识别一个抗原上一个抗原表位的特性,使其具有极高的特异性,能在混合物中高效的结合靶标抗原,降低交叉反应的出现,产生的背景信号也明显低于多克隆抗体,并且制备的杂交瘤细胞可作为单克隆抗体持续的再生源。近年来,单克隆抗体在抗感染疾病作用上也取得了较大的进步[17]。并且在标准膜饲实验中单克隆抗体对疟原虫传播的有效阻断也清楚地证明了单克隆抗体在传播阻断免疫中的重要性[18-19]。因此,本研究利用教研室已经完成表达纯化的rPbPH蛋白[11],制备了针对该蛋白的特异性单克隆抗体。
在教研室之前的研究基础上,本研究的实验结果进一步证明了PbPH有成为TBV候选疫苗的潜能。

